Gliederung 1 Einleitung 2 Geschichte 3 Vorkommen 4

























- Slides: 34


Gliederung 1. Einleitung 2. Geschichte 3. Vorkommen 4. Darstellung 5. Verwendung 6. 6. Elementares Silber 7. 7. Silberverbindungen 8. 8. Alltagsrelevanz – Schulrelevanz?

1. Einleitung • Ag (lat. argentum) • Namensgebend für Argentinien • Alchemie: Halbmond als chem. Symbol (der Mondgöttin Luna geweiht) • Cu, Ag, Au: Münzmetalle • Cu, Ag, Au und Platingruppenmetalle: Edelmetalle

2. Geschichte • 4000 v. Chr. : Silberentdeckung, Nebenprodukt bei der ägypischen Goldgewinnung • 3400 v. Chr. : Au/ Ag-Ringe als Zahlungsmittel • 700 v. Chr. : Beginn der Münzprägung in Griechenland • 16. Jh. n. Chr. : Blütezeit der mitteldeutschen Silberproduktion (Freiberg) • Um 1540: Entdeckung der Silbervorkommen in Südamerika • 19. Jh. : USA wird zweitgrößter Silberproduzent

2. Geschichte Versuch 1: Nachweis von Silber in Legierungen +1 Oxidation: Reduktion: 0 +6 +3 Chromat-Dichromat-Gleichgewicht: Fällung von schwerlöslichem Silberchromat Ag 2 Cr. O 4 (braunrot) und Silberdichromat Ag 2 Cr 2 O 7 (rot) Rautenförmige Kristalle


3. Vorkommen • Silbergehalt der Erdkruste: 0, 1 g/t (0, 1 ppm) „Silberlocke“ • Gediegen • Silbererze: Ag 2 S (Silberglanz, Argentit) Cu. Ag. S (Kupfersilberglanz) Argentit Ag. Cl (Hornsilber) • Silberhaltige Erze: Silber, kristallin Pb. S (Bleiglanz) enthält 0, 01 -1% Silber in Form von Ag 2 S Cu. Fe. S 2 (Kupferkies) Hornsilber

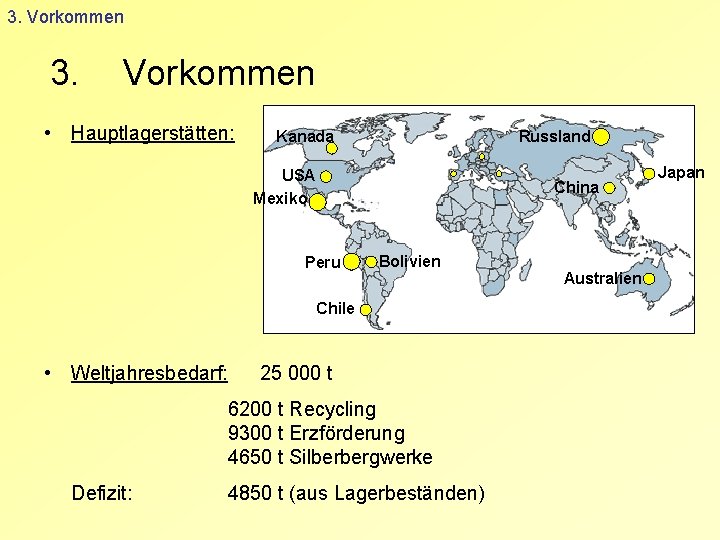
3. Vorkommen 3. Vorkommen • Hauptlagerstätten: Kanada Russland USA Mexiko China Peru Bolivien Chile • Weltjahresbedarf: 25 000 t 6200 t Recycling 9300 t Erzförderung 4650 t Silberbergwerke Defizit: 4850 t (aus Lagerbeständen) Australien Japan

4. Darstellung • Aus Silbererzen: Cyanidlaugerei Rohsilber • Aus Blei- und Kupfererzen: „Parkesieren“ „Pattinsonieren“ Kupellation Rohsilber • Feinreinigung: Elektrolytische Raffination Feinsilber • Rückgewinnung von Silber aus Sekundärrohstoffen

4. Darstellung Cyanidlaugerei • Ausgangsmaterial: Silbererze (Ag, Ag. Cl, Ag 2 S) • Gemahlenes Erz wird mit 0, 1 - 0, 2 %-iger heißer Natriumcyanidlösung unter Einblasen von Luft ausgelaugt: 0 +1 0 -0, 31 V 0 V Ag/[Ag(CN)2]- H 2/2 H+ 0, 40 V 2 OH-/O 2 (p. H 14) -2 0, 80 V Ag/Ag+

4. Darstellung Cyanidlaugerei • Hornsilber: • Silberglanz: -2 0 +6 -2 • Zementation: +1 0 +2 0 Rohsilber

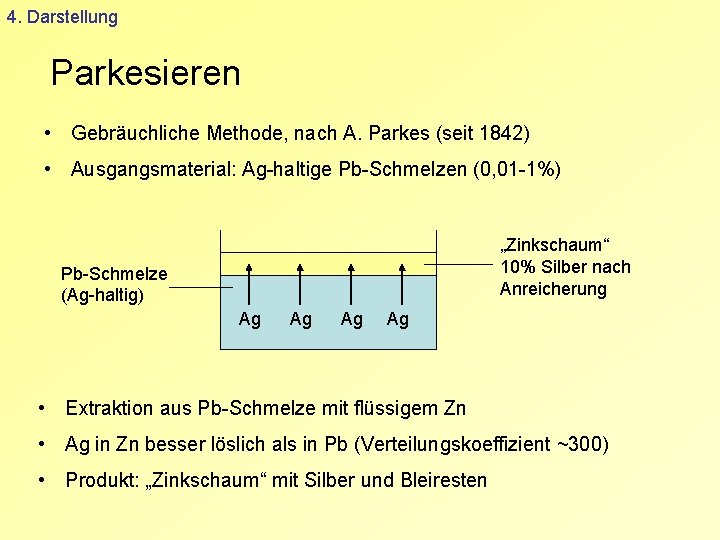
4. Darstellung Parkesieren • Gebräuchliche Methode, nach A. Parkes (seit 1842) • Ausgangsmaterial: Ag-haltige Pb-Schmelzen (0, 01 -1%) „Zinkschaum“ 10% Silber nach Anreicherung Pb-Schmelze (Ag-haltig) Ag Ag • Extraktion aus Pb-Schmelze mit flüssigem Zn • Ag in Zn besser löslich als in Pb (Verteilungskoeffizient ~300) • Produkt: „Zinkschaum“ mit Silber und Bleiresten

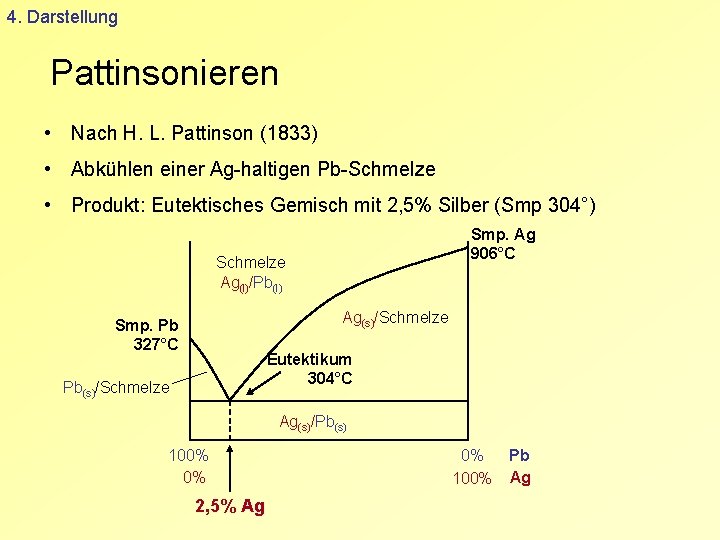
4. Darstellung Pattinsonieren • Nach H. L. Pattinson (1833) • Abkühlen einer Ag-haltigen Pb-Schmelze • Produkt: Eutektisches Gemisch mit 2, 5% Silber (Smp 304°) Smp. Ag 906°C Schmelze Ag(l)/Pb(l) Ag(s)/Schmelze Smp. Pb 327°C Eutektikum 304°C Pb(s)/Schmelze Ag(s)/Pb(s) 100% 0% 2, 5% Ag 0% 100% Pb Ag

4. Darstellung Isolierung des angereicherten Silbers: • Ausgangsmaterial: Produkte des Parkesierens bzw. Pattinsonierens • Treibarbeit („Kupellation“) überführt Pb in Pb. O, dieses wird flüssig abgezogen • Zink wird durch Destillation entfernt (Sdp. Zn: 908, 5 °C, Sdp. Ag: 2212°C) Rohsilber (95%)

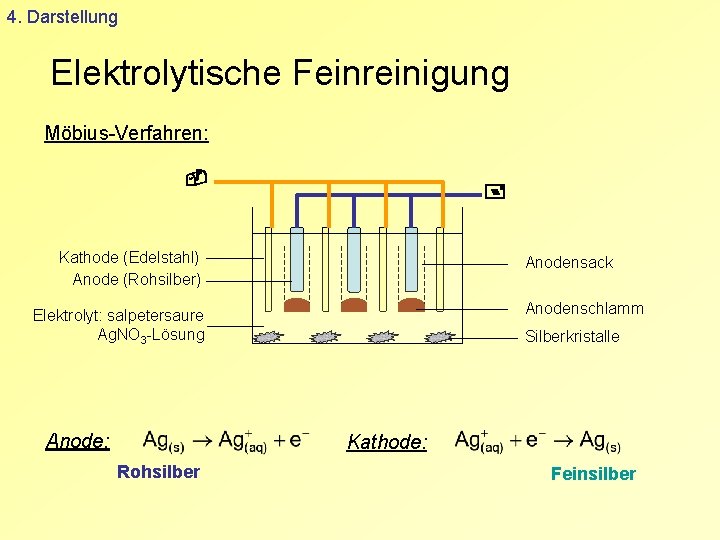
4. Darstellung Elektrolytische Feinreinigung Möbius-Verfahren: Kathode (Edelstahl) Anode (Rohsilber) Anodensack Anodenschlamm Elektrolyt: salpetersaure Ag. NO 3 -Lösung Anode: Silberkristalle Kathode: Rohsilber Feinsilber

4. Darstellung Versuch 2: Fraktale Silberstrukturen • Anode: • Kathode: -2 +1 0 0

4. Darstellung Feinsilber und Legierungen „Feinheit“ = Anteil des Silbers am Gesamtgewicht in Promille Feinsilber-Qualitäten: Feinheit 835 (83, 5 %): 835 Teile Feinsilber, 165 Teile Legierungsmetalle Feinheit 925 (92, 5 %): „Sterling-Silber“ Feinheit 999 (99, 9 %): Reines Feinsilber Preis: ca. 6 $ pro Feinunze (ca. 200 €/kg) 1 Feinunze (oz) = 31, 104 g

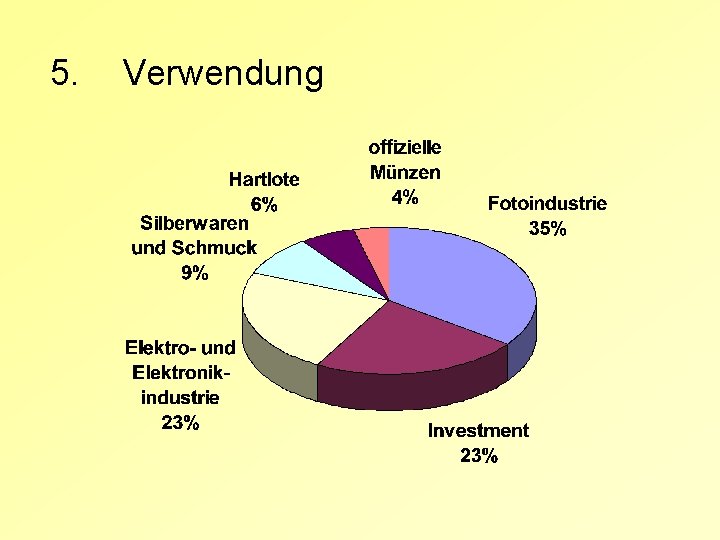
5. Verwendung

6. Elementares Silber Eigenschaften: • 1. Nebengruppe (11. Gruppe) • Isotope: 107 Ag (51, 83%) und 109 Ag (48, 17%) 47 107, 87 Ag Silber • Smp. 960, 8°C, Sdp. 2212°C • Kubisch dichteste Kugelpackung • Sehr duktil (Silberfolien, dünne Drähte) • Beste elektrische und Wärmeleitfähigkeit unter den Metallen [Kr] 4 d 10 5 s 1

6. Elementares Silber als Edelmetall • E 0 (Ag/Ag+) = +0, 7991 V • Oxidationsbeständig gegenüber Luft-O 2 • Bildung einer passivierenden, durchsichtigen Ag 2 O-Schicht (10 -20 nm) • Löst sich nur in oxidierenden Säuren (HNO 3) • „Anlaufen“ von Silber an der Luft unter Einwirkung schwefelhaltiger Spurengase

6. Elementares Silber Versuch 3: Sulfidieren einer Silbergabel • Reaktionsverlauf: 0 0 +1 -2 schwarz • Unter Einwirkung schwefelhaltiger Spurengase: 0 • 0 +1 -2 Begünstigte Adsorption und Reaktion der Spurengase an der Ag 2 O -Schicht

6. Elementares Silber Versuch 4: Reinigen einer angelaufenen Silbergabel Passivierung des Aluminiums wird aufgehoben: Oxidation des Aluminiums (E 0 (Al/Al 3+)= -1, 7 V): 0 +3 Reduktion von Ag 2 S: +1 0 Wasserstoffentwicklung: +1 0

6. Elementares Silber Antibakterielle Wirkung • Verunreinigungen (Lokalströme) und Ag 2 O-Schicht führen zur Löslichkeit des Silbers • Ag+ wirkt bakterizid, fungizid, antiseptisch • 2 g Ag+ sterilisieren 1 Mio. Kubikmeter Wasser Oligodynamische Wirkung • Wirkung: Blockade von Thioenzymen • Anwendungen: Chirurgische Instrumente Medikamente Essbesteck und -geschirr Trinkwasserreinigung

6. Elementares Silber Versuch 5: Nachweis von Silber in Trinkwasserfiltern • Trinkwasserfilter: mechanischer Filter Ionenaustauscher Aktivkohle Silber (als keimtötende Substanz) Aufschluss mit HNO 3: 0 +2 +5 0 +1 +4 -2 braun Nachweis als Ag. Cl: +2 farblos

6. Elementares Silber Versilbern • Galvanisches Versilbern von Metallgegenständen: Kathodische Abscheidung von Ag aus einer Lösung von K[Ag(CN)2] • Stromloses Versilbern: Bei unedleren Metallen möglich • Glasversilberung: Auf chemischem Wege, zur Spiegelherstellung

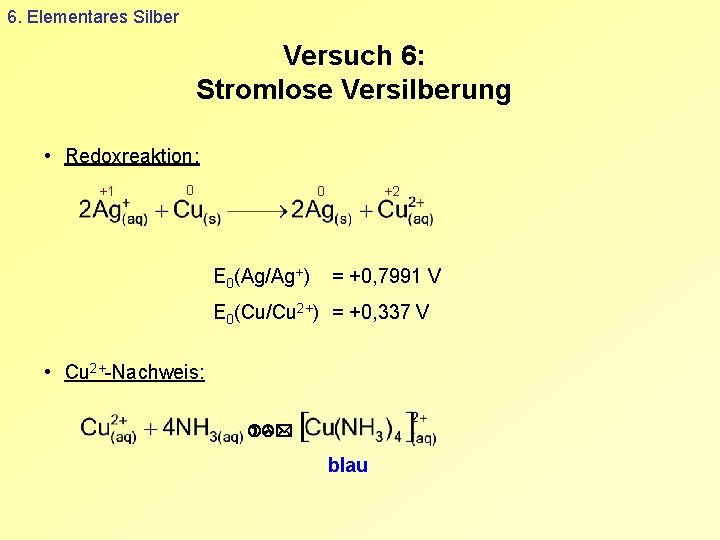
6. Elementares Silber Versuch 6: Stromlose Versilberung • Redoxreaktion: +1 0 0 E 0(Ag/Ag+) +2 = +0, 7991 V E 0(Cu/Cu 2+) = +0, 337 V • Cu 2+-Nachweis: blau

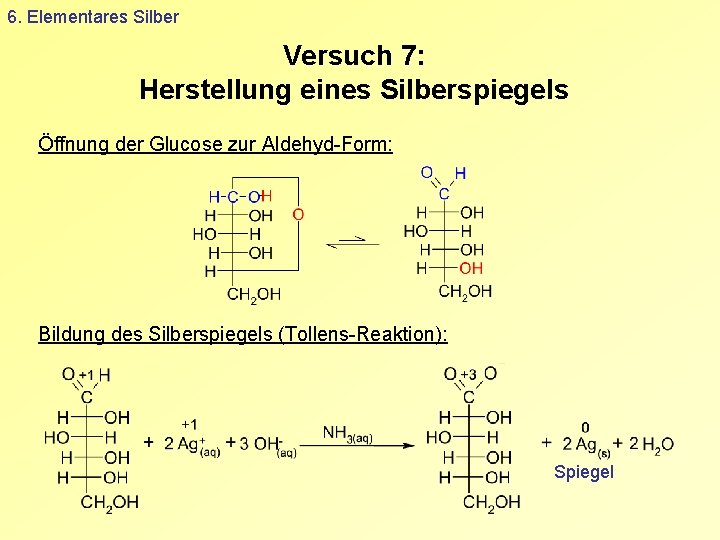
6. Elementares Silber Versuch 7: Herstellung eines Silberspiegels Öffnung der Glucose zur Aldehyd-Form: Bildung des Silberspiegels (Tollens-Reaktion): Spiegel

6. Elementares Silber Spiegelherstellung – Historisches • Altes Ägypten: polierte Bronze- und Kupferspiegel • Die Römer: Glas mit Gold und Lack beschichtet • Mittelalter (ab 13. Jh. ): Zinn-Amalgam-Spiegel • 1835, Justus v. Liebig: Silberspiegel • Heute: Silberspiegel mit Schutzschicht aus Kupfer oder nur mit Schutzlack

7. Silberverbindungen • Stabilste Oxidationsstufe: +1 • Oxidationsstufen +2, +3 sind selten (Bsp. : Ag. IIF 2, Ag. IIIO 2) • Elektronenkonfiguraton des Ag+: 4 d 10 • Farblos und diamagnetisch • Koordinationszahl in Ag(I)-Komplexen: 2 (lineare Anordnung der Liganden, Bsp. : [Ag(CN)2]-) • Lösliche Ag(I)-Salze: Ag. F, Ag. NO 3, Ag. Cl. O 4 • Der Rest: schwerlöslich (relevant: Silberhalogenide)

7. Silberverbindungen Silbernitrat – Ag. NO 3 • Wichtigstes Silbersalz • Ausgangsprodukt zur Herstellung aller anderen Silberverbindungen • Gut wasserlöslich (215 g/100 g Wasser bei 20°C) • Darstellung: Auflösen von Silber in Salpetersäure: 0 +5 +1 +2 • Wirkt auf der Haut oxidierend und ätzend, bildet schwarze Flecken. „Höllenstein“: Anwendung in der Medizin zur Entfernung von Warzen und Wucherungen Bildung von Ag (schwarz) und HNO 3

7. Silberverbindungen Schwerlösliche Silberhalogenide Darstellung: - Aus den Elementen - Durch Fällung aus Ag. NO 3 -Lösung mittels Halogenid Eigenschaften: Farbe Löslichkeitsprodukt KL [mol 2/L 2] Ag. Cl Weiß 1, 7 · 10 -10 Ag. Br Hellgelb 5 · 10 -13 Ag. I 8, 5 · 10 -17 Gelb • Kovalenter Charakter nimmt mit zunehmender OZ zu (HSAB): abnehmende Löslichkeit Farbvertiefung (Charge-Transfer) • Lichtempfindlichkeit

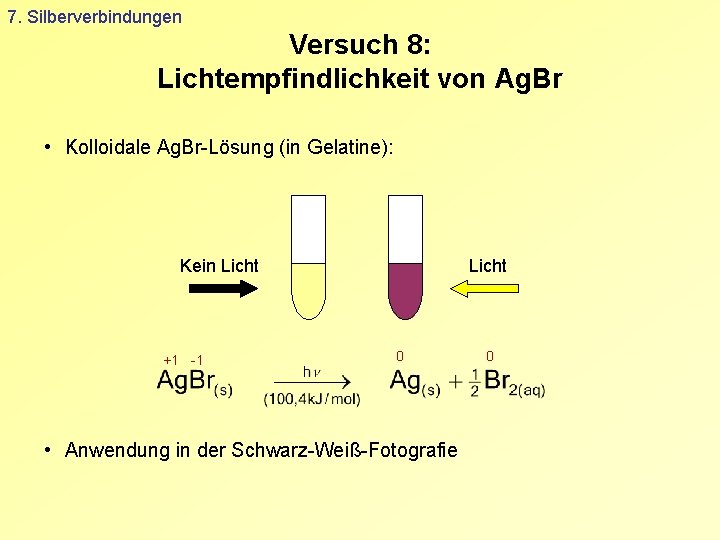
7. Silberverbindungen Versuch 8: Lichtempfindlichkeit von Ag. Br • Kolloidale Ag. Br-Lösung (in Gelatine): Kein Licht +1 -1 Licht 0 • Anwendung in der Schwarz-Weiß-Fotografie 0

8. Alltagsrelevanz – Schulrelevanz? Akkumulatoren Fotografie Recycling (Röntgenfilme, Elektroschrott) Elektronik, Elektrotechnik Haushalt (Trinkwasserfilter, Besteck) Schmuck Medizin

 Aluminium vorkommen
Aluminium vorkommen Kupfer steckbrief
Kupfer steckbrief Eigenschaften der halogene
Eigenschaften der halogene Gliederung biographie
Gliederung biographie Mitarbeiterbindung gliederung
Mitarbeiterbindung gliederung Divisionale gliederung
Divisionale gliederung Weg der wissenschaftlichen erkenntnisgewinnung
Weg der wissenschaftlichen erkenntnisgewinnung Horizontale gliederung fachsprache
Horizontale gliederung fachsprache Apollinisch dionysisch schelling
Apollinisch dionysisch schelling Gliederung des wortschatzes
Gliederung des wortschatzes Gutachterliche stellungnahme aufbau
Gutachterliche stellungnahme aufbau Fallstudie gliederung beispiel
Fallstudie gliederung beispiel Gliederung foto
Gliederung foto Projektstrukturplan gliederung
Projektstrukturplan gliederung Motivationsschreiben gliederung
Motivationsschreiben gliederung Biografie gliederung
Biografie gliederung Abschreibung rechnungswesen
Abschreibung rechnungswesen Definition autoritärer führungsstil
Definition autoritärer führungsstil Gliederung mathematik
Gliederung mathematik Michel de certeau
Michel de certeau W-seminar bayern gliederung
W-seminar bayern gliederung Klimawandel gliederung
Klimawandel gliederung Unversteuerte rücklagen definition
Unversteuerte rücklagen definition Gliederung facharbeit
Gliederung facharbeit Der filialleiter inhaltsangabe
Der filialleiter inhaltsangabe Vertikale gliederung fachsprache
Vertikale gliederung fachsprache Standardschätzfehler regression
Standardschätzfehler regression Volxbibel matthäus 5
Volxbibel matthäus 5 Gliederung qualitative forschung
Gliederung qualitative forschung Gliederung in niveaus
Gliederung in niveaus Gluconeogenese
Gluconeogenese Leise begleitung rainer maria rilke
Leise begleitung rainer maria rilke Gliederung gif
Gliederung gif Präsentation einleitung
Präsentation einleitung Einleitung textanalyse
Einleitung textanalyse