Fondamenti di chimica organica Janice Gorzynski Smith University




![Acidi Carbossilici e l’Acidità del legame O—H Preparazione degli Acidi Carbossilici [1] Ossidazione di Acidi Carbossilici e l’Acidità del legame O—H Preparazione degli Acidi Carbossilici [1] Ossidazione di](https://slidetodoc.com/presentation_image/4bbc90da80b99960db351cf2d4d3914e/image-7.jpg)
![Acidi Carbossilici e l’Acidità del legame O—H Preparazione degli Acidi Carbossilici [3] Rottura Ossidativa Acidi Carbossilici e l’Acidità del legame O—H Preparazione degli Acidi Carbossilici [3] Rottura Ossidativa](https://slidetodoc.com/presentation_image/4bbc90da80b99960db351cf2d4d3914e/image-8.jpg)


![Acidi Carbossilici e l’Acidità del legame O—H Acidi Benzoici Sostituiti [2] I gruppi attrattori Acidi Carbossilici e l’Acidità del legame O—H Acidi Benzoici Sostituiti [2] I gruppi attrattori](https://slidetodoc.com/presentation_image/4bbc90da80b99960db351cf2d4d3914e/image-23.jpg)




- Slides: 38

Fondamenti di chimica organica Janice Gorzynski Smith University of Hawai’i Capitolo 17 Acidi carbossilici e l’acidità del legame O-H Prepared by Rabi Ann Musah State University of New York at Albany Copyright © The Mc. Graw-Hill Companies, Inc. Permission required for reproduction or display. Fondamenti di chimica organica Janice Gorzynski Smith 1 Copyright © 2009 – The Mc. Graw-Hill Companies srl

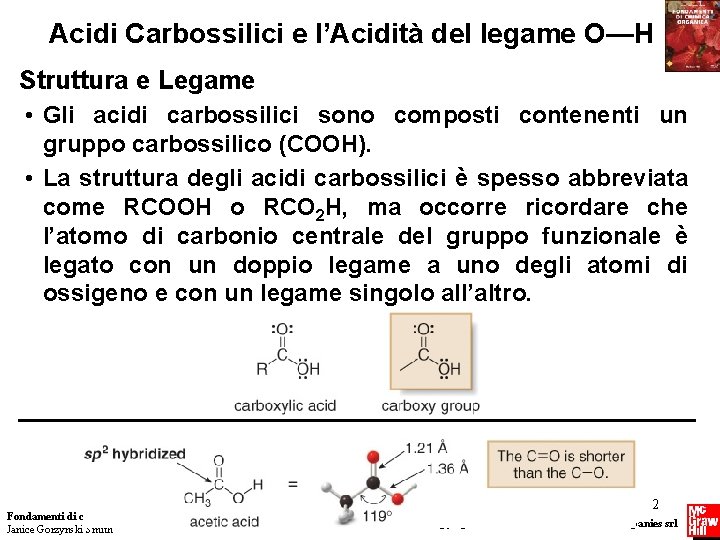
Acidi Carbossilici e l’Acidità del legame O—H Struttura e Legame • Gli acidi carbossilici sono composti contenenti un gruppo carbossilico (COOH). • La struttura degli acidi carbossilici è spesso abbreviata come RCOOH o RCO 2 H, ma occorre ricordare che l’atomo di carbonio centrale del gruppo funzionale è legato con un doppio legame a uno degli atomi di ossigeno e con un legame singolo all’altro. Fondamenti di chimica organica Janice Gorzynski Smith 2 Copyright © 2009 – The Mc. Graw-Hill Companies srl

Acidi Carbossilici e l’Acidità del legame O—H Nomenclatura—Il Sistema IUPAC • Nel sistema IUPAC gli acidi carbossilici sono contraddistinti da un suffisso, aggiunto al nome della catena carboniosa più lunga, e si usano due diverse terminazioni del nome a seconda che il gruppo carbossilico sia legato a una catena o a un anello. Se il COOH è legato a una catena, trovare la catena più lunga che contiene il COOH, e cambiare la desinenza “o” dell’alcano corrispondente nel suffisso “oico”, premettendo il termine “acido”. Se il COOH è legato a un anello, denominare l’anello e aggiungere all’inizio il termine “acido” e alla fine il termine “carbossilico”. Numerare la catena carboniosa o l’anello in modo che il gruppo COOH sia il C 1, ma omettere questo numero dal nome. Applicare poi tutte le altre regole di nomenclatura. Fondamenti di chimica organica Janice Gorzynski Smith 3 Copyright © 2009 – The Mc. Graw-Hill Companies srl

Acidi Carbossilici e l’Acidità del legame O—H Nomenclatura Fondamenti di chimica organica Janice Gorzynski Smith 4 Copyright © 2009 – The Mc. Graw-Hill Companies srl

Acidi Carbossilici e l’Acidità del legame O—H Nomenclatura • Nei nomi comuni sono usate lettere greche per definire la posizione dei sostituenti. • Il carbonio adiacente al COOH è chiamato carbonio , seguito dal carbonio , quindi dal carbonio , dal carbonio e così via lungo la catena. • L’ultimo carbonio della catena è talvolta chiamato carbonio . • Il carbonio nei sistemi comuni è contrassegnato, nel sistema IUPAC, dal numero 2 (C 2). Fondamenti di chimica organica Janice Gorzynski Smith 5 Copyright © 2009 – The Mc. Graw-Hill Companies srl

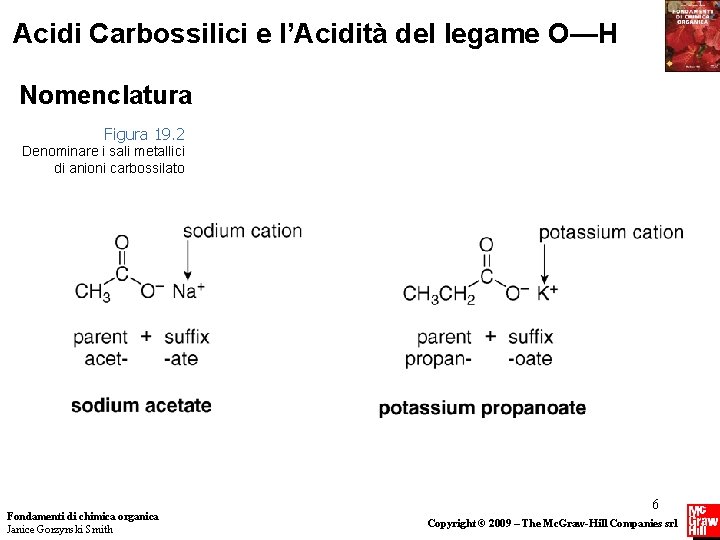
Acidi Carbossilici e l’Acidità del legame O—H Nomenclatura Figura 19. 2 Denominare i sali metallici di anioni carbossilato Fondamenti di chimica organica Janice Gorzynski Smith 6 Copyright © 2009 – The Mc. Graw-Hill Companies srl
![Acidi Carbossilici e lAcidità del legame OH Preparazione degli Acidi Carbossilici 1 Ossidazione di Acidi Carbossilici e l’Acidità del legame O—H Preparazione degli Acidi Carbossilici [1] Ossidazione di](https://slidetodoc.com/presentation_image/4bbc90da80b99960db351cf2d4d3914e/image-7.jpg)
Acidi Carbossilici e l’Acidità del legame O—H Preparazione degli Acidi Carbossilici [1] Ossidazione di alcoli 1° [2] Ossidazione di alchilbenzeni Fondamenti di chimica organica Janice Gorzynski Smith 7 Copyright © 2009 – The Mc. Graw-Hill Companies srl
![Acidi Carbossilici e lAcidità del legame OH Preparazione degli Acidi Carbossilici 3 Rottura Ossidativa Acidi Carbossilici e l’Acidità del legame O—H Preparazione degli Acidi Carbossilici [3] Rottura Ossidativa](https://slidetodoc.com/presentation_image/4bbc90da80b99960db351cf2d4d3914e/image-8.jpg)
Acidi Carbossilici e l’Acidità del legame O—H Preparazione degli Acidi Carbossilici [3] Rottura Ossidativa degli Alchini Fondamenti di chimica organica Janice Gorzynski Smith 8 Copyright © 2009 – The Mc. Graw-Hill Companies srl

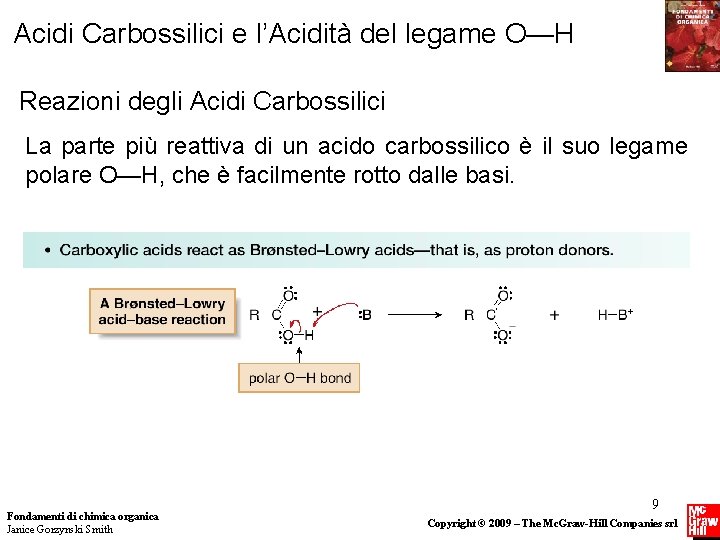
Acidi Carbossilici e l’Acidità del legame O—H Reazioni degli Acidi Carbossilici La parte più reattiva di un acido carbossilico è il suo legame polare O—H, che è facilmente rotto dalle basi. Fondamenti di chimica organica Janice Gorzynski Smith 9 Copyright © 2009 – The Mc. Graw-Hill Companies srl

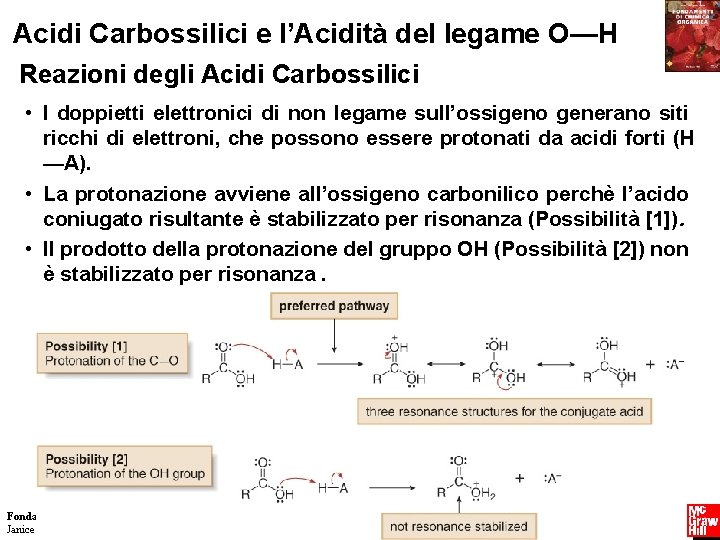
Acidi Carbossilici e l’Acidità del legame O—H Reazioni degli Acidi Carbossilici • I doppietti elettronici di non legame sull’ossigeno generano siti ricchi di elettroni, che possono essere protonati da acidi forti (H —A). • La protonazione avviene all’ossigeno carbonilico perchè l’acido coniugato risultante è stabilizzato per risonanza (Possibilità [1]). • Il prodotto della protonazione del gruppo OH (Possibilità [2]) non è stabilizzato per risonanza. Fondamenti di chimica organica Janice Gorzynski Smith 10 Copyright © 2009 – The Mc. Graw-Hill Companies srl

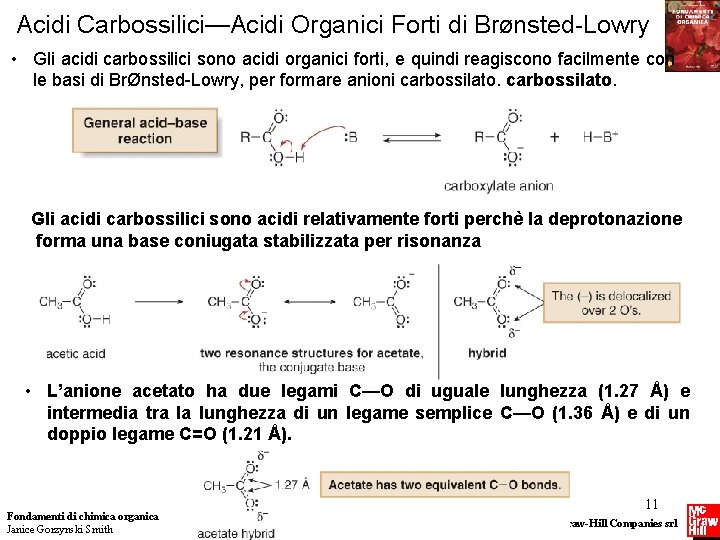
Acidi Carbossilici—Acidi Organici Forti di BrØnsted-Lowry • Gli acidi carbossilici sono acidi organici forti, e quindi reagiscono facilmente con le basi di BrØnsted-Lowry, per formare anioni carbossilato. Gli acidi carbossilici sono acidi relativamente forti perchè la deprotonazione forma una base coniugata stabilizzata per risonanza • L’anione acetato ha due legami C—O di uguale lunghezza (1. 27 Å) e intermedia tra la lunghezza di un legame semplice C—O (1. 36 Å) e di un doppio legame C=O (1. 21 Å). Fondamenti di chimica organica Janice Gorzynski Smith 11 Copyright © 2009 – The Mc. Graw-Hill Companies srl

Acidi Carbossilici—Acidi Organici Forti di BrØnsted-Lowry • Un acido può essere deprotonato da una base, il cui acido coniugato abbia p. Ka più alto. • Poiché il valore di p. Ka di molti acidi carbossilici è ~5, le basi il cui acido coniugato ha un valore di p. Ka maggiore di 5 sono sofficientemente forti da deprotonarlo. • Un acido carbossilico può essere deprotonato sia dall’idrossido di sodio (Na. OH, base forte) che dal bicarbonato di sodio (Na. HCO 3, base debole) Fondamenti di chimica organica Janice Gorzynski Smith 12 Copyright © 2009 – The Mc. Graw-Hill Companies srl

Acidi Carbossilici e l’Acidità del legame O—H Acidi Carbossilici—Acidi Organici Forti di BrØnsted-Lowry Fondamenti di chimica organica Janice Gorzynski Smith 13 Copyright © 2009 – The Mc. Graw-Hill Companies srl

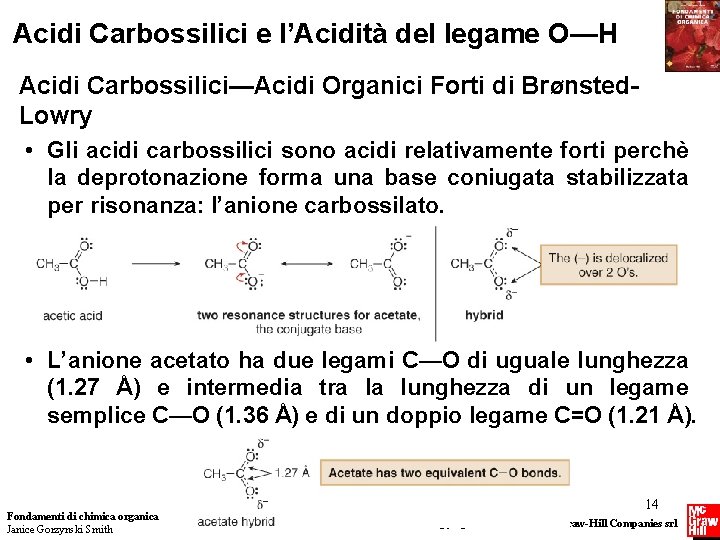
Acidi Carbossilici e l’Acidità del legame O—H Acidi Carbossilici—Acidi Organici Forti di BrØnsted. Lowry • Gli acidi carbossilici sono acidi relativamente forti perchè la deprotonazione forma una base coniugata stabilizzata per risonanza: l’anione carbossilato. • L’anione acetato ha due legami C—O di uguale lunghezza (1. 27 Å) e intermedia tra la lunghezza di un legame semplice C—O (1. 36 Å) e di un doppio legame C=O (1. 21 Å). Fondamenti di chimica organica Janice Gorzynski Smith 14 Copyright © 2009 – The Mc. Graw-Hill Companies srl

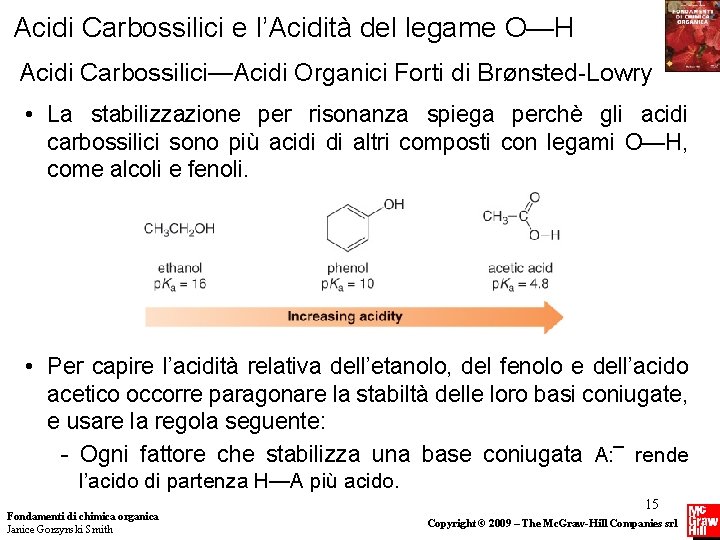
Acidi Carbossilici e l’Acidità del legame O—H Acidi Carbossilici—Acidi Organici Forti di BrØnsted-Lowry • La stabilizzazione per risonanza spiega perchè gli acidi carbossilici sono più acidi di altri composti con legami O—H, come alcoli e fenoli. • Per capire l’acidità relativa dell’etanolo, del fenolo e dell’acido acetico occorre paragonare la stabiltà delle loro basi coniugate, e usare la regola seguente: - Ogni fattore che stabilizza una base coniugata A: ¯ rende l’acido di partenza H—A più acido. Fondamenti di chimica organica Janice Gorzynski Smith 15 Copyright © 2009 – The Mc. Graw-Hill Companies srl

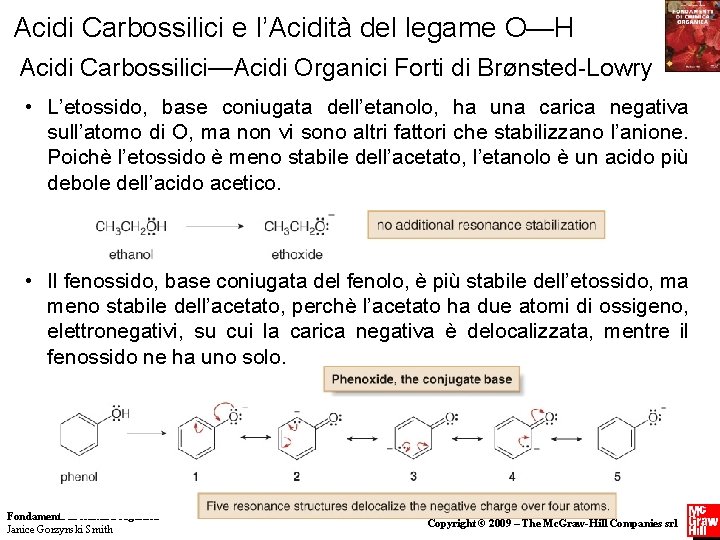
Acidi Carbossilici e l’Acidità del legame O—H Acidi Carbossilici—Acidi Organici Forti di BrØnsted-Lowry • L’etossido, base coniugata dell’etanolo, ha una carica negativa sull’atomo di O, ma non vi sono altri fattori che stabilizzano l’anione. Poichè l’etossido è meno stabile dell’acetato, l’etanolo è un acido più debole dell’acido acetico. • Il fenossido, base coniugata del fenolo, è più stabile dell’etossido, ma meno stabile dell’acetato, perchè l’acetato ha due atomi di ossigeno, elettronegativi, su cui la carica negativa è delocalizzata, mentre il fenossido ne ha uno solo. Fondamenti di chimica organica Janice Gorzynski Smith 16 Copyright © 2009 – The Mc. Graw-Hill Companies srl

Acidi Carbossilici e l’Acidità del legame O—H Acidi Carbossilici—Acidi Organici Forti di BrØnsted-Lowry Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The Mc. Graw-Hill Companies srl

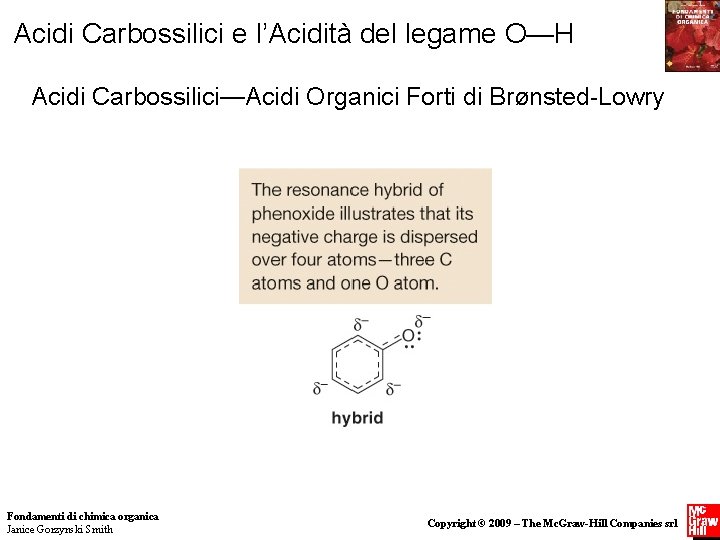
Acidi Carbossilici e l’Acidità del legame O—H Acidi Carbossilici—Acidi Organici Forti di BrØnsted-Lowry Figura 19. 3 Energie relative delle cinque strutture di risonanza del fenossido e il suo ibrido • Le strutture 2 -4 hanno la carica negativa sul carbonio, un atomo meno elettronegativo dell’ossigeno. Le strutture 2 -4 sono quindi meno stabili delle strutture 1 e 5. • Le strutture 1 e 5 hanno anelli aromatici intatti, mentre le strutture 2 -4 non ne hanno. Anche questo rende le strutture 2 -4 18 meno stabili di 1 e 5. Fondamenti di chimica organica Copyright © 2009 – The Mc. Graw-Hill Companies srl Janice Gorzynski Smith

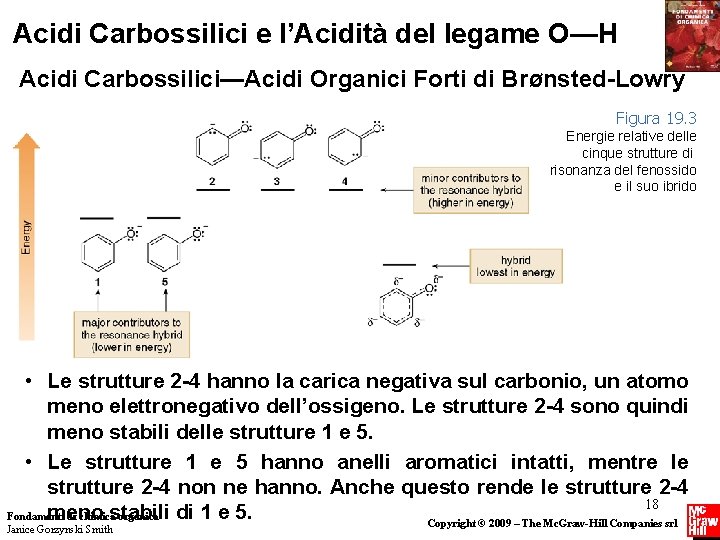
Acidi Carbossilici e l’Acidità del legame O—H Acidi Carbossilici—Acidi Organici Forti di BrØnsted-Lowry Figura 19. 4 Riassunto: La relazione tra acidità e stabilità della base coniugata per l’acido acetico, il fenolo e l’etanolo • Notare che, sebbene la stabilizzazione per risonanza della base coniugata sia importante per determinare l’acidità, il numero 19 assoluto delle strutture di risonanza da solo non è significativo. Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The Mc. Graw-Hill Companies srl

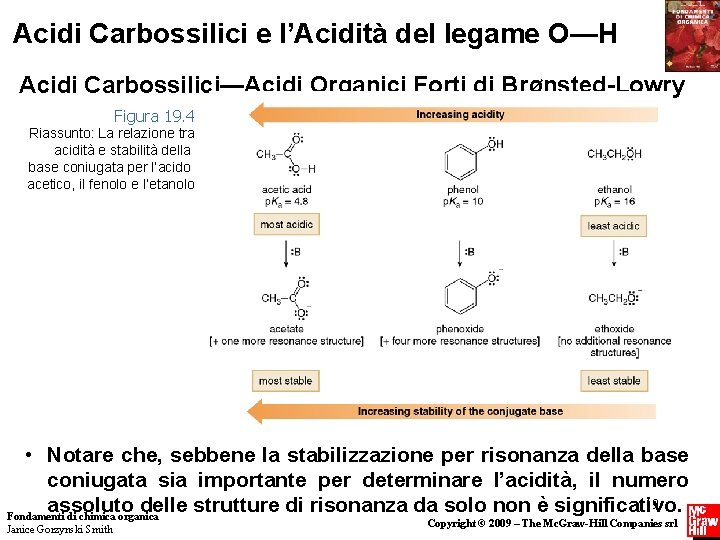
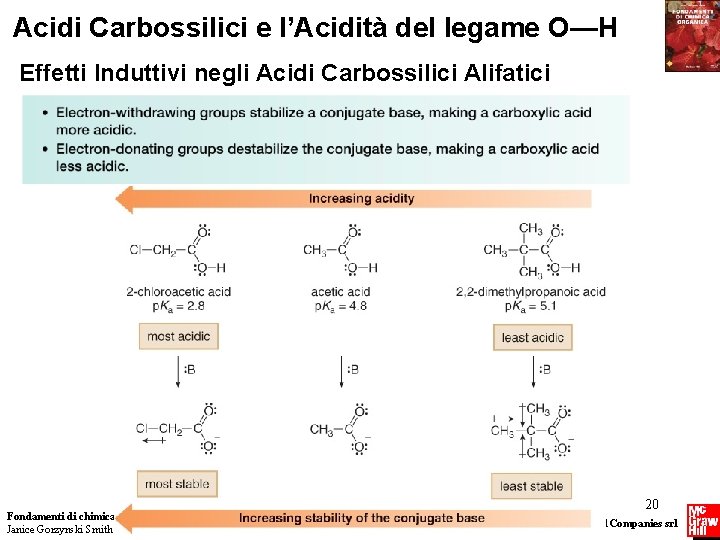
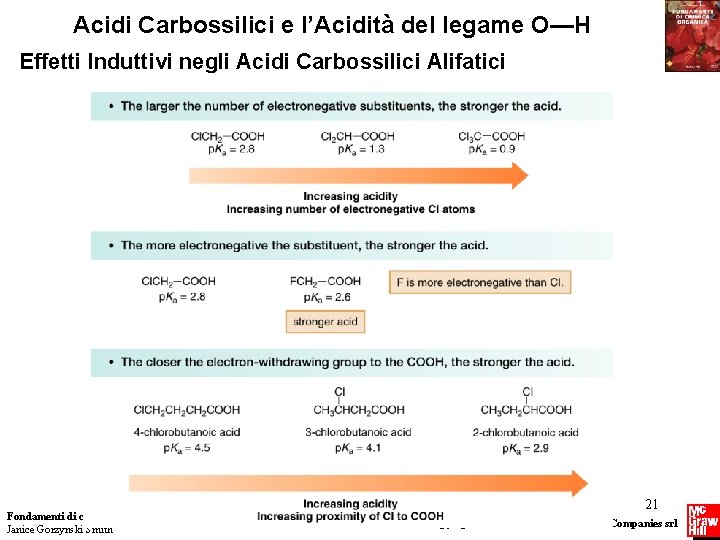
Acidi Carbossilici e l’Acidità del legame O—H Effetti Induttivi negli Acidi Carbossilici Alifatici Fondamenti di chimica organica Janice Gorzynski Smith 20 Copyright © 2009 – The Mc. Graw-Hill Companies srl

Acidi Carbossilici e l’Acidità del legame O—H Effetti Induttivi negli Acidi Carbossilici Alifatici Fondamenti di chimica organica Janice Gorzynski Smith 21 Copyright © 2009 – The Mc. Graw-Hill Companies srl

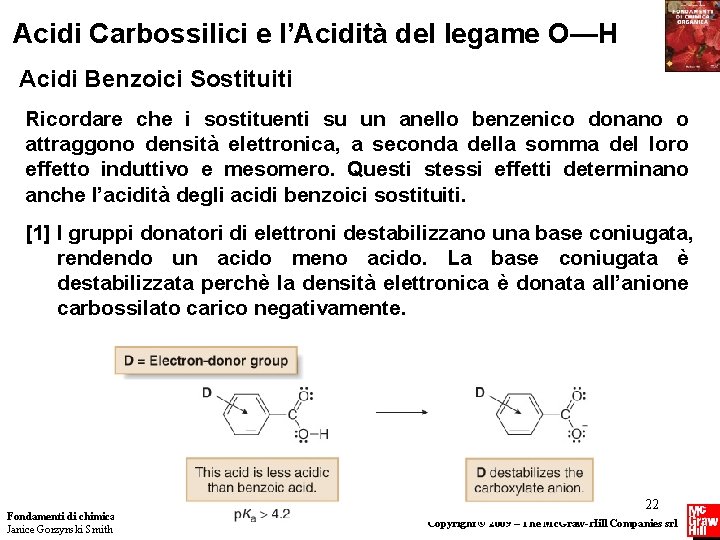
Acidi Carbossilici e l’Acidità del legame O—H Acidi Benzoici Sostituiti Ricordare che i sostituenti su un anello benzenico donano o attraggono densità elettronica, a seconda della somma del loro effetto induttivo e mesomero. Questi stessi effetti determinano anche l’acidità degli acidi benzoici sostituiti. [1] I gruppi donatori di elettroni destabilizzano una base coniugata, rendendo un acido meno acido. La base coniugata è destabilizzata perchè la densità elettronica è donata all’anione carbossilato carico negativamente. Fondamenti di chimica organica Janice Gorzynski Smith 22 Copyright © 2009 – The Mc. Graw-Hill Companies srl
![Acidi Carbossilici e lAcidità del legame OH Acidi Benzoici Sostituiti 2 I gruppi attrattori Acidi Carbossilici e l’Acidità del legame O—H Acidi Benzoici Sostituiti [2] I gruppi attrattori](https://slidetodoc.com/presentation_image/4bbc90da80b99960db351cf2d4d3914e/image-23.jpg)
Acidi Carbossilici e l’Acidità del legame O—H Acidi Benzoici Sostituiti [2] I gruppi attrattori di elettroni stabilizzano la base coniugata, rendendo un acido più acido. La base coniugata è stabilizzata perchè la densità elettronica è rimossa dall’anione carbossilato, carico negativamente. Fondamenti di chimica organica Janice Gorzynski Smith 23 Copyright © 2009 – The Mc. Graw-Hill Companies srl

Acidi Carbossilici e l’Acidità del legame O—H Acidi Benzoici Sostituiti Figura 19. 5 Come i più comuni sostituenti influenzano la reattività di un benzene con gli elettrofili e l’acidità degli acidi benzoici sostituiti Fondamenti di chimica organica Janice Gorzynski Smith 24 Copyright © 2009 – The Mc. Graw-Hill Companies srl

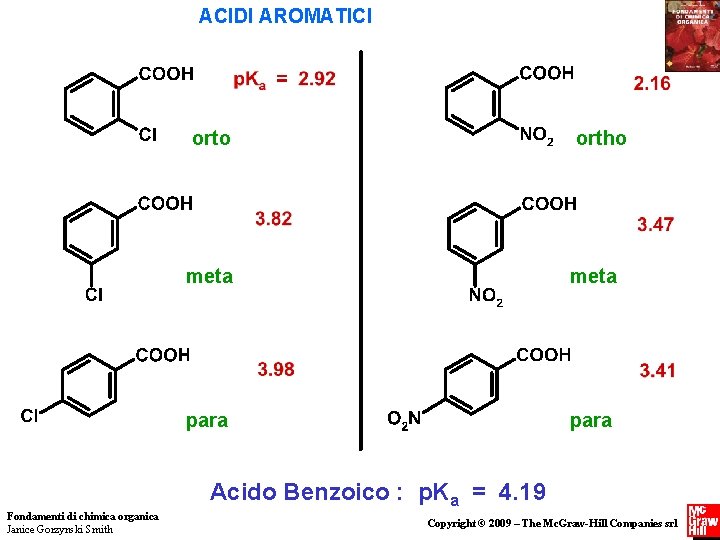
ACIDI AROMATICI orto ortho meta para Acido Benzoico : p. Ka = 4. 19 Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The Mc. Graw-Hill Companies srl

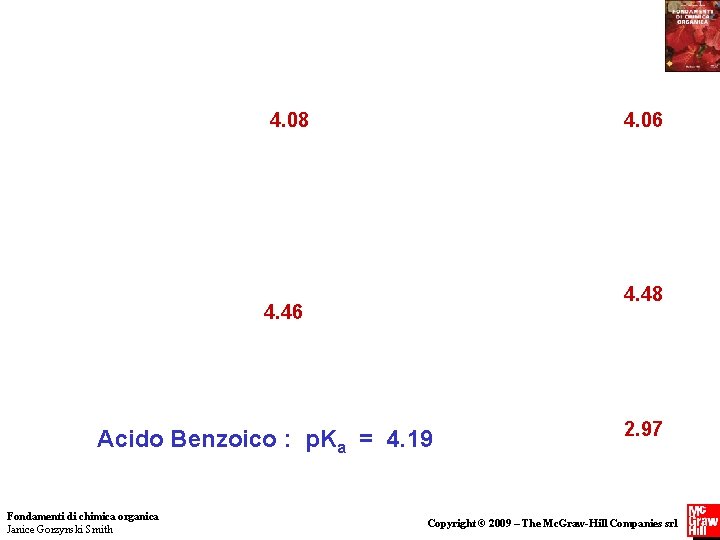
4. 08 4. 06 4. 48 4. 46 Benzoic Acid: p. K = a 4. 19 Acido Benzoico : ap. K = 4. 19 Fondamenti di chimica organica Janice Gorzynski Smith 2. 97 Copyright © 2009 – The Mc. Graw-Hill Companies srl

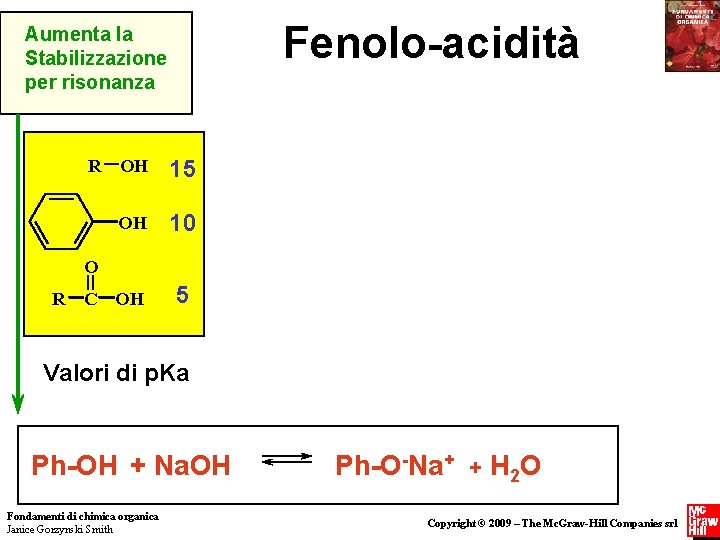
Fenolo-acidità Aumenta la Stabilizzazione per risonanza R OH 15 OH 10 O R C OH 5 Valori di p. Ka Ph-OH + Na. OH Fondamenti di chimica organica Janice Gorzynski Smith Ph-O-Na+ + H 2 O Copyright © 2009 – The Mc. Graw-Hill Companies srl

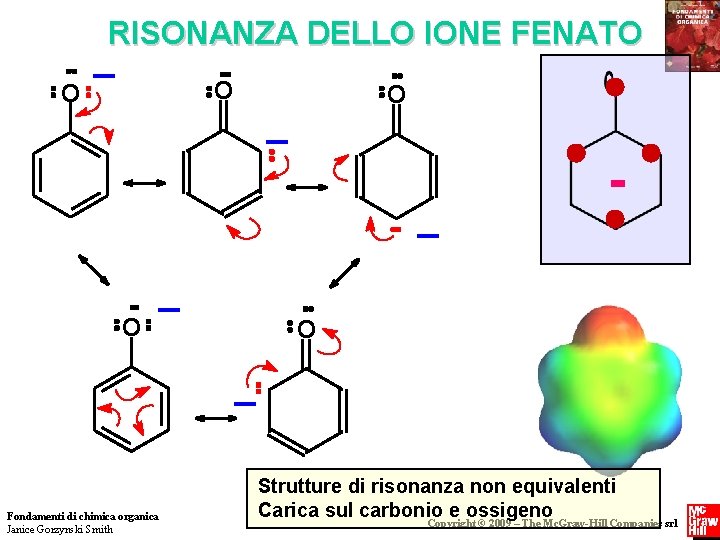
RISONANZA DELLO IONE FENATO _ O O O _ _ - _ O O _ Fondamenti di chimica organica Janice Gorzynski Smith Strutture di risonanza non equivalenti Carica sul carbonio e ossigeno Copyright © 2009 – The Mc. Graw-Hill Companies srl

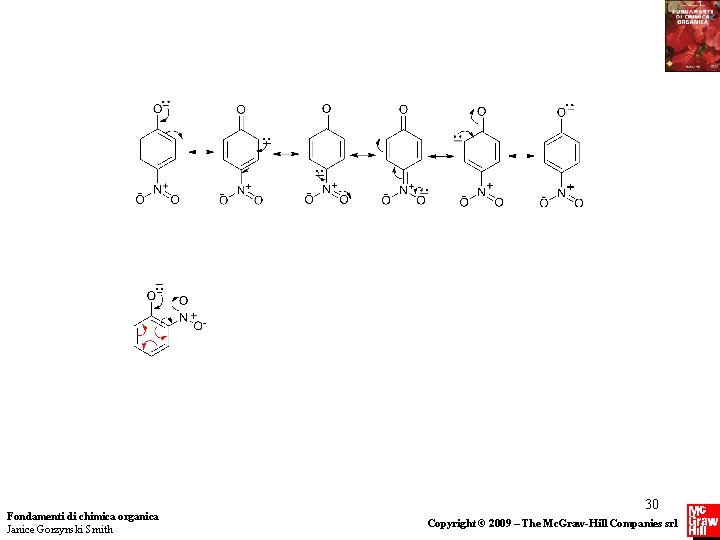
NITROFENOLI La presenza di un nitro gruppo sull’ anello benzenico di un fenolo ne aumenta l’ acidità. L’effetto è massimo se il nitrogruppo è in posizione orto o para rispetto all’ OH, molto minore se in posizione meta. Più nitro gruppi nelle posizioni orto e para diminuiscono il p. Ka del fenolo fino al punto che questo può divenire un acido forte. Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The Mc. Graw-Hill Companies srl

Fondamenti di chimica organica Janice Gorzynski Smith 30 Copyright © 2009 – The Mc. Graw-Hill Companies srl

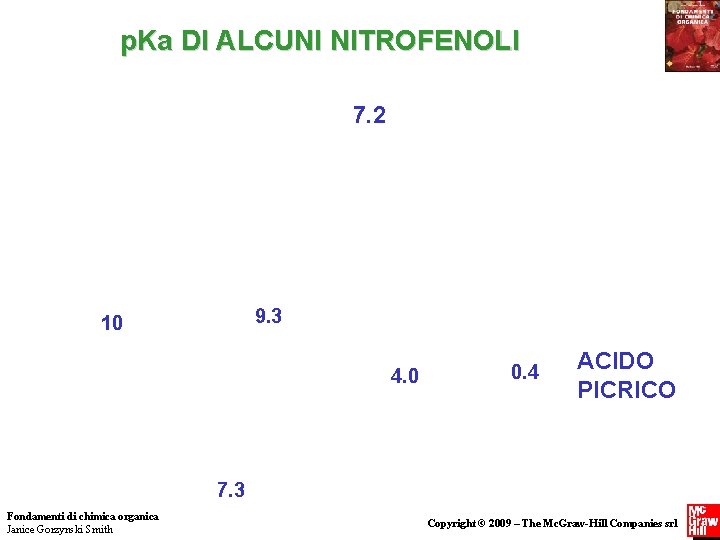
p. Ka DI ALCUNI NITROFENOLI 7. 2 9. 3 10 4. 0 0. 4 ACIDO PICRICO 7. 3 Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The Mc. Graw-Hill Companies srl

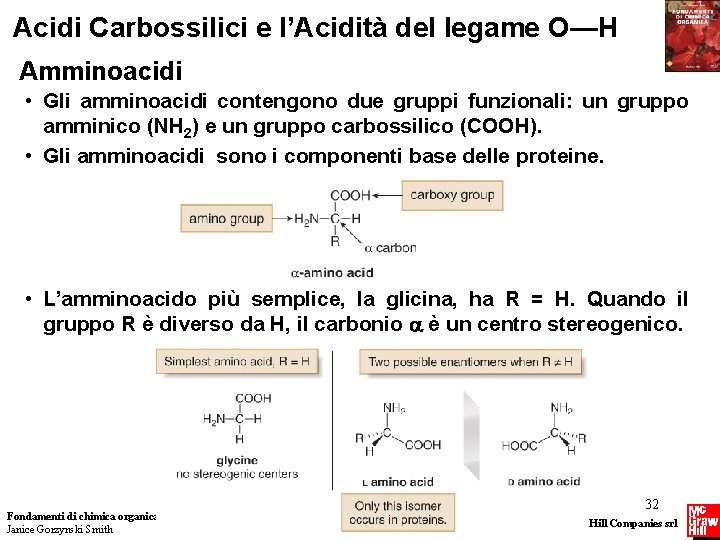
Acidi Carbossilici e l’Acidità del legame O—H Amminoacidi • Gli amminoacidi contengono due gruppi funzionali: un gruppo amminico (NH 2) e un gruppo carbossilico (COOH). • Gli amminoacidi sono i componenti base delle proteine. • L’amminoacido più semplice, la glicina, ha R = H. Quando il gruppo R è diverso da H, il carbonio è un centro stereogenico. Fondamenti di chimica organica Janice Gorzynski Smith 32 Copyright © 2009 – The Mc. Graw-Hill Companies srl

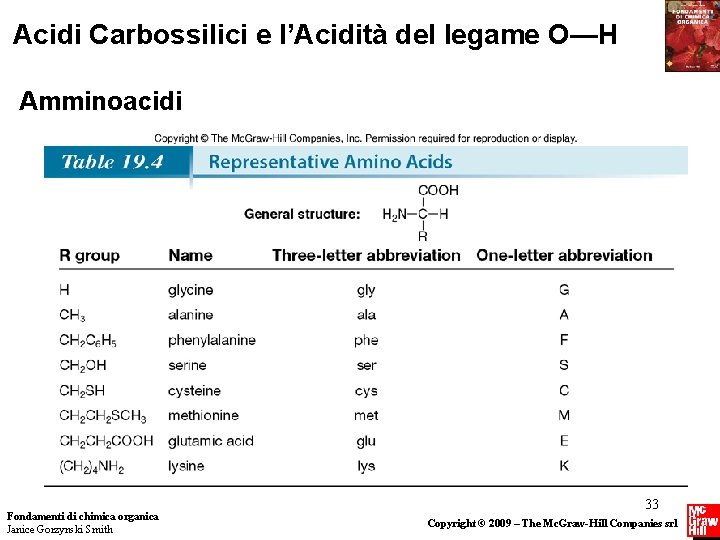
Acidi Carbossilici e l’Acidità del legame O—H Amminoacidi Fondamenti di chimica organica Janice Gorzynski Smith 33 Copyright © 2009 – The Mc. Graw-Hill Companies srl

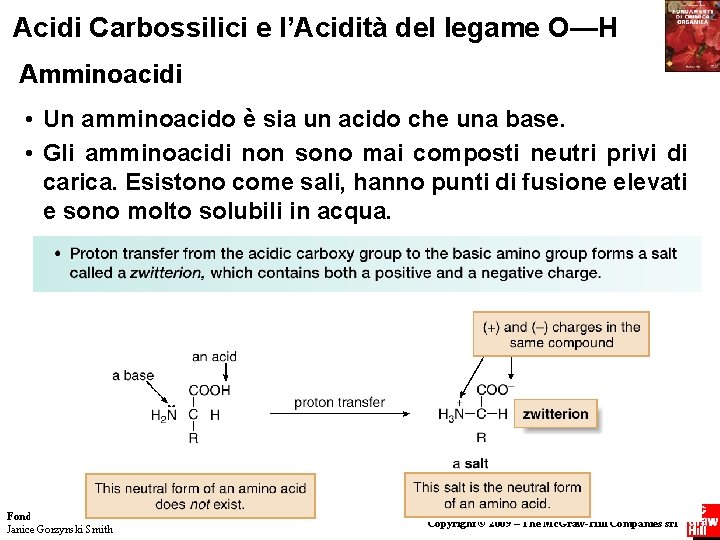
Acidi Carbossilici e l’Acidità del legame O—H Amminoacidi • Un amminoacido è sia un acido che una base. • Gli amminoacidi non sono mai composti neutri privi di carica. Esistono come sali, hanno punti di fusione elevati e sono molto solubili in acqua. Fondamenti di chimica organica Janice Gorzynski Smith 34 Copyright © 2009 – The Mc. Graw-Hill Companies srl

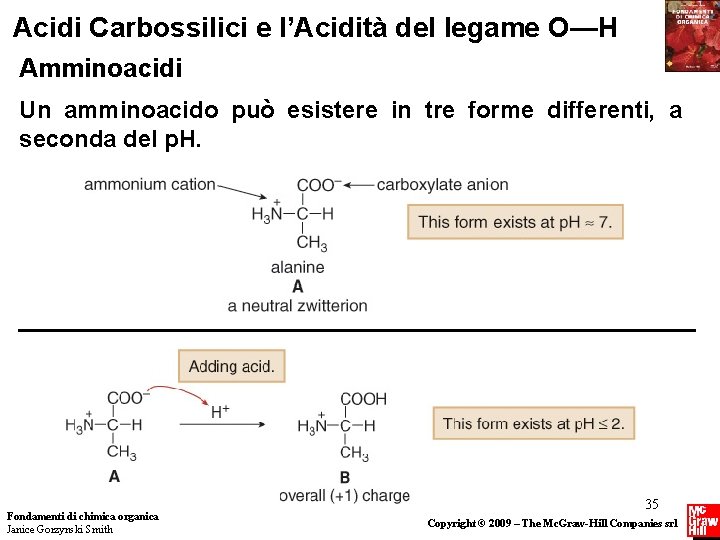
Acidi Carbossilici e l’Acidità del legame O—H Amminoacidi Un amminoacido può esistere in tre forme differenti, a seconda del p. H. Fondamenti di chimica organica Janice Gorzynski Smith 35 Copyright © 2009 – The Mc. Graw-Hill Companies srl

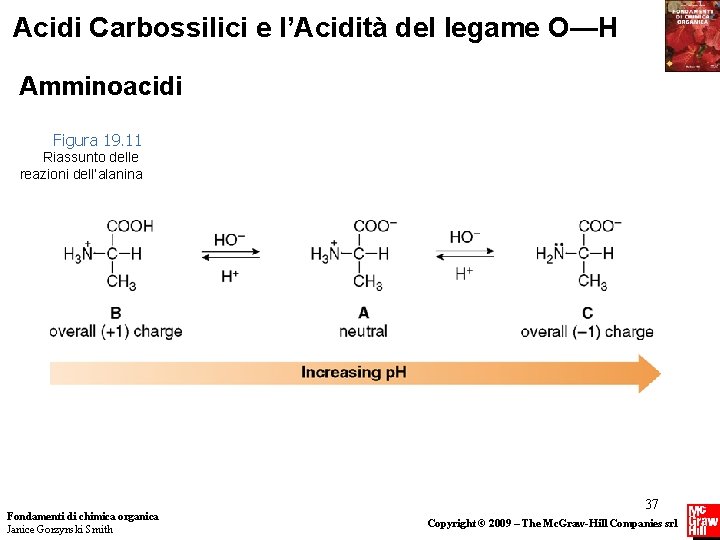
Acidi Carbossilici e l’Acidità del legame O—H Amminoacidi Quindi l’alanina esiste in tre forme differenti, a seconda del p. H della soluzione in cui è sciolta. Se il p. H della soluzione è gradualmente aumentato da 2 a 10, avviene il seguente processo: Fondamenti di chimica organica Janice Gorzynski Smith 36 Copyright © 2009 – The Mc. Graw-Hill Companies srl

Acidi Carbossilici e l’Acidità del legame O—H Amminoacidi Figura 19. 11 Riassunto delle reazioni dell’alanina Fondamenti di chimica organica Janice Gorzynski Smith 37 Copyright © 2009 – The Mc. Graw-Hill Companies srl

Acidi Carbossilici e l’Acidità del legame O—H Amminoacidi — Punto Isoelettrico Poichè un amminoacido protonato ha almeno due protoni differenti rimuovibili, è riportato il valore di p. Ka per ciascuno di questi protoni. Fondamenti di chimica organica Janice Gorzynski Smith 38 Copyright © 2009 – The Mc. Graw-Hill Companies srl
 Chimica organica
Chimica organica Janice gorzynski smith
Janice gorzynski smith Janice smith
Janice smith Alcani alcheni alchini mappa concettuale
Alcani alcheni alchini mappa concettuale Formula di struttura alcani
Formula di struttura alcani I gruppi funzionali
I gruppi funzionali Carbonio metabolismo biotech soluzioni
Carbonio metabolismo biotech soluzioni Alcani alcheni alchini
Alcani alcheni alchini Funzione delle proteine
Funzione delle proteine Chimica organica
Chimica organica Chimica organica
Chimica organica Gruppi alchilici
Gruppi alchilici Loudon chimica organica
Loudon chimica organica I componenti principali di un computer
I componenti principali di un computer Giovanni danese
Giovanni danese Controllo ad anello aperto
Controllo ad anello aperto Fondamenti di automatica benvenuti
Fondamenti di automatica benvenuti Pedagogia generale slide
Pedagogia generale slide Verismo italiano e naturalismo francese
Verismo italiano e naturalismo francese Genotipo
Genotipo Fondamenti di astronomia
Fondamenti di astronomia Giddens fondamenti di sociologia
Giddens fondamenti di sociologia Impedenzimetro
Impedenzimetro Gli angoli retti
Gli angoli retti Fondamenti di informatica 2
Fondamenti di informatica 2 Marco schaerf
Marco schaerf Janice seinfeld
Janice seinfeld Gslaw group
Gslaw group Janice pilch
Janice pilch Fearless by janice galloway text
Fearless by janice galloway text Hue luu
Hue luu Hemocode test
Hemocode test Janice hermann
Janice hermann Janice whatley
Janice whatley Map of majapahit empire
Map of majapahit empire Janice ciavaglia
Janice ciavaglia The probability that janice smokes is 3/10
The probability that janice smokes is 3/10 Janice lapsansky
Janice lapsansky Qian janice wang
Qian janice wang

























































