Fondamenti di chimica organica Janice Gorzynski Smith University







![Struttura e Legame Disegnare strutture di risonanza Regola [1]: Due strutture di risonanza differiscono Struttura e Legame Disegnare strutture di risonanza Regola [1]: Due strutture di risonanza differiscono](https://slidetodoc.com/presentation_image_h/d03bf844438fad4fd0b1555715fc1ec0/image-16.jpg)
![Struttura e Legame Disegnare strutture di risonanza Regola [3]: le strutture di risonanza devono Struttura e Legame Disegnare strutture di risonanza Regola [3]: le strutture di risonanza devono](https://slidetodoc.com/presentation_image_h/d03bf844438fad4fd0b1555715fc1ec0/image-17.jpg)









- Slides: 35

Fondamenti di chimica organica Janice Gorzynski Smith University of Hawai’i Capitolo 14 Coniugazione e risonanza Prepared by Rabi Ann Musah State University of New York at Albany Copyright © The Mc. Graw-Hill Companies, Inc. Permission required for reproduction or display. Fondamenti di chimica organica Janice Gorzynski Smith 1 Copyright © 2009 – The Mc. Graw-Hill Companies srl

RISONANZA La teoria della risonanza descrive quelle molecole (o ioni) che vengono rappresentate da più strutture di Lewis, dette STRUTTURE LIMITE DI RISONANZA. Queste differiscono per la diversa localizzazione degli elettroni, NON DEGLI ATOMI. La molecula (O IONE) reale si dice IBRIDO di RISONANZA. Per le speci risonanti, non esiste una singola struttura di Lewis che le descriva correttamente. Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The Mc. Graw-Hill Companies srl

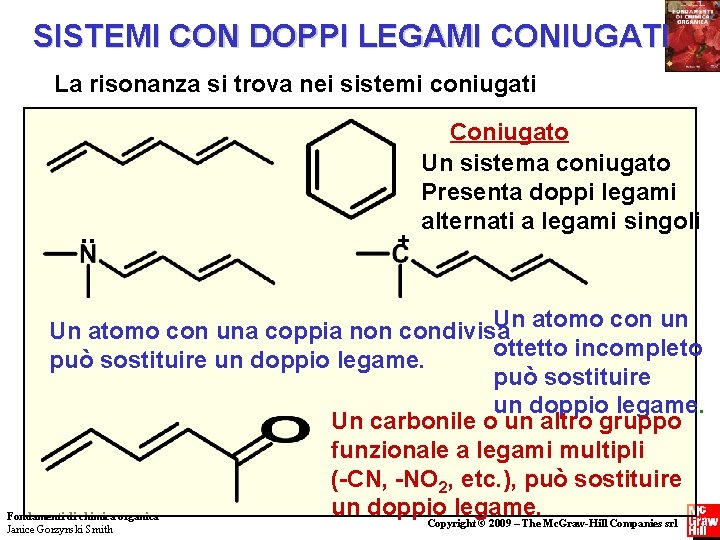
SISTEMI CON DOPPI LEGAMI CONIUGATI La risonanza si trova nei sistemi coniugati . . + Coniugato Un sistema coniugato Presenta doppi legami alternati a legami singoli Un atomo con una coppia non condivisa ottetto incompleto può sostituire un doppio legame. Un carbonile o un altro gruppo funzionale a legami multipli (-CN, -NO 2, etc. ), può sostituire un doppio legame. Fondamenti di chimica organica Copyright © 2009 – The Mc. Graw-Hill Companies srl Janice Gorzynski Smith

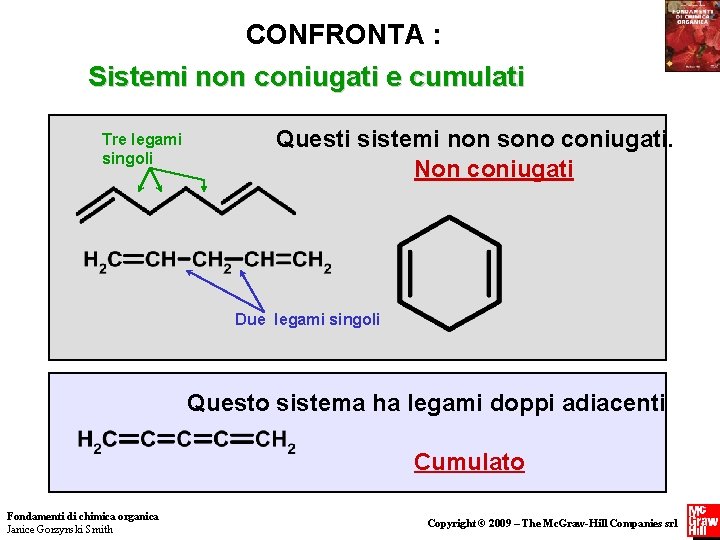
CONFRONTA : Sistemi non coniugati e cumulati Tre legami singoli Questi sistemi non sono coniugati. Non coniugati Due legami singoli Questo sistema ha legami doppi adiacenti Cumulato Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The Mc. Graw-Hill Companies srl

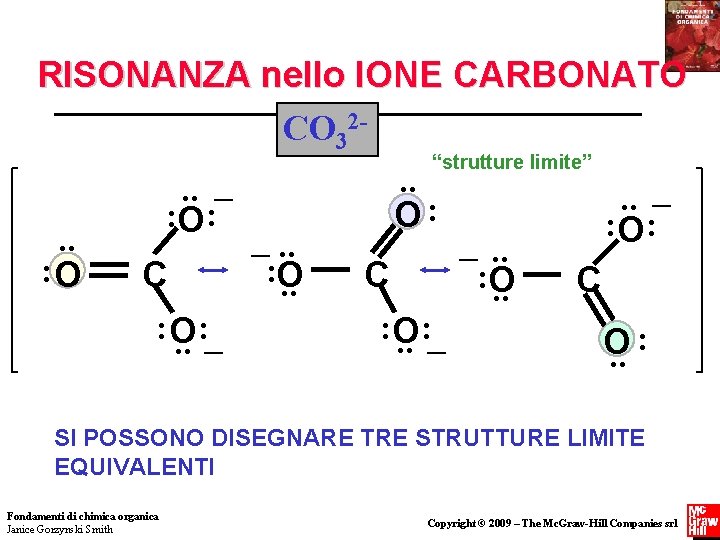
RISONANZA nello IONE CARBONATO CO 32“strutture limite”. . _. . O: : : O _. . : O C C : O C. . : O : : : O _ : . . _ O. . SI POSSONO DISEGNARE TRE STRUTTURE LIMITE EQUIVALENTI Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The Mc. Graw-Hill Companies srl

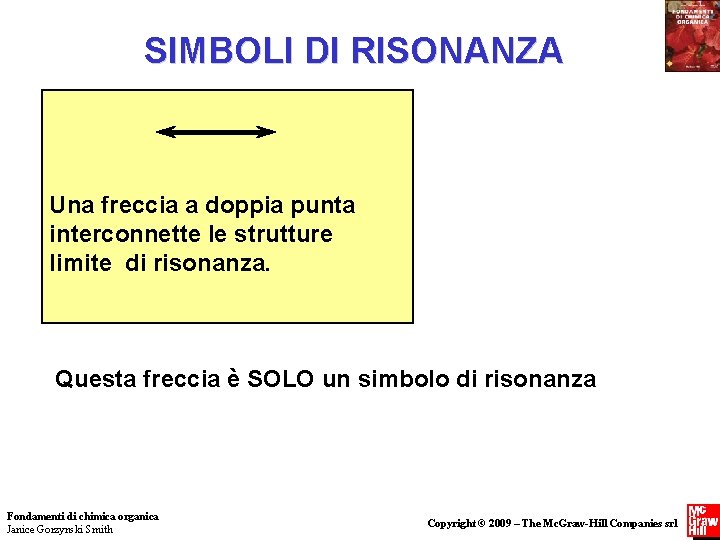
SIMBOLI DI RISONANZA Una freccia a doppia punta interconnette le strutture limite di risonanza. Questa freccia è SOLO un simbolo di risonanza Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The Mc. Graw-Hill Companies srl

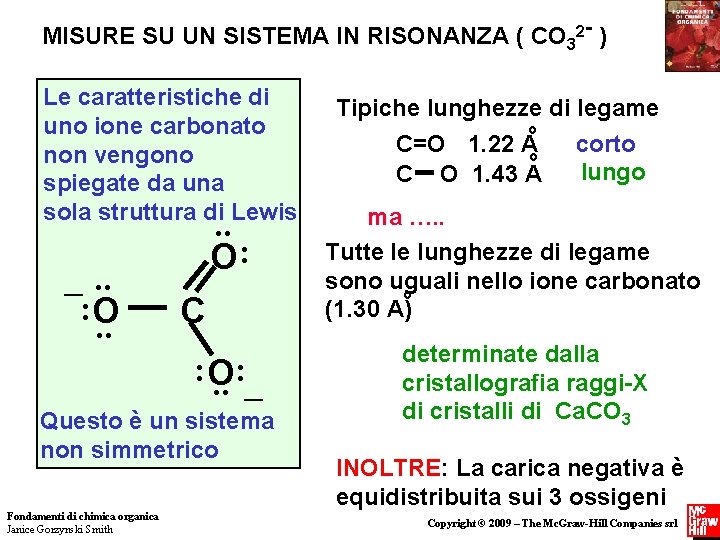
MISURE SU UN SISTEMA IN RISONANZA ( CO 32 - ) Le caratteristiche di uno ione carbonato non vengono spiegate da una sola struttura di Lewis _. . : O. . O: C : O. . : _ Questo è un sistema non simmetrico Fondamenti di chimica organica Janice Gorzynski Smith Tipiche lunghezze di legame o C=O 1. 22 Ao C O 1. 43 A corto lungo ma …. . Tutte le lunghezze di legame sono uguali nello ione carbonato o (1. 30 A) determinate dalla cristallografia raggi-X di cristalli di Ca. CO 3 INOLTRE: La carica negativa è equidistribuita sui 3 ossigeni Copyright © 2009 – The Mc. Graw-Hill Companies srl

Ione carbonato rosso = neg blu = pos (ab initio 3 -21 g) Mappa di potenziale elettrostatico sulla superficie di van der Waal’s Superficie di van der Waal’s Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The Mc. Graw-Hill Companies srl

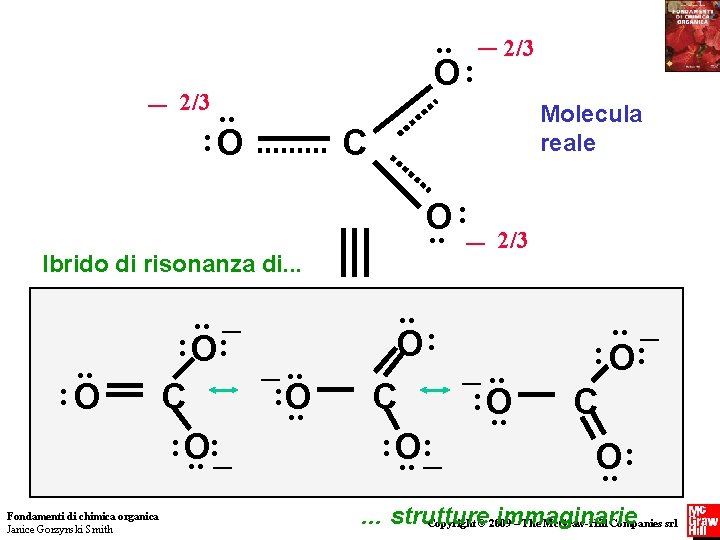
_ 2/3 . . : O Ibrido di risonanza di. . . : O Fondamenti di chimica organica Janice Gorzynski Smith . . _ 2/3 O: . . _ : O: _. . : O C. . : O : . . _ Molecula reale C : _ O. . 2/3 . . O: _. . C : O. . : O : . . _ : O: C : O. . … strutture immaginarie Copyright © 2009 – The Mc. Graw-Hill Companies srl

RISONANZA nello IONE ACETATO acido acetico La delocalizzazione della carica abbassa l’energia della base coniugata. Fondamenti di chimica organica Janice Gorzynski Smith ione acetato Copyright © 2009 – The Mc. Graw-Hill Companies srl

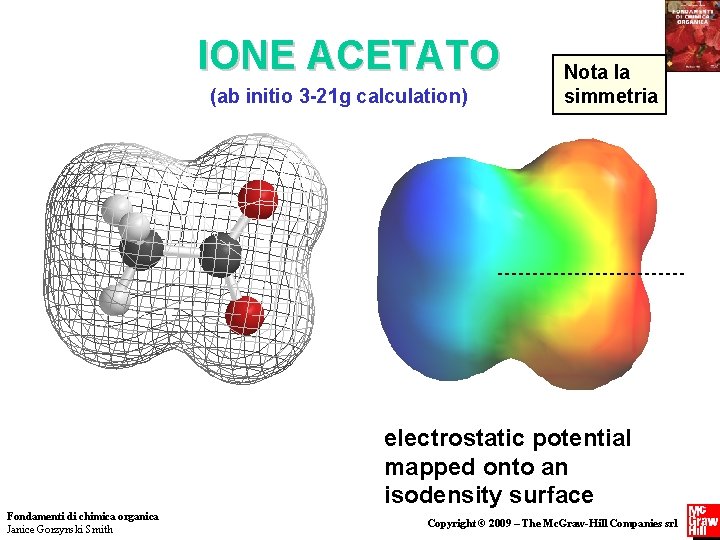
IONE ACETATO (ab initio 3 -21 g calculation) Nota la simmetria electrostatic potential mapped onto an isodensity surface Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The Mc. Graw-Hill Companies srl

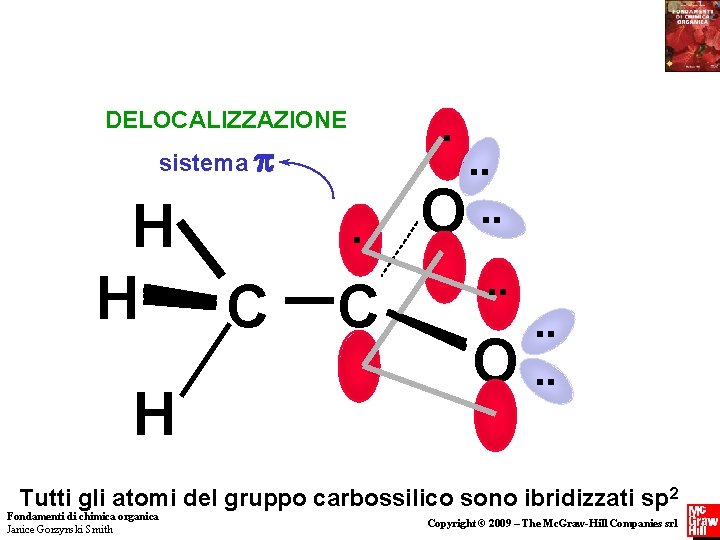
. DELOCALIZZAZIONE sistema H H C H . C . . O. . O . . Tutti gli atomi del gruppo carbossilico sono ibridizzati sp 2 Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The Mc. Graw-Hill Companies srl

Struttura e Legame Altri esempi Anione HCONH¯. Una struttura presenta l’atomo di azoto carico negativamente ed un doppio legame C-O; l’altra presenta un atomo di ossigeno carico negativamente ed un doppio legame C-N. Queste strutture sono chiamate strutture di risonanza o forme di risonanza. Una freccia a due punte viene usata per separare le strutture di risonanza. Fondamenti di chimica organica Janice Gorzynski Smith 13 Copyright © 2009 – The Mc. Graw-Hill Companies srl

Struttura e Legame Introduzione alla Teoria della Risonanza Relativamente alle due strutture di risonanza di (HCONH)¯ qui mostrate, si deve notare che: • Nessuna struttura di risonanza è un’accurata rappresentazione per (HCONH)¯. La vera struttura è una struttura mista di entrambe le forme di risonanza ed è chiamata ibrido di risonanza. • L’ibrido mostra caratteristiche di entrambe le strutture. • La risonanza fa sì che alcune coppie elettroniche risultino delocalizzate su due o più atomi, e questa delocalizazione aumenta la stabilità. • Una molecola con due o più forme di risonanza viene detta essere stabilizzata per risonanza. Fondamenti di chimica organica Janice Gorzynski Smith 14 Copyright © 2009 – The Mc. Graw-Hill Companies srl

Struttura e Legame Introduzione alla Teoria della Risonanza Ricorda i seguenti principi di base della teoria della risonanza: 1. Le strutture di risonanza non sono reali. Una singola struttura di risonanza non rappresenta in modo adeguato la struttura di una molecola o di uno ione. Ciò vale solo per l’ibrido. 2. Le strutture di risonanza non sono in equilibrio tra loro. Non c’è movimento di elettroni da una all’altra. 3. Le strutture di risonanza non sono isomeri. Due isomeri differiscono nella disposizione sia di atomi che di elettroni, mentre le strutture di risonanza differiscono solamente nella disposizione degli elettroni. Fondamenti di chimica organica Janice Gorzynski Smith 15 Copyright © 2009 – The Mc. Graw-Hill Companies srl
![Struttura e Legame Disegnare strutture di risonanza Regola 1 Due strutture di risonanza differiscono Struttura e Legame Disegnare strutture di risonanza Regola [1]: Due strutture di risonanza differiscono](https://slidetodoc.com/presentation_image_h/d03bf844438fad4fd0b1555715fc1ec0/image-16.jpg)
Struttura e Legame Disegnare strutture di risonanza Regola [1]: Due strutture di risonanza differiscono nella posizione di legami multipli e di elettroni di non legame. La posizione degli atomi e dei legami singoli rimane sempre la stessa. Regola [2]: Due strutture di risonanza devono avere lo stesso numero di elettroni non accoppiati. Fondamenti di chimica organica Janice Gorzynski Smith 16 Copyright © 2009 – The Mc. Graw-Hill Companies srl
![Struttura e Legame Disegnare strutture di risonanza Regola 3 le strutture di risonanza devono Struttura e Legame Disegnare strutture di risonanza Regola [3]: le strutture di risonanza devono](https://slidetodoc.com/presentation_image_h/d03bf844438fad4fd0b1555715fc1ec0/image-17.jpg)
Struttura e Legame Disegnare strutture di risonanza Regola [3]: le strutture di risonanza devono essere strutture di Lewis valide. L’idrogeno deve avere due elettroni e nessun elemento della seconda riga deve avere più di otto elettroni. Fondamenti di chimica organica Janice Gorzynski Smith 17 Copyright © 2009 – The Mc. Graw-Hill Companies srl

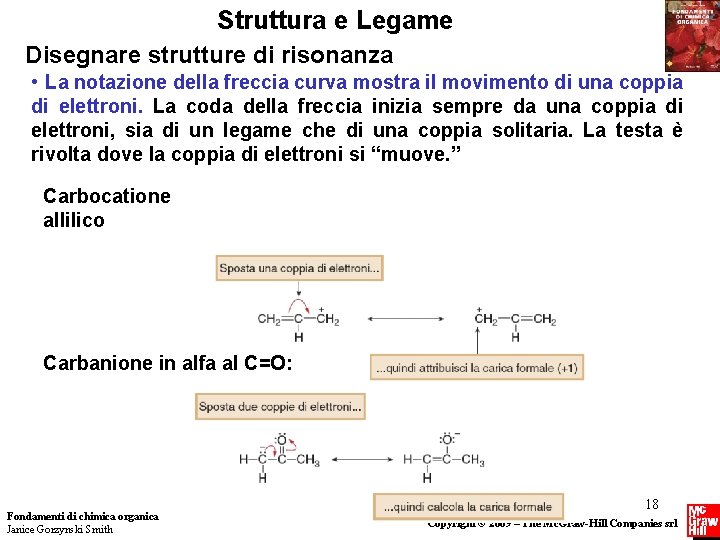
Struttura e Legame Disegnare strutture di risonanza • La notazione della freccia curva mostra il movimento di una coppia di elettroni. La coda della freccia inizia sempre da una coppia di elettroni, sia di un legame che di una coppia solitaria. La testa è rivolta dove la coppia di elettroni si “muove. ” Carbocatione allilico Carbanione in alfa al C=O: Fondamenti di chimica organica Janice Gorzynski Smith 18 Copyright © 2009 – The Mc. Graw-Hill Companies srl

Struttura e Legame Esempi di strutture di risonanza Nei due esempi precedenti, una coppia solitaria è posizionata su un atomo direttamente legato ad un doppio legame: Fondamenti di chimica organica Janice Gorzynski Smith 19 Copyright © 2009 – The Mc. Graw-Hill Companies srl

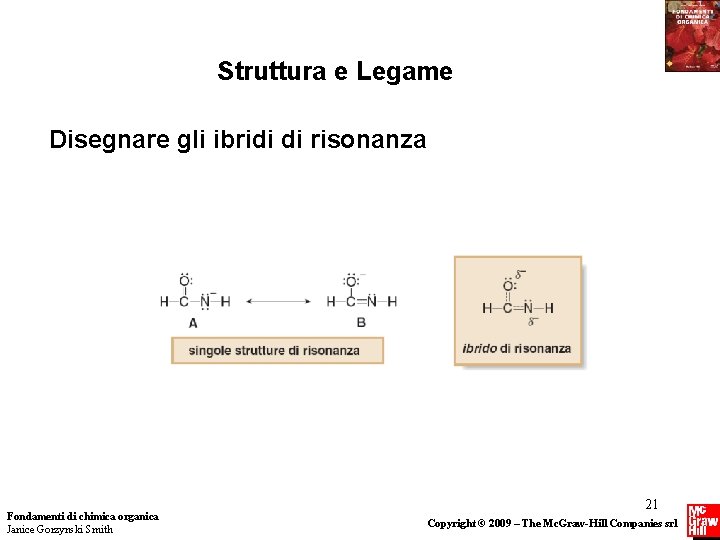
Struttura e Legame Ibridi di risonanza • L’ ibrido di risonanza è la struttura composta di tutte le possibili strutture di risonanza. Nell’ibrido di risonanza le coppie di elettroni, disegnate nelle differenti posizioni delle strutture di risonanza individuali, sono delocalizzate. • Quando due strutture di risonanza sono differenti, l’ibrido assomiglia di più alla struttura di risonanza “migliore”. La struttura di risonanza “migliore” è chiamata il maggior contribuente all’ibrido, e tutte le altre sono contribuenti minori. • L’ibrido è la media pesata delle strutture di risonanza contribuenti. Fondamenti di chimica organica Janice Gorzynski Smith 20 Copyright © 2009 – The Mc. Graw-Hill Companies srl

Struttura e Legame Disegnare gli ibridi di risonanza Fondamenti di chimica organica Janice Gorzynski Smith 21 Copyright © 2009 – The Mc. Graw-Hill Companies srl

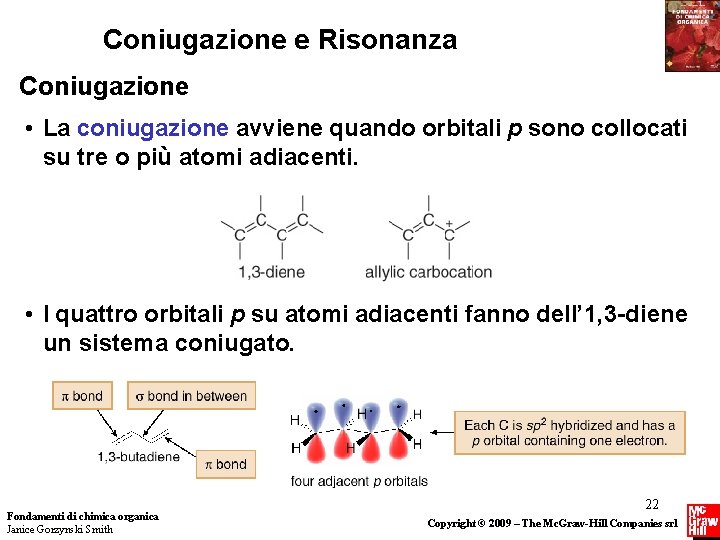
Coniugazione e Risonanza Coniugazione • La coniugazione avviene quando orbitali p sono collocati su tre o più atomi adiacenti. • I quattro orbitali p su atomi adiacenti fanno dell’ 1, 3 -diene un sistema coniugato. Fondamenti di chimica organica Janice Gorzynski Smith 22 Copyright © 2009 – The Mc. Graw-Hill Companies srl

Coniugazione e Risonanza Coniugazione • Avere tre o più orbitali p su atomi adiacenti permette la sovrapposizione degli orbitali p e la delocalizzazione degli elettroni. Fondamenti di chimica organica Janice Gorzynski Smith 23 Copyright © 2009 – The Mc. Graw-Hill Companies srl

Coniugazione e Risonanza Coniugazione • L’ 1, 4 -pentadiene è un diene isolato. • I legami nell’ 1, 4 -pentadiene sono troppo lontani tra loro per essere coniugati. Fondamenti di chimica organica Janice Gorzynski Smith 24 Copyright © 2009 – The Mc. Graw-Hill Companies srl

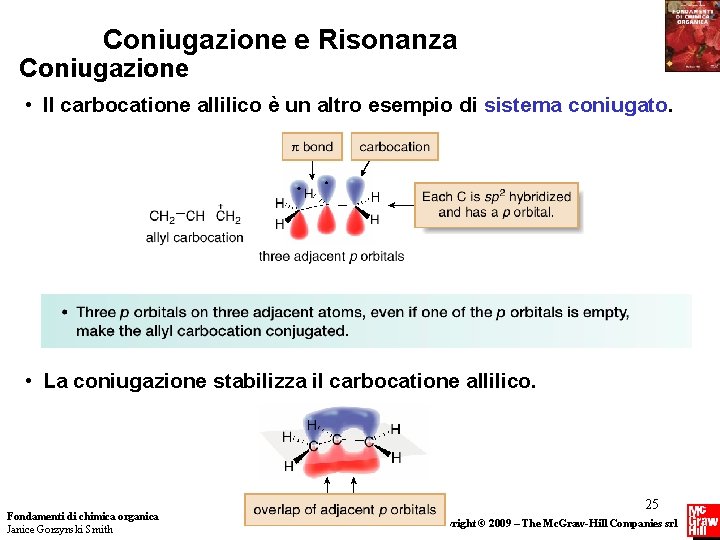
Coniugazione e Risonanza Coniugazione • Il carbocatione allilico è un altro esempio di sistema coniugato. • La coniugazione stabilizza il carbocatione allilico. Fondamenti di chimica organica Janice Gorzynski Smith 25 Copyright © 2009 – The Mc. Graw-Hill Companies srl

Coniugazione e Risonanza Coniugazione • Disegnare le strutture di risonanza per il carbocatione allilico è un modo di utilizzare le strutture di Lewis per mostrare come la coniugazione delocalizza gli elettroni. • Il vero carbocatione allilico è un ibrido delle due strutture di risonanza. • Nell’ibrido, la carica positiva è delocalizzata su due atomi di carbonio terminali. • La delocalizzazione della densità elettronica abbassa l’energia dell’ibrido, stabilizzando il carbocatione allilico e rendendolo più stabile di un normale carbocatione 1°. 26 Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The Mc. Graw-Hill Companies srl

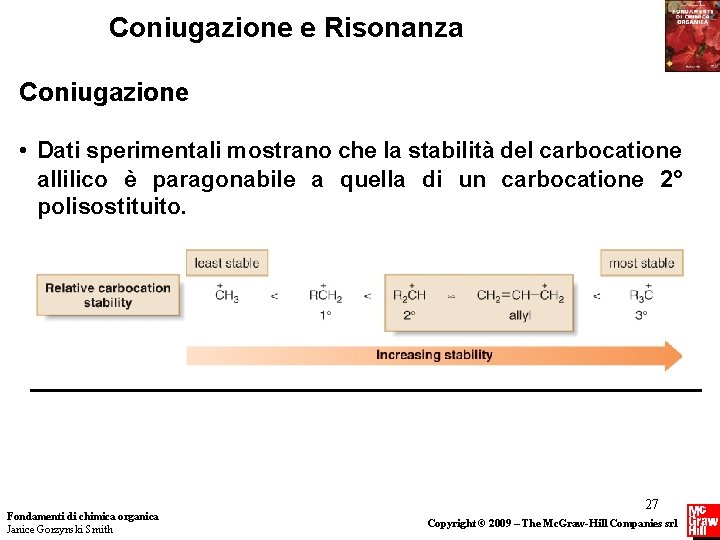
Coniugazione e Risonanza Coniugazione • Dati sperimentali mostrano che la stabilità del carbocatione allilico è paragonabile a quella di un carbocatione 2° polisostituito. Fondamenti di chimica organica Janice Gorzynski Smith 27 Copyright © 2009 – The Mc. Graw-Hill Companies srl

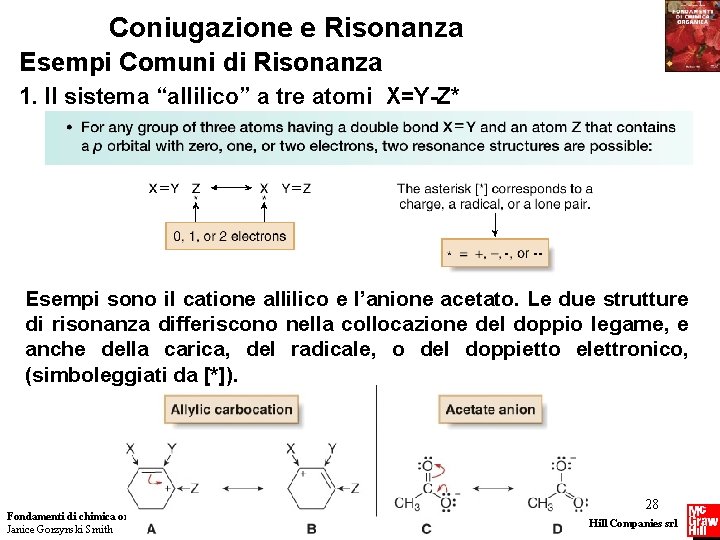
Coniugazione e Risonanza Esempi Comuni di Risonanza 1. Il sistema “allilico” a tre atomi X=Y-Z* Esempi sono il catione allilico e l’anione acetato. Le due strutture di risonanza differiscono nella collocazione del doppio legame, e anche della carica, del radicale, o del doppietto elettronico, (simboleggiati da [*]). Fondamenti di chimica organica Janice Gorzynski Smith 28 Copyright © 2009 – The Mc. Graw-Hill Companies srl

Coniugazione e Risonanza Esempi Comuni di Risonanza 2. Doppi legami coniugati • Composti ciclici, completamente coniugati, come il benzene, hanno due strutture di risonanza, disegnate muovendo gli elettroni in circolo intorno all’anello. • Per altri dieni coniugati possono essere disegnate tre strutture di risonanza, due delle quali comportano separazione di carica. Fondamenti di chimica organica Janice Gorzynski Smith 29 Copyright © 2009 – The Mc. Graw-Hill Companies srl

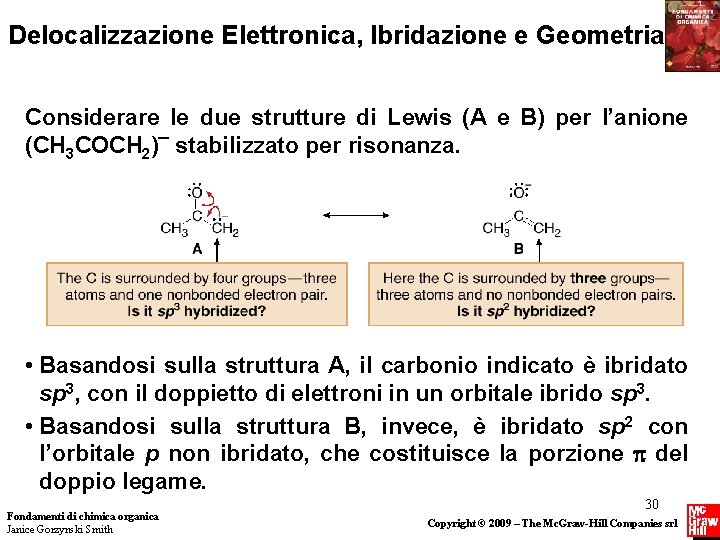
Delocalizzazione Elettronica, Ibridazione e Geometria Considerare le due strutture di Lewis (A e B) per l’anione (CH 3 COCH 2)¯ stabilizzato per risonanza. • Basandosi sulla struttura A, il carbonio indicato è ibridato sp 3, con il doppietto di elettroni in un orbitale ibrido sp 3. • Basandosi sulla struttura B, invece, è ibridato sp 2 con l’orbitale p non ibridato, che costituisce la porzione del doppio legame. Fondamenti di chimica organica Janice Gorzynski Smith 30 Copyright © 2009 – The Mc. Graw-Hill Companies srl

Delocalizzazione Elettronica, Ibridazione e Geometria • Il doppietto elettronico, su un atomo di carbonio adiacente al gruppo C=O, può essere delocalizzato se ha un orbitale p che si può sovrapporre a due altri orbitali p su due atomi adiacenti. Quindi l’atomo di carbonio terminale è ibridato sp 2 con geometria trigonale planare. • Tre orbitali p adiacenti formano un anione coniugato. Fondamenti di chimica organica Janice Gorzynski Smith 31 Copyright © 2009 – The Mc. Graw-Hill Companies srl

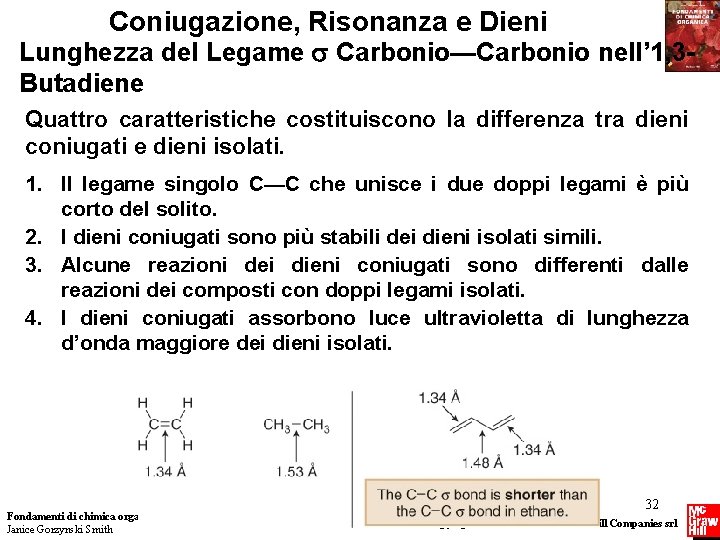
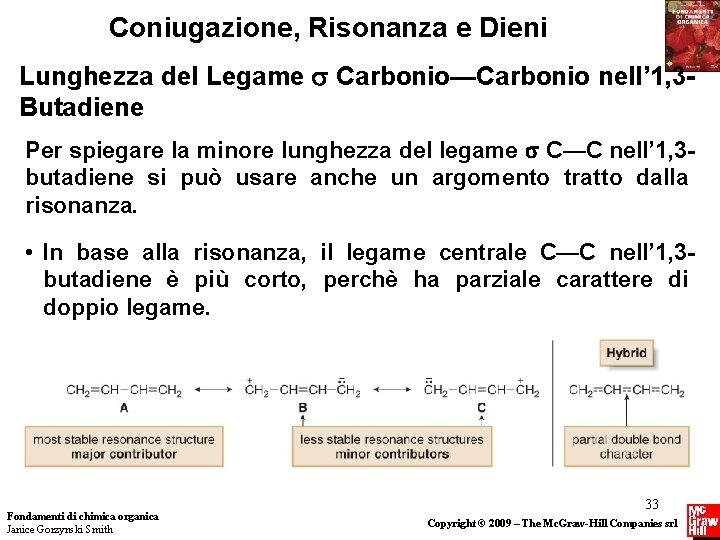
Coniugazione, Risonanza e Dieni Lunghezza del Legame Carbonio—Carbonio nell’ 1, 3 Butadiene Quattro caratteristiche costituiscono la differenza tra dieni coniugati e dieni isolati. 1. Il legame singolo C—C che unisce i due doppi legami è più corto del solito. 2. I dieni coniugati sono più stabili dei dieni isolati simili. 3. Alcune reazioni dei dieni coniugati sono differenti dalle reazioni dei composti con doppi legami isolati. 4. I dieni coniugati assorbono luce ultravioletta di lunghezza d’onda maggiore dei dieni isolati. Fondamenti di chimica organica Janice Gorzynski Smith 32 Copyright © 2009 – The Mc. Graw-Hill Companies srl

Coniugazione, Risonanza e Dieni Lunghezza del Legame Carbonio—Carbonio nell’ 1, 3 Butadiene Per spiegare la minore lunghezza del legame C—C nell’ 1, 3 butadiene si può usare anche un argomento tratto dalla risonanza. • In base alla risonanza, il legame centrale C—C nell’ 1, 3 butadiene è più corto, perchè ha parziale carattere di doppio legame. Fondamenti di chimica organica Janice Gorzynski Smith 33 Copyright © 2009 – The Mc. Graw-Hill Companies srl

Risonanza in anioni e cationi (Carica in posizione coniugata a un doppio legame) ANIONI Movimento degli elettroni a partire dalla carica negativa. -. . : O. . C C + C C CATIONI C Gli elettroni si muovono verso la Carica positiva Fondamenti di chimica organica Janice Gorzynski Smith Si muove la carica non si forma una nuova carica : O. . C - C C + C C Si muove la carica + non si forma una nuova carica Copyright © 2009 – The Mc. Graw-Hill Companies srl

Risonanza in molecole neutre (Doppietto di non legame in posizione coniugata o Doppi legami coniugati. ) NEUTRAL C C + C C - Doppietto p-greco si muove verso l’altro. Si creano nuove cariche . . N C C + N - C C Il doppietto dell’azoto si muove verso il sistema p-greco. Fondamenti di chimica organica Janice Gorzynski Smith Copyright © 2009 – The Mc. Graw-Hill Companies srl
 Reazione di riduzione
Reazione di riduzione Janice gorzynski smith
Janice gorzynski smith Janice smith
Janice smith Met et prop but pent
Met et prop but pent Definizione chimica organica
Definizione chimica organica Gli alcani sono poco reattivi
Gli alcani sono poco reattivi Carbonio metabolismo biotech soluzioni
Carbonio metabolismo biotech soluzioni Gruppi alchilici
Gruppi alchilici Chimica organica
Chimica organica Chimica organica
Chimica organica Chimica organica
Chimica organica Chimica organica
Chimica organica Acido 4 amminobutanoico
Acido 4 amminobutanoico I fondamenti dell'ict
I fondamenti dell'ict Danese unipv
Danese unipv Fondamenti di automatica unife
Fondamenti di automatica unife Fondamenti di automatica benvenuti
Fondamenti di automatica benvenuti Fondamenti di pedagogia generale
Fondamenti di pedagogia generale Il naturalismo francese i fondamenti teorici
Il naturalismo francese i fondamenti teorici Fondamenti biogenetici
Fondamenti biogenetici Fondamenti di astronomia
Fondamenti di astronomia Fondamenti di sociologia giddens
Fondamenti di sociologia giddens Fondamenti di misure
Fondamenti di misure Crisi dei fondamenti
Crisi dei fondamenti Fondamenti di informatica 2
Fondamenti di informatica 2 Marco schaerf
Marco schaerf Jerry seinfeld public speaking
Jerry seinfeld public speaking Janice gross stein
Janice gross stein Janice pilch
Janice pilch Fearless by janice galloway text
Fearless by janice galloway text Li hue
Li hue Hemocode test
Hemocode test Janice hermann
Janice hermann Janice whatley
Janice whatley Majapahit empire peta
Majapahit empire peta First nations
First nations






















































