Fondamenti di chimica organica Janice Gorzynski Smith University












- Slides: 33

Fondamenti di chimica organica Janice Gorzynski Smith University of Hawai’i Capitolo 23 Ammine Prepared by Rabi Ann Musah State University of New York at Albany Copyright © The Mc. Graw-Hill Companies, Inc. Permission required for reproduction or display. Fondamenti di chimica organica Janice Gorzynski Smith 1 Copyright © 2009 – The Mc. Graw-Hill Companies srl

Ammine Introduzione • Le ammine sono composti organici contenenti azoto, formate sostituendo uno o più atomi di idrogeno dell’ammoniaca (NH 3) con gruppi alchilici o arilici. • Le ammine sono classificate come 1°, 2°, or 3° in funzione del numero di gruppi alchilici legati all’atomo di azoto. • Le ammine sono basi più forti e nucleofili migliori di altri composti organici neutri. Fondamenti di chimica organica Janice Gorzynski Smith 2 Copyright © 2009 – The Mc. Graw-Hill Companies srl

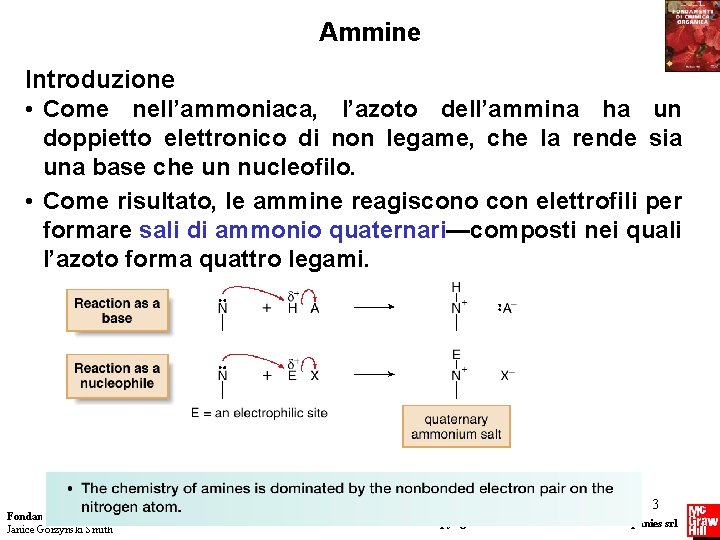
Ammine Introduzione • Come nell’ammoniaca, l’azoto dell’ammina ha un doppietto elettronico di non legame, che la rende sia una base che un nucleofilo. • Come risultato, le ammine reagiscono con elettrofili per formare sali di ammonio quaternari—composti nei quali l’azoto forma quattro legami. Fondamenti di chimica organica Janice Gorzynski Smith 3 Copyright © 2009 – The Mc. Graw-Hill Companies srl

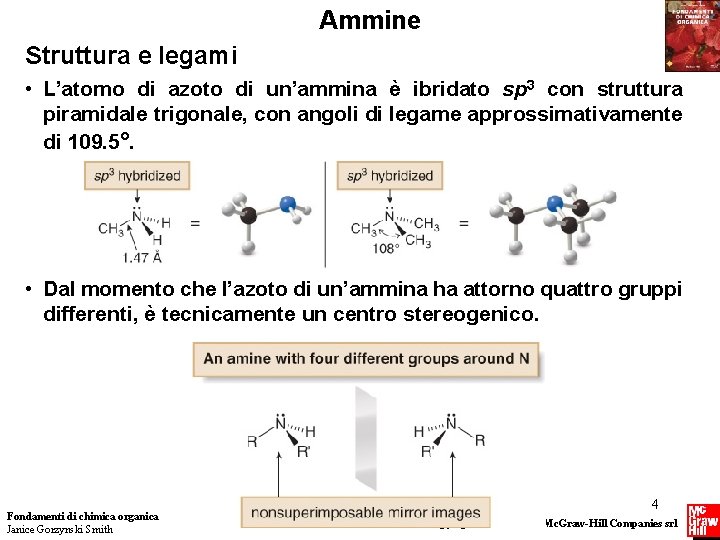
Ammine Struttura e legami • L’atomo di azoto di un’ammina è ibridato sp 3 con struttura piramidale trigonale, con angoli di legame approssimativamente di 109. 5°. • Dal momento che l’azoto di un’ammina ha attorno quattro gruppi differenti, è tecnicamente un centro stereogenico. Fondamenti di chimica organica Janice Gorzynski Smith 4 Copyright © 2009 – The Mc. Graw-Hill Companies srl

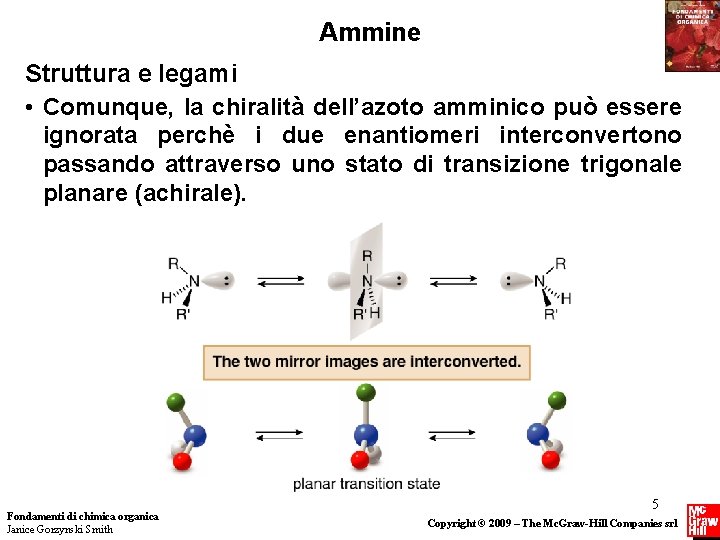
Ammine Struttura e legami • Comunque, la chiralità dell’azoto amminico può essere ignorata perchè i due enantiomeri interconvertono passando attraverso uno stato di transizione trigonale planare (achirale). Fondamenti di chimica organica Janice Gorzynski Smith 5 Copyright © 2009 – The Mc. Graw-Hill Companies srl

Ammine Struttura e legami • D’altra parte, la chiralità di un sale di ammonio quaternario con quattro gruppi differenti non può essere ignorata. Poichè non ci sono doppietti elettronici di non legame sull’atomo di azoto, l’interconversione non può avere luogo, e l’atomo N si comporta come un atomo di carbonio legato a quattro gruppi diversi. Fondamenti di chimica organica Janice Gorzynski Smith 6 Copyright © 2009 – The Mc. Graw-Hill Companies srl

Ammine Nomenclatura • Le ammine 1° sono chiamate usando sia i nomi sistematici sia i nomi comuni. • Per assegnare il nome sistematico, cercare la catena carboniosa più lunga legata all’azoto amminico, e sostituire il suffisso –o dell’alcano corrispondente con il suffiso –ammina. Quindi usare le normali regole della nomenclatura per numerare la catena ed introdurre i sostituenti. • Per assegnare il nome comune, usare il nome del gruppo alchilico legato all’atomo di azoto e aggiungere la parola ammina, formando un’unica parola. Fondamenti di chimica organica Janice Gorzynski Smith 7 Copyright © 2009 – The Mc. Graw-Hill Companies srl

Ammine Nomenclatura • Le ammine secondarie e terziarie che hanno gruppi alchilici identici vengono definite con il prefisso di- o triseguito dal nome dell’ammina primaria. • Le ammine secondarie e 3° che hanno gruppi alchilici di più tipi vengono definite ammine primarie N-sostituite usando la seguente procedura: Fondamenti di chimica organica Janice Gorzynski Smith 8 Copyright © 2009 – The Mc. Graw-Hill Companies srl

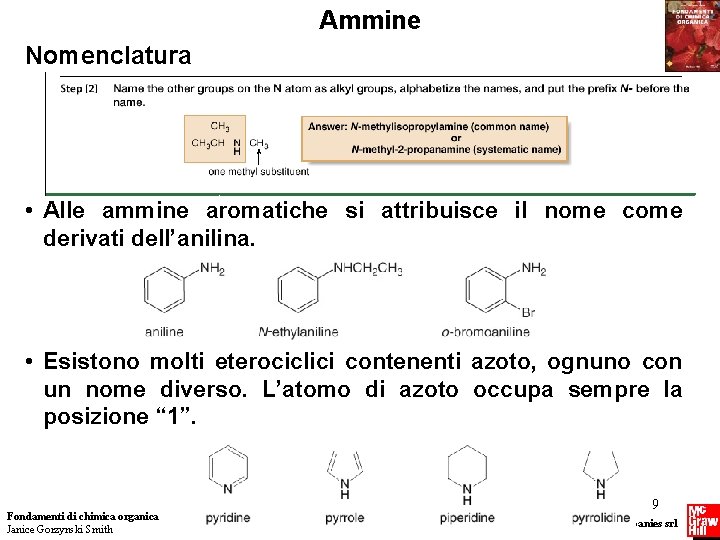
Ammine Nomenclatura • Alle ammine aromatiche si attribuisce il nome come derivati dell’anilina. • Esistono molti eterociclici contenenti azoto, ognuno con un nome diverso. L’atomo di azoto occupa sempre la posizione “ 1”. Fondamenti di chimica organica Janice Gorzynski Smith 9 Copyright © 2009 – The Mc. Graw-Hill Companies srl

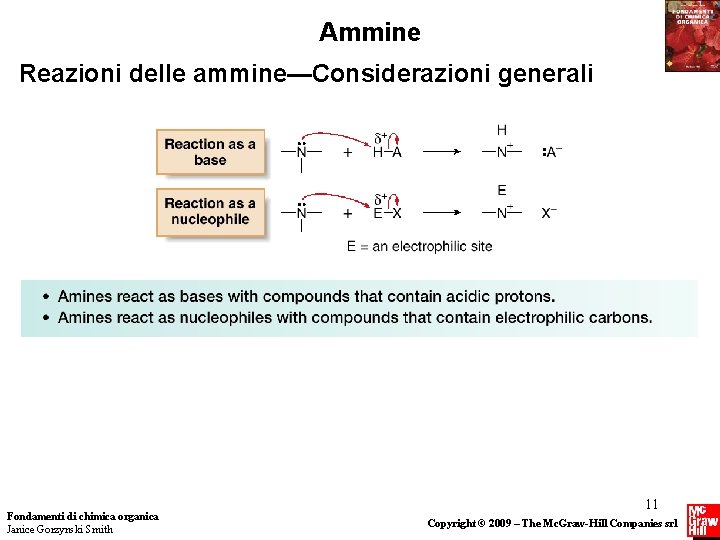
Ammine Reazioni delle ammine—Considerazioni generali • La chimica delle ammine è caratterizzata dalla presenza di un doppietto elettronico non di legame sull’azoto. • Solo tre elementi del secondo periodo della tavola periodica hanno coppie di elettroni non di legame nei composti organici neutri: azoto, ossigeno e fluoro. Poichè la basicità e la nucleofilicità diminuiscono lungo il periodo, l’azoto è il più basico e il più nucleofilo. Fondamenti di chimica organica Janice Gorzynski Smith 10 Copyright © 2009 – The Mc. Graw-Hill Companies srl

Ammine Reazioni delle ammine—Considerazioni generali Fondamenti di chimica organica Janice Gorzynski Smith 11 Copyright © 2009 – The Mc. Graw-Hill Companies srl

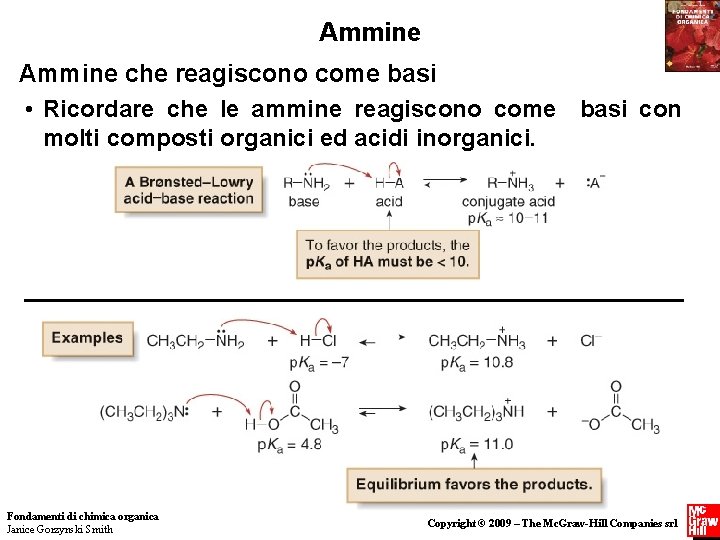
Ammine che reagiscono come basi • Ricordare che le ammine reagiscono come basi con molti composti organici ed acidi inorganici. Fondamenti di chimica organica Janice Gorzynski Smith 12 Copyright © 2009 – The Mc. Graw-Hill Companies srl

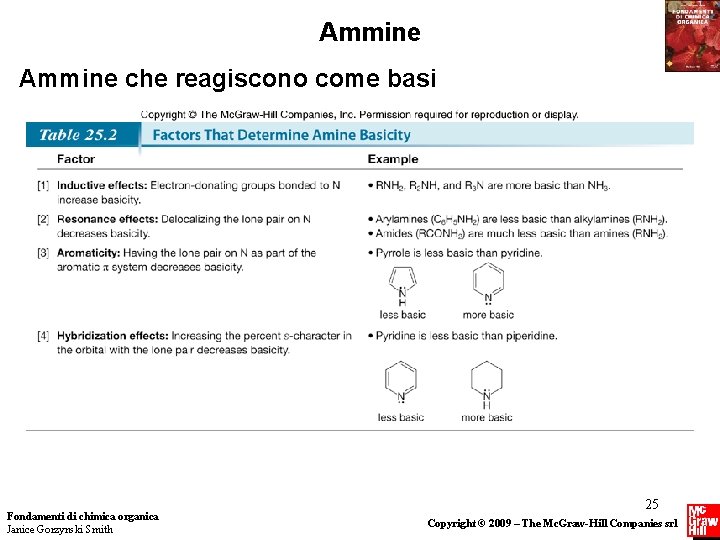
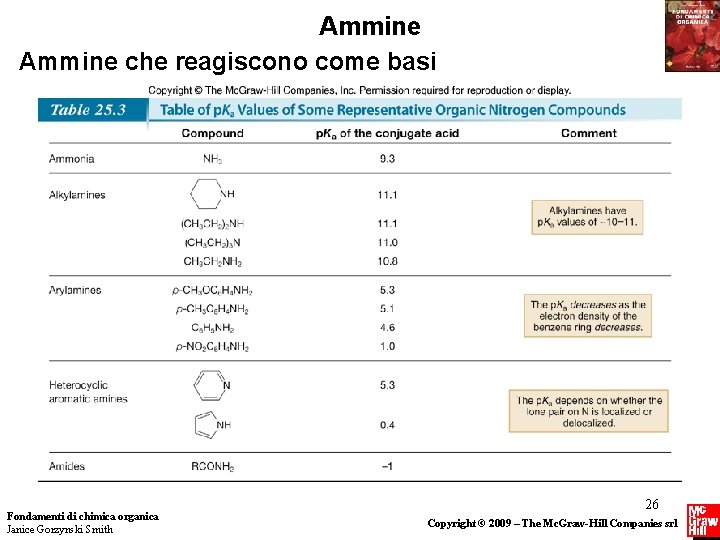
Ammine che reagiscono come basi • L’acidità relativa di composti diversi può essere confrontata usando i loro valori di p. Ka. La basicità relativa di composti diversi (come le ammine) può essere confrontata usando i valori di p. Ka dei loro acidi coniugati. • Per confrontare la basicità di due composti, ricordare che (1) qualsiasi fattore in grado di aumentare la densità elettronica sull’atomo di azoto, causa l’aumento della basicità dell’ammina; (2) qualsiasi fattore che diminuisce la densità 13 elettronica Fondamenti di chimica organica sull’ N diminuisce la basicità dell’ammina. Janice Gorzynski Smith Copyright © 2009 – The Mc. Graw-Hill Companies srl

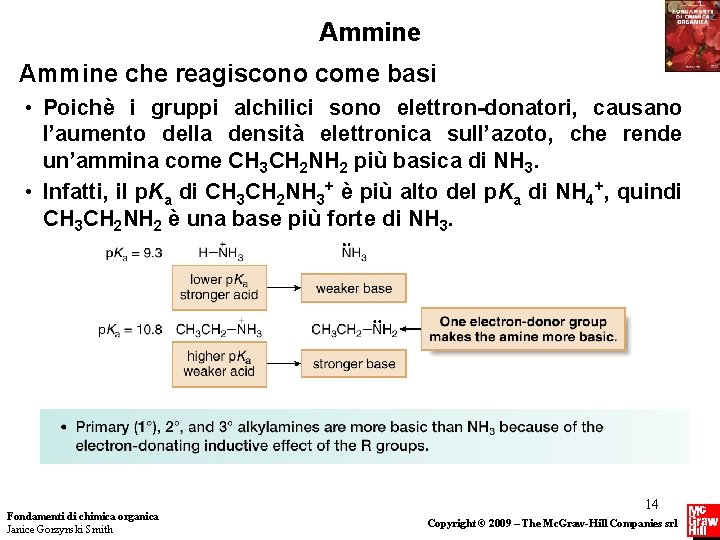
Ammine che reagiscono come basi • Poichè i gruppi alchilici sono elettron-donatori, causano l’aumento della densità elettronica sull’azoto, che rende un’ammina come CH 3 CH 2 NH 2 più basica di NH 3. • Infatti, il p. Ka di CH 3 CH 2 NH 3+ è più alto del p. Ka di NH 4+, quindi CH 3 CH 2 NH 2 è una base più forte di NH 3. Fondamenti di chimica organica Janice Gorzynski Smith 14 Copyright © 2009 – The Mc. Graw-Hill Companies srl

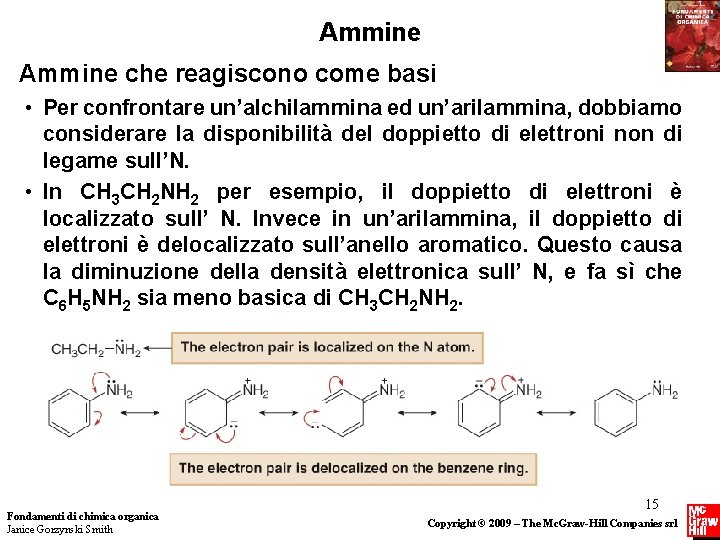
Ammine che reagiscono come basi • Per confrontare un’alchilammina ed un’arilammina, dobbiamo considerare la disponibilità del doppietto di elettroni non di legame sull’N. • In CH 3 CH 2 NH 2 per esempio, il doppietto di elettroni è localizzato sull’ N. Invece in un’arilammina, il doppietto di elettroni è delocalizzato sull’anello aromatico. Questo causa la diminuzione della densità elettronica sull’ N, e fa sì che C 6 H 5 NH 2 sia meno basica di CH 3 CH 2 NH 2. Fondamenti di chimica organica Janice Gorzynski Smith 15 Copyright © 2009 – The Mc. Graw-Hill Companies srl

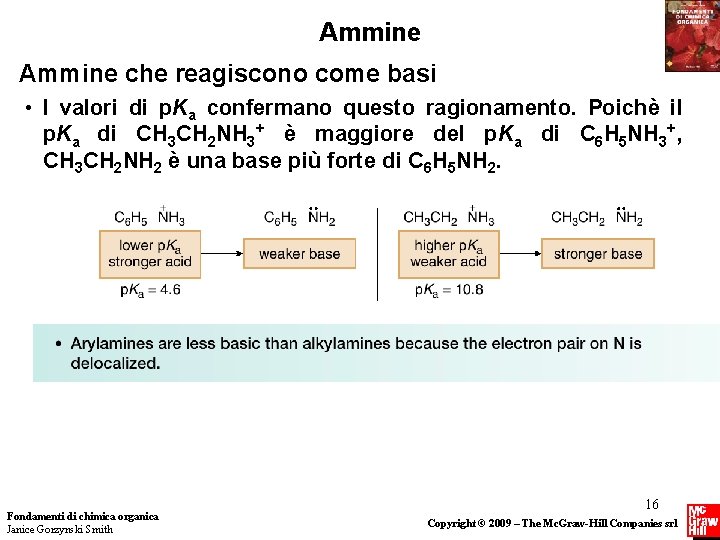
Ammine che reagiscono come basi • I valori di p. Ka confermano questo ragionamento. Poichè il p. Ka di CH 3 CH 2 NH 3+ è maggiore del p. Ka di C 6 H 5 NH 3+, CH 3 CH 2 NH 2 è una base più forte di C 6 H 5 NH 2. Fondamenti di chimica organica Janice Gorzynski Smith 16 Copyright © 2009 – The Mc. Graw-Hill Companies srl

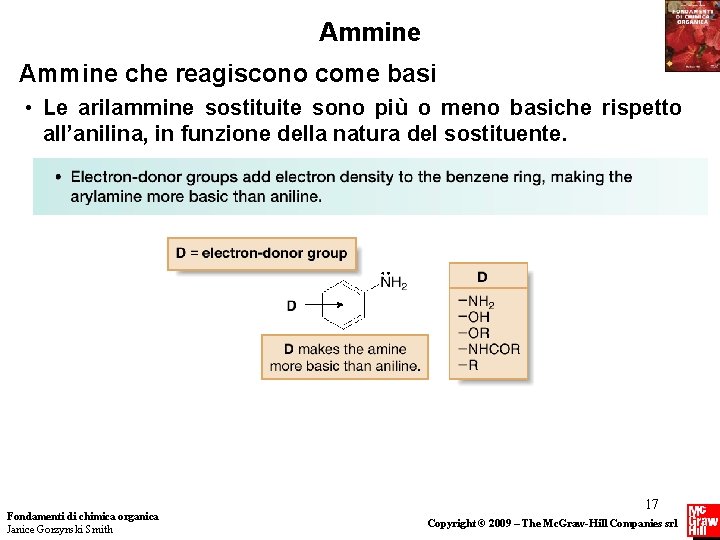
Ammine che reagiscono come basi • Le arilammine sostituite sono più o meno basiche rispetto all’anilina, in funzione della natura del sostituente. Fondamenti di chimica organica Janice Gorzynski Smith 17 Copyright © 2009 – The Mc. Graw-Hill Companies srl

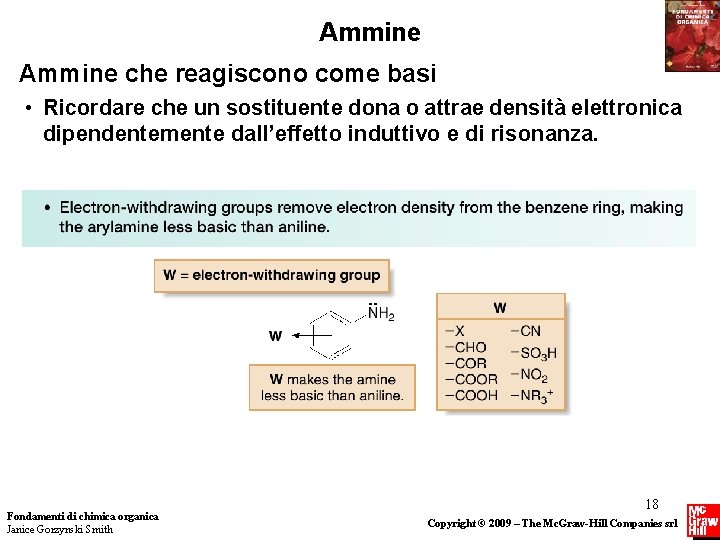
Ammine che reagiscono come basi • Ricordare che un sostituente dona o attrae densità elettronica dipendentemente dall’effetto induttivo e di risonanza. Fondamenti di chimica organica Janice Gorzynski Smith 18 Copyright © 2009 – The Mc. Graw-Hill Companies srl

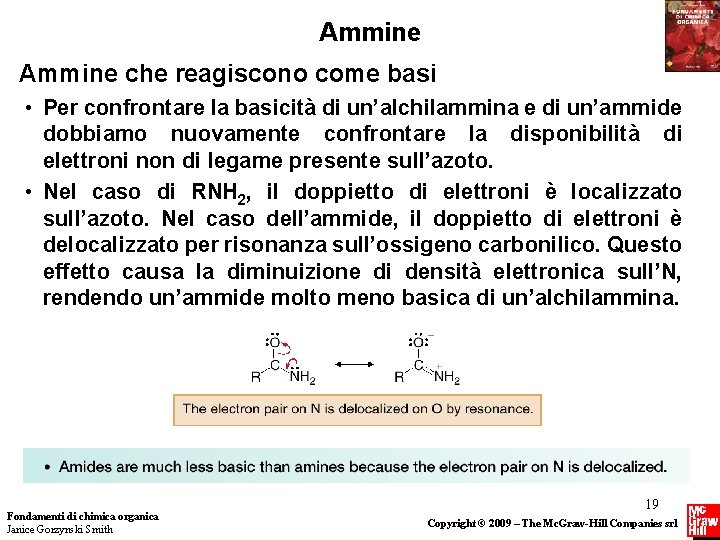
Ammine che reagiscono come basi • Per confrontare la basicità di un’alchilammina e di un’ammide dobbiamo nuovamente confrontare la disponibilità di elettroni non di legame presente sull’azoto. • Nel caso di RNH 2, il doppietto di elettroni è localizzato sull’azoto. Nel caso dell’ammide, il doppietto di elettroni è delocalizzato per risonanza sull’ossigeno carbonilico. Questo effetto causa la diminuizione di densità elettronica sull’N, rendendo un’ammide molto meno basica di un’alchilammina. Fondamenti di chimica organica Janice Gorzynski Smith 19 Copyright © 2009 – The Mc. Graw-Hill Companies srl

Ammine che reagiscono come basi • Le ammidi non sono molto più basiche di un qualsiasi composto carbonilico. • Quando un’ammide viene trattata con un acido, la protonazione avviene all’ossigeno carbonilico e non all’azoto, perché il catione risultante è stabilizzato per risonanza. Il prodotto della protonazione del gruppo NH 2 non può essere stabilizzato per risonanza. Quindi la protonazione all’ossigeno è la via preferita. Fondamenti di chimica organica Janice Gorzynski Smith 20 Copyright © 2009 – The Mc. Graw-Hill Companies srl

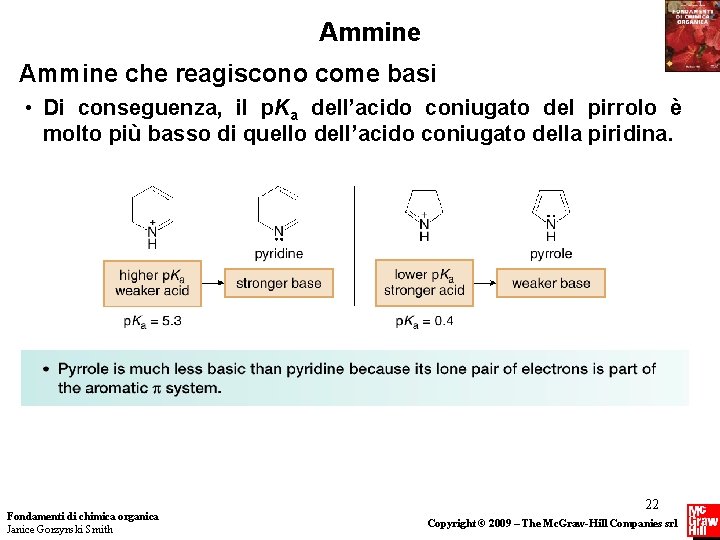
Ammine che reagiscono come basi • Per determinare la basicità relativa di eterocicli azotati che sono anche aromatici, dobbiamo sapere se la coppia elettronica libera dell’azoto fa parte del sistema aromatico. • Consideriamo la piridina ed il pirrolo. Entrambi sono aromatici, ma il doppietto di elettroni non di legame dell’N in questi composti è posto in orbitali diversi. • Ricordiamo che il doppietto elettronico non di legame della piridina occupa un orbitale ibrido sp 2, mentre quello del pirrolo è localizzato in un orbitale p, che fa parte del sistema aromatico. Di conseguenza, il pirrolo è una base molto più debole della piridina. Fondamenti di chimica organica Janice Gorzynski Smith 21 Copyright © 2009 – The Mc. Graw-Hill Companies srl

Ammine che reagiscono come basi • Di conseguenza, il p. Ka dell’acido coniugato del pirrolo è molto più basso di quello dell’acido coniugato della piridina. Fondamenti di chimica organica Janice Gorzynski Smith 22 Copyright © 2009 – The Mc. Graw-Hill Companies srl

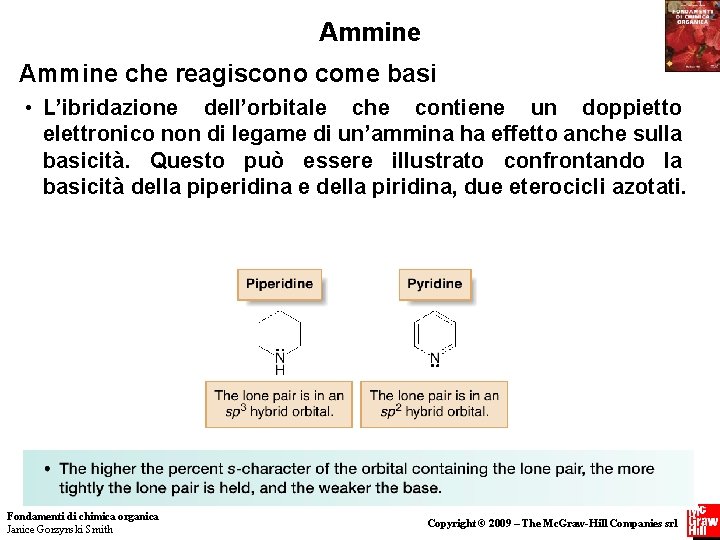
Ammine che reagiscono come basi • L’ibridazione dell’orbitale che contiene un doppietto elettronico non di legame di un’ammina ha effetto anche sulla basicità. Questo può essere illustrato confrontando la basicità della piperidina e della piridina, due eterocicli azotati. Fondamenti di chimica organica Janice Gorzynski Smith 23 Copyright © 2009 – The Mc. Graw-Hill Companies srl

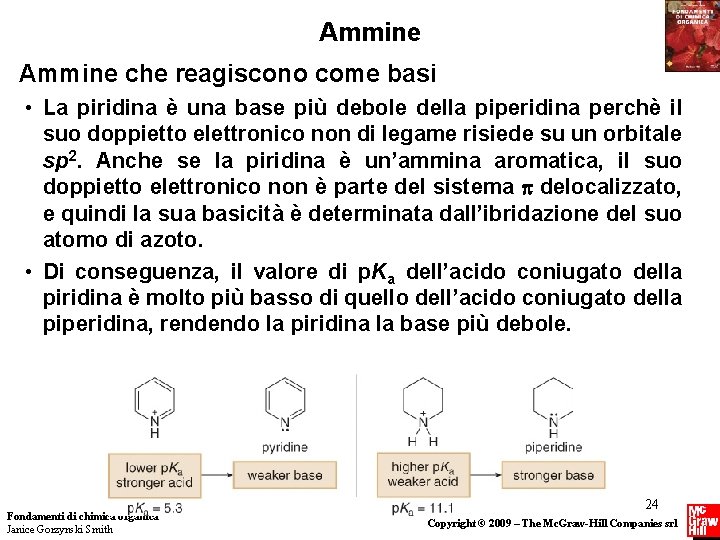
Ammine che reagiscono come basi • La piridina è una base più debole della piperidina perchè il suo doppietto elettronico non di legame risiede su un orbitale sp 2. Anche se la piridina è un’ammina aromatica, il suo doppietto elettronico non è parte del sistema delocalizzato, e quindi la sua basicità è determinata dall’ibridazione del suo atomo di azoto. • Di conseguenza, il valore di p. Ka dell’acido coniugato della piridina è molto più basso di quello dell’acido coniugato della piperidina, rendendo la piridina la base più debole. Fondamenti di chimica organica Janice Gorzynski Smith 24 Copyright © 2009 – The Mc. Graw-Hill Companies srl

Ammine che reagiscono come basi Fondamenti di chimica organica Janice Gorzynski Smith 25 Copyright © 2009 – The Mc. Graw-Hill Companies srl

Ammine che reagiscono come basi Fondamenti di chimica organica Janice Gorzynski Smith 26 Copyright © 2009 – The Mc. Graw-Hill Companies srl

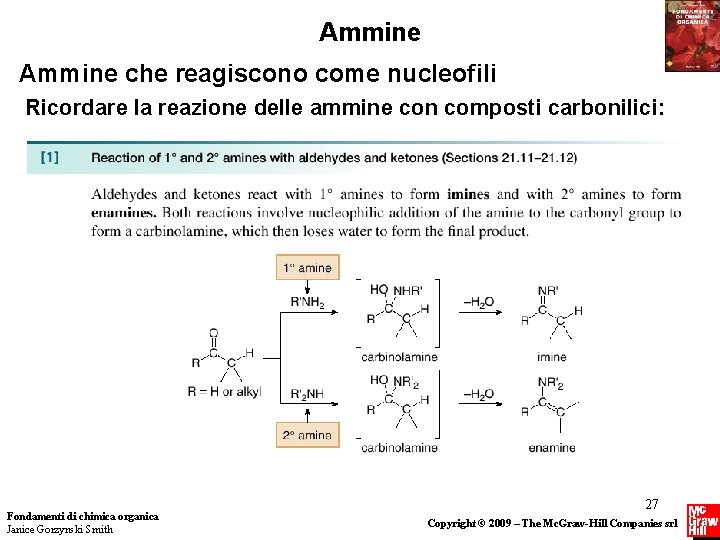
Ammine che reagiscono come nucleofili Ricordare la reazione delle ammine con composti carbonilici: Fondamenti di chimica organica Janice Gorzynski Smith 27 Copyright © 2009 – The Mc. Graw-Hill Companies srl

Ammine che reagiscono come nucleofili Ricordare la reazione delle ammine con i derivati degli acidi carbossilici: Fondamenti di chimica organica Janice Gorzynski Smith 28 Copyright © 2009 – The Mc. Graw-Hill Companies srl

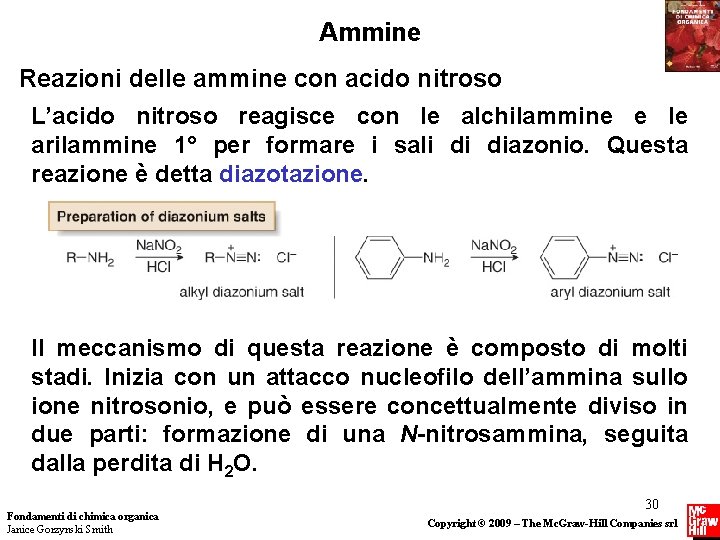
Ammine Reazioni delle ammine con acido nitroso L’ acido nitroso, HNO 2, è un acido debole e instabile formato da Na. NO 2 ed un acido forte come HCl. In presenza di un acido, l’acido nitroso si decompone con formazione di +NO, lo ione nitrosonio. Questo elettrofilo va poi a reagire con l’atomo di azoto nucleofilo delle ammine per formare i sali di diazonio (RN 2+Cl¯) da ammine 1° e le N-nitrosammine (R 2 NN=O) dalle ammine 2°. Fondamenti di chimica organica Janice Gorzynski Smith 29 Copyright © 2009 – The Mc. Graw-Hill Companies srl

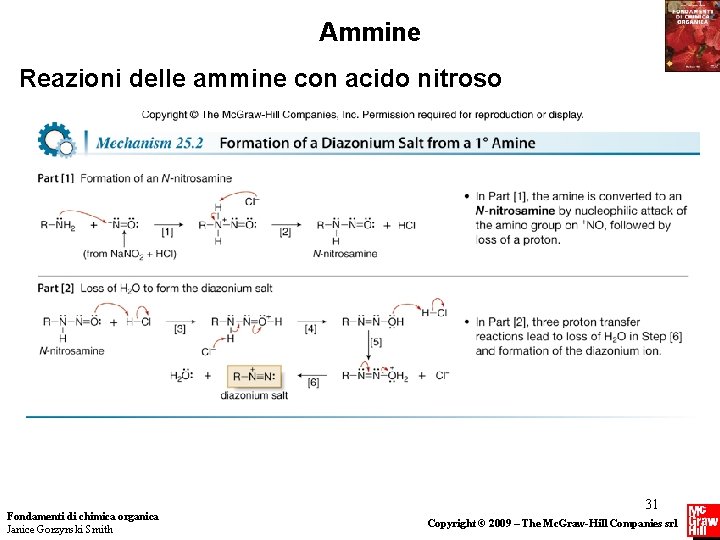
Ammine Reazioni delle ammine con acido nitroso L’acido nitroso reagisce con le alchilammine e le arilammine 1° per formare i sali di diazonio. Questa reazione è detta diazotazione. Il meccanismo di questa reazione è composto di molti stadi. Inizia con un attacco nucleofilo dell’ammina sullo ione nitrosonio, e può essere concettualmente diviso in due parti: formazione di una N-nitrosammina, seguita dalla perdita di H 2 O. Fondamenti di chimica organica Janice Gorzynski Smith 30 Copyright © 2009 – The Mc. Graw-Hill Companies srl

Ammine Reazioni delle ammine con acido nitroso Fondamenti di chimica organica Janice Gorzynski Smith 31 Copyright © 2009 – The Mc. Graw-Hill Companies srl

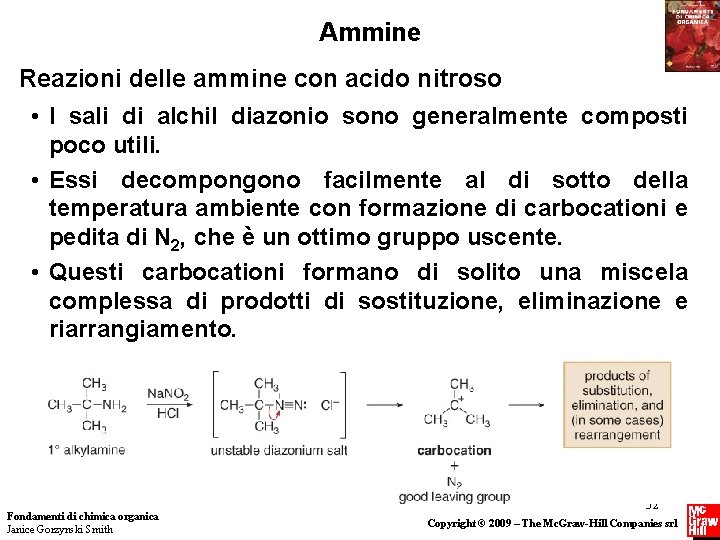
Ammine Reazioni delle ammine con acido nitroso • I sali di alchil diazonio sono generalmente composti poco utili. • Essi decompongono facilmente al di sotto della temperatura ambiente con formazione di carbocationi e pedita di N 2, che è un ottimo gruppo uscente. • Questi carbocationi formano di solito una miscela complessa di prodotti di sostituzione, eliminazione e riarrangiamento. Fondamenti di chimica organica Janice Gorzynski Smith 32 Copyright © 2009 – The Mc. Graw-Hill Companies srl

Ammine Reazioni delle ammine con acido nitroso Le alchilammine e le arilammine 2° reagiscono con acido nitroso per formare le N-nitrosammine. Fondamenti di chimica organica Janice Gorzynski Smith 33 Copyright © 2009 – The Mc. Graw-Hill Companies srl
 Reazione di riduzione
Reazione di riduzione Janice gorzynski smith
Janice gorzynski smith Janice smith
Janice smith Gruppo alchenico
Gruppo alchenico Chimica organica definizione
Chimica organica definizione Gruppo funzionale alcani
Gruppo funzionale alcani Carbonio metabolismo biotech soluzioni
Carbonio metabolismo biotech soluzioni Alcani alcheni alchini
Alcani alcheni alchini Funzioni dei carboidrati
Funzioni dei carboidrati Chimica organica
Chimica organica Chimica organica
Chimica organica Alchilammine
Alchilammine Acido 4 amminobutanoico
Acido 4 amminobutanoico I fondamenti dell'ict
I fondamenti dell'ict Giovanni danese
Giovanni danese Fondamenti di automatica unife
Fondamenti di automatica unife Fondamenti di automatica benvenuti
Fondamenti di automatica benvenuti Pedagogia generale slide
Pedagogia generale slide Verismo italiano e naturalismo francese
Verismo italiano e naturalismo francese Fondamenti biogenetici
Fondamenti biogenetici Fondamenti di astronomia
Fondamenti di astronomia Giddens fondamenti di sociologia
Giddens fondamenti di sociologia Fondamenti di misure
Fondamenti di misure Crisi dei fondamenti
Crisi dei fondamenti Fondamenti di informatica 2
Fondamenti di informatica 2 Marco schaerf
Marco schaerf Jerry seinfeld public speaking
Jerry seinfeld public speaking Gslaw group
Gslaw group Janice pilch
Janice pilch Fearless by janice galloway
Fearless by janice galloway Li hue
Li hue Hemocode test
Hemocode test Janice hermann
Janice hermann Interpretivsm
Interpretivsm





















































