FAMILIA RETROVIRIDAE Dra Dora Ruchansky Prof Adjunta del
















- Slides: 36

FAMILIA RETROVIRIDAE Dra. Dora Ruchansky Prof. Adjunta del Dpto. Bacteriologia y Virologia. Facultad de Medicina – U. D. E. L. A. R


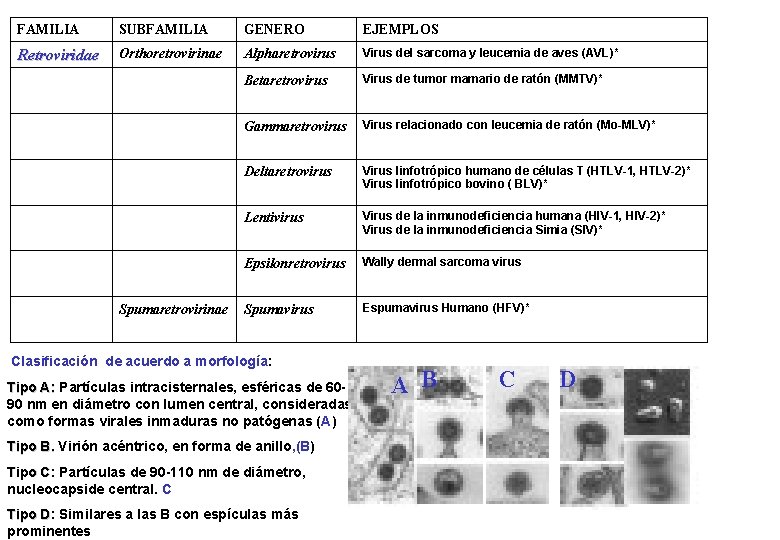
FAMILIA SUBFAMILIA GENERO EJEMPLOS Retroviridae Orthoretrovirinae Alpharetrovirus Virus del sarcoma y leucemia de aves (AVL)* Betaretrovirus Virus de tumor mamario de ratón (MMTV)* Gammaretrovirus Virus relacionado con leucemia de ratón (Mo-MLV)* Deltaretrovirus Virus linfotrópico humano de células T (HTLV-1, HTLV-2)* Virus linfotrópico bovino ( BLV)* Lentivirus Virus de la inmunodeficiencia humana (HIV-1, HIV-2)* Virus de la inmunodeficiencia Simia (SIV)* Epsilonretrovirus Wally dermal sarcoma virus Spumavirus Espumavirus Humano (HFV)* Spumaretrovirinae Clasificación de acuerdo a morfología: Tipo A: Partículas intracisternales, esféricas de 6090 nm en diámetro con lumen central, consideradas como formas virales inmaduras no patógenas (A) Tipo B. Virión acéntrico, en forma de anillo, (B) Tipo C: C Partículas de 90 -110 nm de diámetro, nucleocapside central. C Tipo D: D Similares a las B con espículas más prominentes A B C D

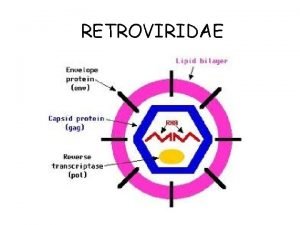
ESTRUCTURA DE LOS RETROVIRUS • Virus esférico envuelto • Diametro: 90 – 130 nm • Pequeñas proyecciones en su superficie • Nucleocapside esférica o en cono truncado • 2% de ácido nucleico. (2 ARN (+) y 1 ARNt (trp, pro, lys). Su tamaño varía entre 8 a 11 kb. Sigla Proteina Función MA Matriz Proteina de la matriz (gen gag) CA Capside Proteinas de la capside (gen gag); protege al core. NC Nucleocapside Proteina de la capside (gen gag); protege al genoma, forma parte del core. PR Proteasa Esencial para el clivaje de la proteina Gag durante la maduración RT Transcriptasa Reversa Retrotranscripción del RNA genómico, también tiene actividad RNAsa. H IN Integrasa Codificada por el gen pol, es necesaria para la integración del provirus Glicoproteínas de superficie Proteina transmembrana Proteínas externas de la envoltura; Antigeno viral muy importante. Interviene en la union al receptor. SU TM Glicoproteinas internas de la envoltura madura

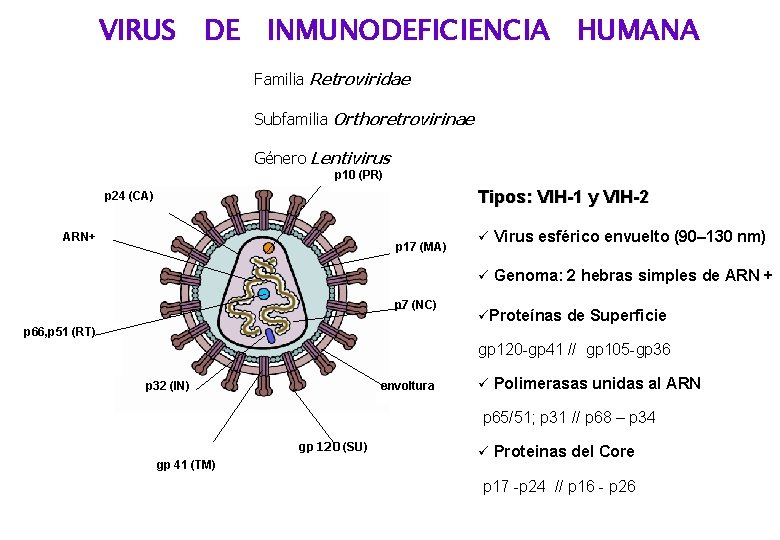
VIRUS DE INMUNODEFICIENCIA HUMANA Familia Retroviridae Subfamilia Orthoretrovirinae Género Lentivirus p 10 (PR) Tipos: VIH-1 y VIH-2 p 24 (CA) ARN+ p 17 (MA) Virus esférico envuelto (90– 130 nm) Genoma: 2 hebras simples de ARN + p 7 (NC) Proteínas de Superficie p 66, p 51 (RT) gp 120 -gp 41 // gp 105 -gp 36 p 32 (IN) envoltura Polimerasas unidas al ARN p 65/51; p 31 // p 68 – p 34 gp 120 (SU) gp 41 (TM) Proteinas del Core p 17 -p 24 // p 16 - p 26

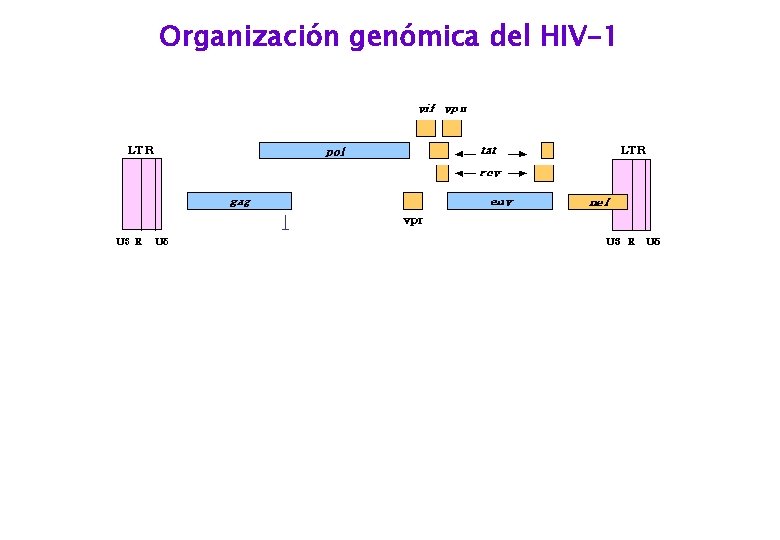
Organización genómica del HIV-1

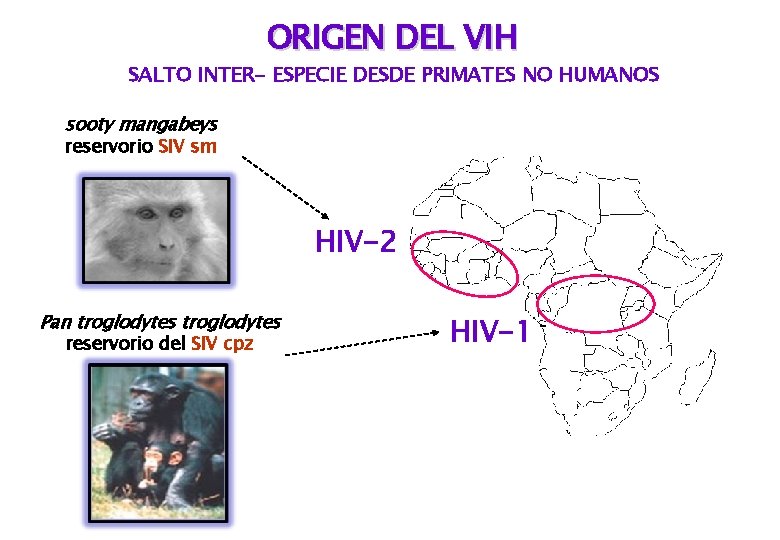
ORIGEN DEL VIH SALTO INTER- ESPECIE DESDE PRIMATES NO HUMANOS sooty mangabeys reservorio SIV sm HIV-2 Pan troglodytes reservorio del SIV cpz HIV-1

¿Cómo saltó el virus simio (SIV) a los humanos? • Se cree que el virus simio se propagó de los chimpancés a los humanos, mediante la matanza de los animales y el consumo de su carne. • Mascotas de primates no humanas.

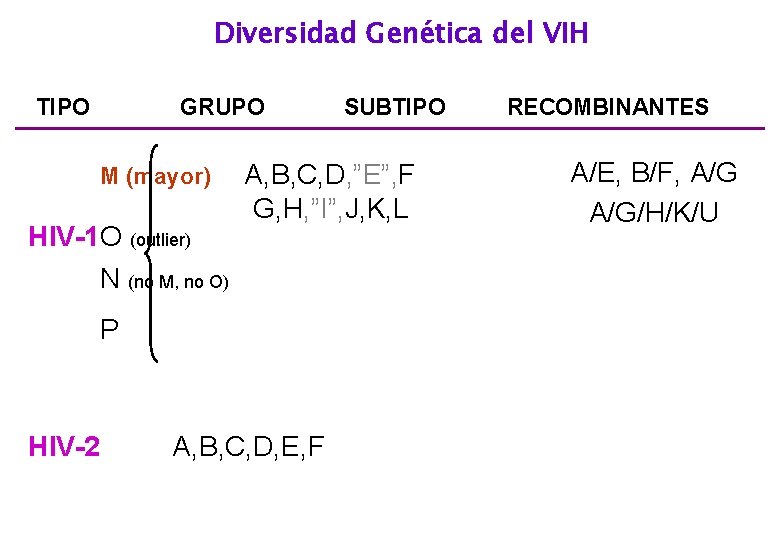
Diversidad Genética del VIH TIPO GRUPO M (mayor) HIV-1 O (outlier) N (no M, no O) A, B, C, D, ”E”, F G, H, ”I”, J, K, L P HIV-2 SUBTIPO A, B, C, D, E, F RECOMBINANTES A/E, B/F, A/G/H/K/U

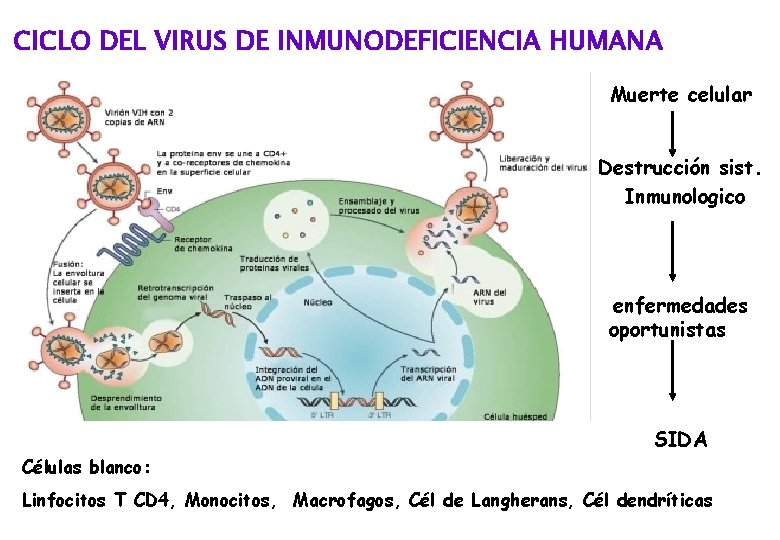
CICLO DEL VIRUS DE INMUNODEFICIENCIA HUMANA Muerte celular Destrucción sist. Inmunologico enfermedades oportunistas SIDA Células blanco: Linfocitos T CD 4, Monocitos, Macrofagos, Cél de Langherans, Cél dendríticas

HISTORIA NATURAL DE LA INFECCION POR VIH Primoinfección Infección asintomática pero progresiva SIDA Riesgo de transmisión Diversidad viral Anticuerpo VIH Cel T Citotóxicas CD 8+ Cel T CD 4+ 4 -8 semanas aprox. 10 años 2 -3 años

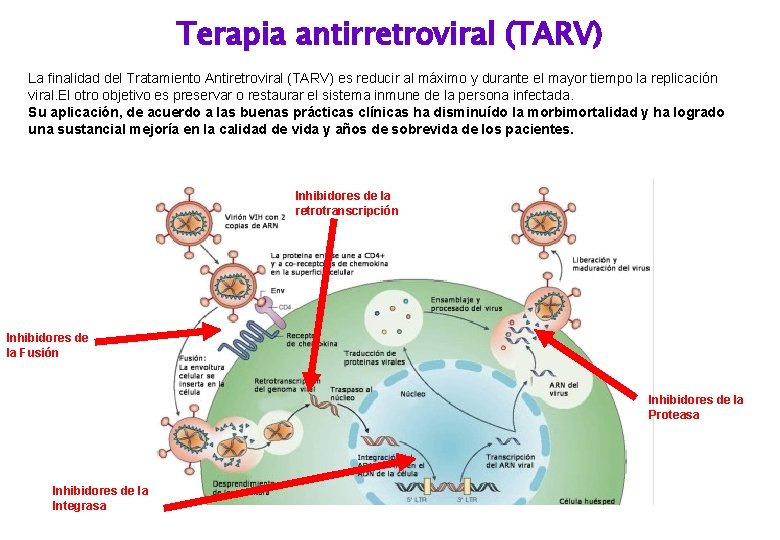
Terapia antirretroviral (TARV) La finalidad del Tratamiento Antiretroviral (TARV) es reducir al máximo y durante el mayor tiempo la replicación viral. El otro objetivo es preservar o restaurar el sistema inmune de la persona infectada. Su aplicación, de acuerdo a las buenas prácticas clínicas ha disminuído la morbimortalidad y ha logrado una sustancial mejoría en la calidad de vida y años de sobrevida de los pacientes. Inhibidores de la retrotranscripción Inhibidores de la Fusión Inhibidores de la Proteasa Inhibidores de la Integrasa

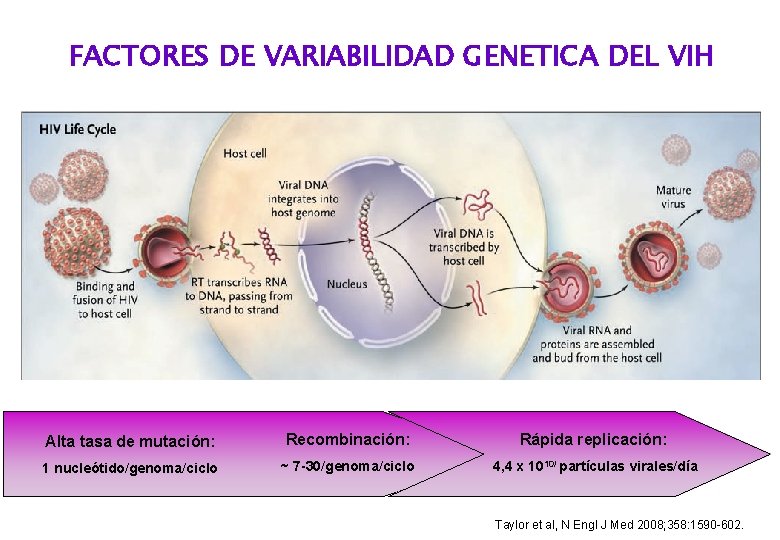
FACTORES DE VARIABILIDAD GENETICA DEL VIH Alta tasa de mutación: Recombinación: Rápida replicación: 1 nucleótido/genoma/ciclo ~ 7 -30/genoma/ciclo 4, 4 x 1010/ partículas virales/día Taylor et al, N Engl J Med 2008; 358: 1590 -602.

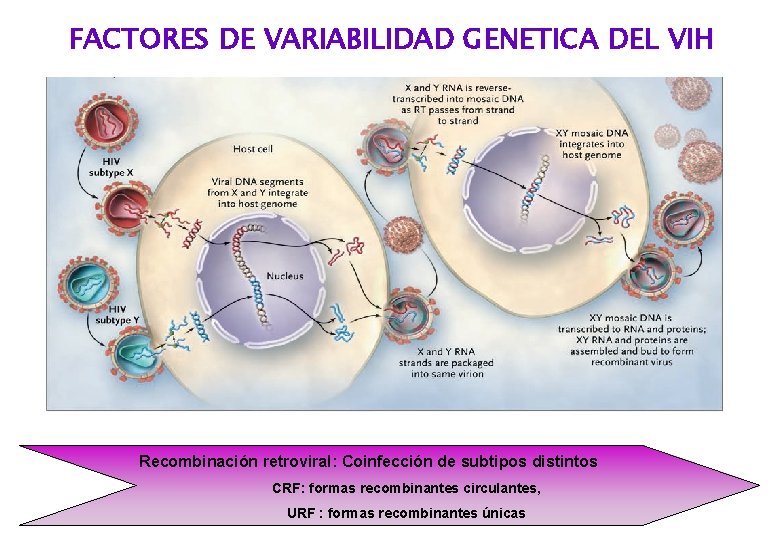
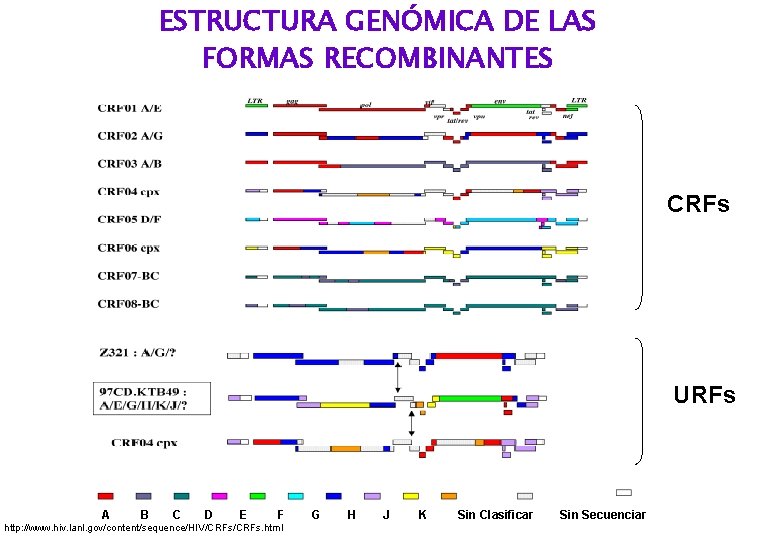
FACTORES DE VARIABILIDAD GENETICA DEL VIH Recombinación retroviral: Coinfección de subtipos distintos CRF: formas recombinantes circulantes, URF : formas recombinantes únicas

ESTRUCTURA GENÓMICA DE LAS FORMAS RECOMBINANTES CRFs URFs A B C D E F http: //www. hiv. lanl. gov/content/sequence/HIV/CRFs. html G H J K Sin Clasificar Sin Secuenciar

Impacto de la Variabilidad Genética en la Epidemia de VIH Transmisión y Progresión de la enfermedad Resistencia antirretroviral Diagnóstico y Monitoreo Formulación de Vacunas Evolución de la Pandemia

DIAGNOSTICO DE LABORATORIO Estudio de respuesta inmune humoral: Ig. M, Ig. A, Ig. G • Test de Tamizaje : • Enzimo inmuno análisis (EIA) • Test rápidos • Aglutinación de partículas • Test Confirmatorios • Western Blot (WB) • Ensayo en Línea (LIA) Detección directa de presencia viral • Estudio de Proteinas virales (Ag p 24) • Estudio de Acidos nucleicos: ADN proviral ARN viral

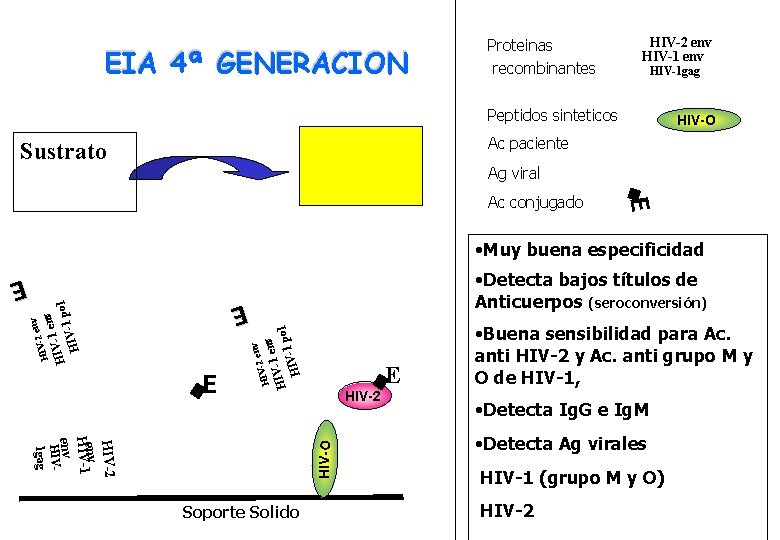
Estudio de respuesta inmune humoral: Ig. M, Ig. A, Ig. G Los test serológicos se basan en la interacción Antígeno – Anticuerpo. • Test de Tamizaje • Son altamente sensibles para poder detectar los Ac en la muestra. • Detectan anticuerpos para HIV-1 y HIV-2 (sin lograr discriminar) • Detectan anticuerpos contra grupo M y O • Antígenos: Lisado total de virus, Proteinas recombinantes, Peptidos sintéticos • Test Confirmatorios • Son altamente específicos para confirmar con certeza la presencia de Ac. Específicos contra HIV. • Pueden discriminar infección por HIV-1 o por HIV-2

EIA 4ª GENERACION Proteinas recombinantes HIV-2 env HIV-1 gag Peptidos sinteticos HIV-O Ac paciente Sustrato Ag viral E Ac conjugado • Muy buena especificidad v -1 en HIV 1 pol HIV -2 en v -1 en V I l H -1 po HIV E E E HIV E v • Detecta bajos títulos de Anticuerpos (seroconversión) HIV-2 env HIV-1 env HIV 1 gag HIV-O HIV-2 Soporte Solido • Buena sensibilidad para Ac. anti HIV-2 y Ac. anti grupo M y O de HIV-1, • Detecta Ig. G e Ig. M • Detecta Ag virales HIV-1 (grupo M y O) HIV-2

TEST RAPIDOS

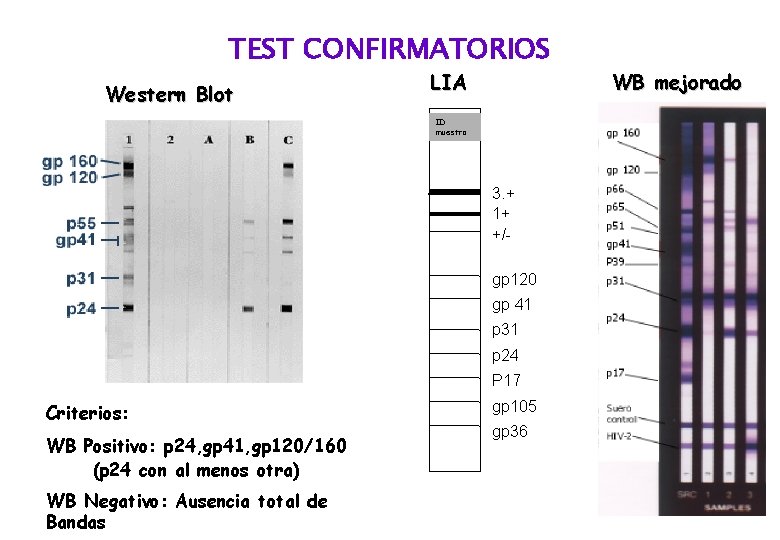
TEST CONFIRMATORIOS Western Blot LIA ID muestra 3. + 1+ +/gp 120 gp 41 p 31 p 24 P 17 Criterios: WB Positivo: p 24, gp 41, gp 120/160 (p 24 con al menos otra) WB Negativo: Ausencia total de Bandas gp 105 gp 36 WB mejorado

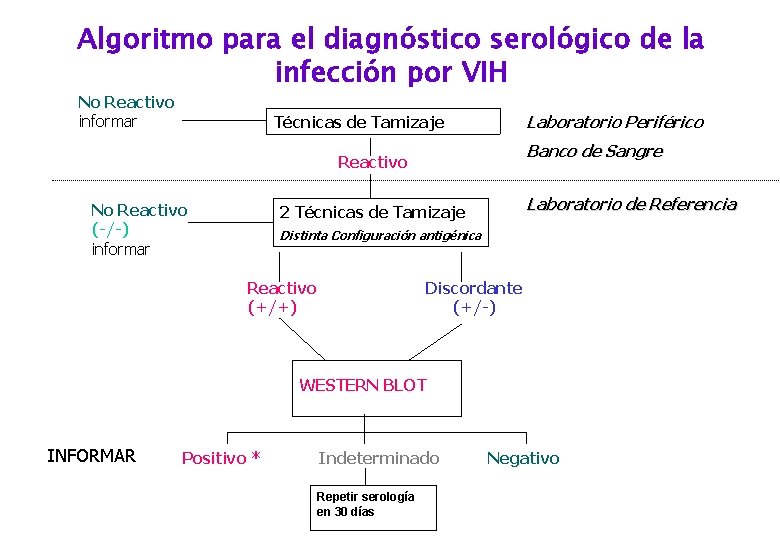
Algoritmo para el diagnóstico serológico de la infección por VIH No Reactivo informar Laboratorio Periférico Técnicas de Tamizaje Banco de Sangre Reactivo No Reactivo (-/-) informar Laboratorio de Referencia 2 Técnicas de Tamizaje Distinta Configuración antigénica Reactivo (+/+) Discordante (+/-) WESTERN BLOT INFORMAR Positivo * Indeterminado Repetir serología en 30 días Negativo

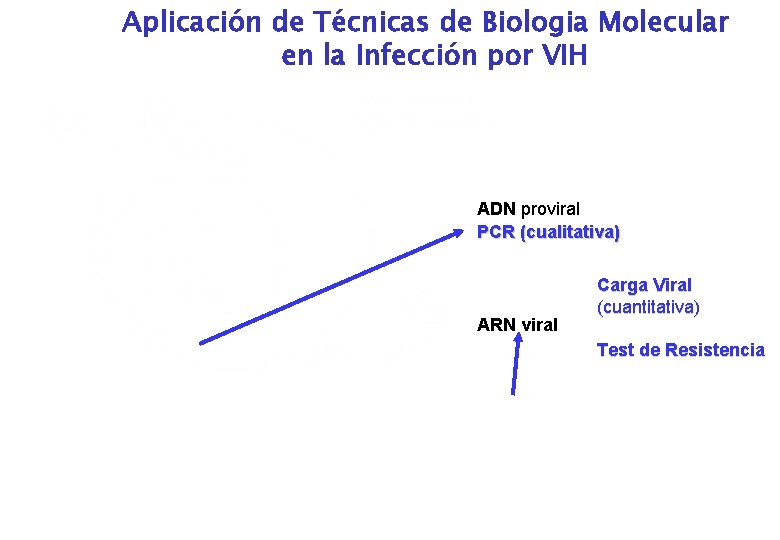
Aplicación de Técnicas de Biologia Molecular en la Infección por VIH ADN proviral PCR (cualitativa) ARN viral Carga Viral (cuantitativa) Test de Resistencia

Aplicación de Técnicas de Biologia Molecular en la Infección por HIV Detección cualitativa de Acido Nucleico (ADN proviral o ARN viral) • Diagnóstico en niños nacidos de madres seropositivas. • Serología indeterminada • Hipoglobulinemia Detección cuantitativa de Acido Nucleico (ARN viral) Carga Viral ( nº copias de ARN v/ml) en pacientes infectados • Inicio de tratamiento • Evaluación de tratamiento • Cambios de tratamiento Estudios de variabilidad genética del VIH • Caracterización molecular de tipos (VIH 1 -VIH 2), subtipos y recombinantes Estudio resistencia a drogas antiretrovirales

infectado serorrevertido Ig. A en sangre: indicador de una respuesta inmunológica específica a la infección viral en el niño.

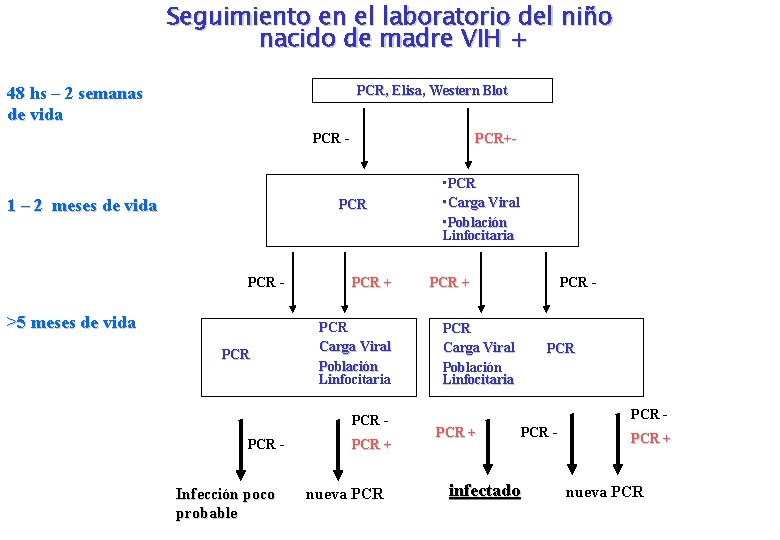
Seguimiento en el laboratorio del niño nacido de madre VIH + 48 hs – 2 semanas de vida PCR, Elisa, Western Blot PCR - 1 – 2 meses de vida PCR+- PCR - >5 meses de vida PCR + PCR Carga Viral Población Linfocitaria PCR - Infección poco probable PCR + nueva PCR • PCR • Carga Viral • Población Linfocitaria PCR + PCR - PCR Carga Viral Población Linfocitaria PCR PCR + PCR - infectado PCR + nueva PCR

Seguimiento en el laboratorio del niño nacido de madre VIH + • Diagnostico de no infección: 3 PCR – 2 muestras negativas en dos momentos distintos en niños >1 mes de vida, más 1 muestra negativa en > 4 meses de vida • Diagnostico de infección: 3 PCR + 3 muestras positivas en dos momentos distintos y al menos una de ellas en niños > 4 meses • Diagnostico de serorreversión: 2 o más muestras con ELISA y Western Blot negativos entre los 6 y 18 meses de edad y dosificación de inmunoglobulinas normales En todos los casos seguir con ELISA hasta 18 meses de edad

El LABORATORIO de VIROLOGÍA EN LA INFECCIÓN POR VIH EN PEDIATRIA Diagnostico de la Infección por VIH • Niños mayores de 18 meses: ELISA - Western Blot • Niños menores de 18 meses: Determinación Cualitativa ADN proviral ARN viral Seguimiento de Niños infectados • Carga Viral : nº de copias de ARN v/ ml Inicio de tratamiento Evaluación de tratamiento Cambios de tratamiento • Estudio de Resistencia a drogas antirretrovirales

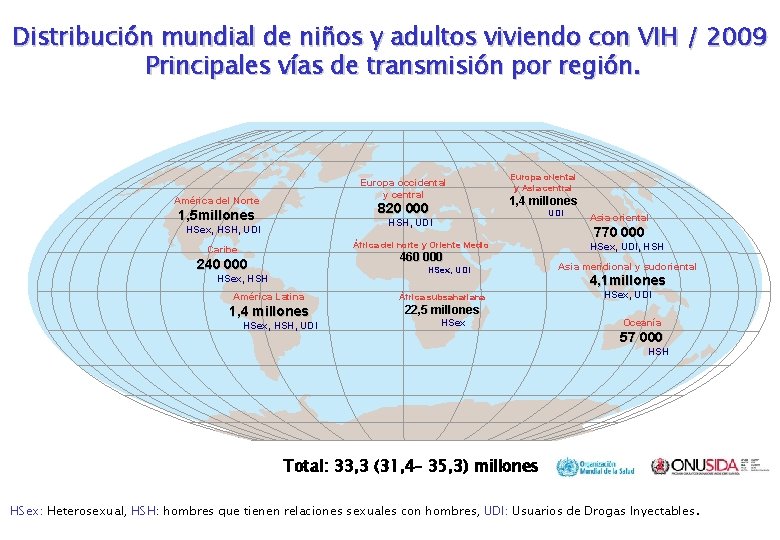
Distribución mundial de niños y adultos viviendo con VIH / 2009 Principales vías de transmisión por región. Europa occidental y central América del Norte 820 000 1, 5 millones Europa oriental y Asia central 1, 4 millones UDI HSH, UDI HSex, HSH, UDI África del norte y Oriente Medio Caribe 460 000 240 000 HSex, UDI HSex, HSH América Latina África subsahariana 1, 4 millones 22, 5 millones HSex, HSH, UDI HSex Asia oriental 770 000 HSex, UDI, HSH Asia meridional y sudoriental 4, 1 millones HSex, UDI Oceanía 57 000 HSH Total: 33, 3 (31, 4– 35, 3) millones HSex: Heterosexual, HSH: hombres que tienen relaciones sexuales con hombres, UDI: Usuarios de Drogas Inyectables.

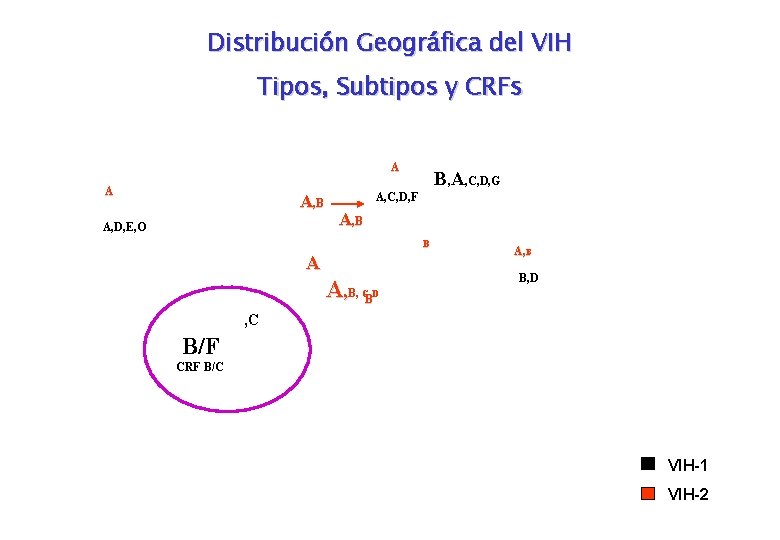
Distribución Geográfica del VIH Tipos, Subtipos y CRFs A A A, B A, D, E, O B, A, C, D, G A, C, D, F A, B B A A, B, C, D B A, B B, D , C B/F CRF B/C VIH-1 VIH-2

Epidemia de VIH en Uruguay Epidemia Concentrada: baja prevalencia en población total (< al 1% )y la prevalencia mayor de 5% en grupos de población clave. Total de casos notificados a 7/ 2010: 13405 (VIH = 9443; SIDA = 3962) Prevalencia en Población general: 0, 42% (2008) Prevalencia en poblaciones vulnerables: - UDI = 18. 5% (2004) - Usuarios cocaína no inyectable: 9. 5% (2004) - Trabajadores sexuales masculinos: 19. 3% (2008 -09) - Trans 36. 5% - HSH: 9% (2008 -09) - PPL: 5. 5% (2008) MSP. ONUSIDA. PITS/SIDA. FCS. OPS. 2008/2009. Informe Epidemiológico VIH/SIDA, DEVISA. MSP, 2010.

Epidemia de VIH en Uruguay En relación al análisis geográfico, 75% de los casos de VIH notificados en Montevideo 25% restante al interior, (> Canelones y Maldonado; siguen Rivera, Tacuarembo, Paysandú y Colonia. En relación al sexo (casos notificados 1/2005 - 7/2010) 54. 1% población de varones 45. 9% población de mujeres En relación a la edad Edad de máxima incidencia entre 25 y 34 años, aunque afecta a todos los grupos etarios.

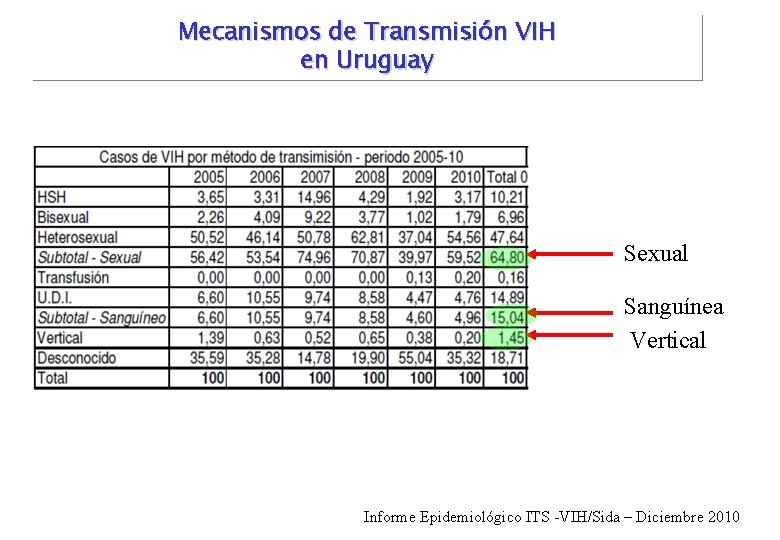
Mecanismos de Transmisión VIH en Uruguay Sexual Sanguínea Vertical Informe Epidemiológico ITS -VIH/Sida – Diciembre 2010

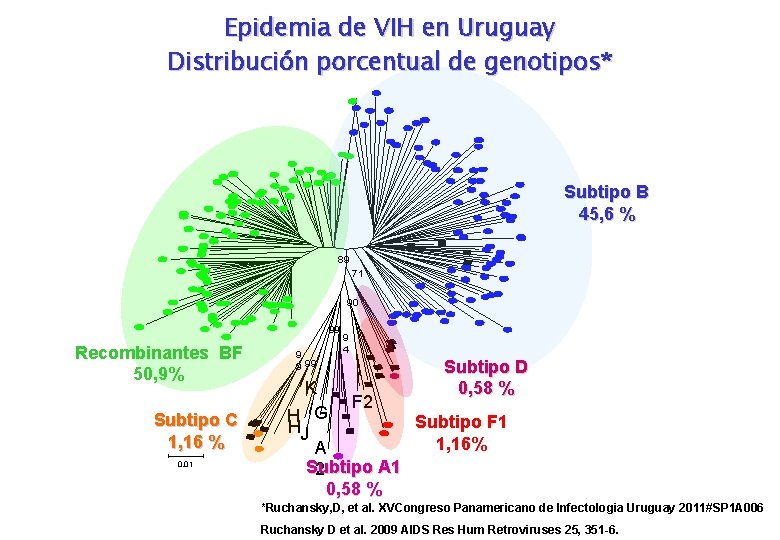
Epidemia de VIH en Uruguay Distribución porcentual de genotipos* Subtipo B 45, 6 % 89 71 90 99 Recombinantes BF 50, 9% Subtipo C 1, 16 % 0. 01 9 9 99 9 4 Subtipo D 0, 58 % K F 2 H G Subtipo F 1 HJ 1, 16% A Subtipo A 1 2 0, 58 % *Ruchansky, D, et al. XVCongreso Panamericano de Infectologia Uruguay 2011#SP 1 A 006 Ruchansky D et al. 2009 AIDS Res Hum Retroviruses 25, 351 -6.

Objetivos de la estrategia de ONUSIDA para 2015: Reducir a la mitad la transmisión sexual del VIH, también entre los jóvenes, los hombres que tienen relaciones sexuales con hombres y dentro del contexto del trabajo sexual. Eliminar la transmisión vertical del VIH y reducir a la mitad la mortalidad materna relacionada con el sida. Prevenir todas las nuevas infecciones por el VIH entre usuarios de drogas. Acceso universal a la terapia antirretrovírica para las personas que viven con el VIH que son elegibles para recibirla. Reducir a la mitad las muertes por tuberculosis en personas que viven con el VIH. Incluir en las estrategias de protección social nacionales a las personas que viven con el VIH y a los hogares afectados por el virus, quienes además tienen acceso a servicios de atención y apoyo esenciales. Reducir a la mitad el número de países con leyes y prácticas punitivas en torno a la transmisión del VIH, el trabajo sexual, el consumo de drogas o la homosexualidad que bloquean las respuestas efectivas. Eliminar en la mitad de los países que las imponen las restricciones en la entrada, estancia y residencia relacionadas con el VIH. Abordar las necesidades relacionadas con el VIH de mujeres y niñas en, al menos, la mitad de las respuestas nacionales al VIH. Tolerancia cero con la violencia de género.

Bibliografía: • Temas de Bacteriología y Virología Médica. 3º Edición. 2008 Oficina del Libro FEFMUR • Fields Virology. David M. Knipe and Peter M. Howley. Fifth edition. Lippincott Williams and Wilkins. 2007. • HIV/AIDS epidemiology, pathogenesis, prevention, and treatment. Lancet. 2006 Aug 5 ; 368(9534): 489 -504. • The challenge of HIV-1 subtype diversity. Taylor BS, Sobieszczyk ME, Mc. Cutchan FE, Hammer SM. N Engl J Med. 2008 Apr 10; 358(15): 1590 -602. • http: //www. msp. gub. uy/homepidemiologia_198_1. html • http: //www. unaids. org/es/
 Retroviridae
Retroviridae Llena la tabla adjunta de la siguiente manera
Llena la tabla adjunta de la siguiente manera Una empresa de arriendo de autos cobra 70000
Una empresa de arriendo de autos cobra 70000 Matrizes inversas
Matrizes inversas Pere ubu dora maar
Pere ubu dora maar Dhcp dora process
Dhcp dora process Dora chico
Dora chico Juridicum prüfereinteilung
Juridicum prüfereinteilung Nagy dóra adriána
Nagy dóra adriána Zlatni rez
Zlatni rez Tikvicki dóra
Tikvicki dóra In dora
In dora Frane bitunjac
Frane bitunjac Dora mali
Dora mali Dora luz llanes herrera
Dora luz llanes herrera Remembrance emily bronte
Remembrance emily bronte Interdictum de arboribus caedendis
Interdictum de arboribus caedendis Dora la exploradora
Dora la exploradora Scheiber dóra
Scheiber dóra Dora pejačević
Dora pejačević Book de preguntas chilecompra 2020 con respuestas
Book de preguntas chilecompra 2020 con respuestas Franz kafka (1883-1924)
Franz kafka (1883-1924) Dora perelli
Dora perelli Cuál es la misión de la familia
Cuál es la misión de la familia Que es familia agregada
Que es familia agregada Los 10 mandamientos del noviazgo
Los 10 mandamientos del noviazgo Doctora pilar del prado
Doctora pilar del prado Dra comprehension rubric
Dra comprehension rubric Dra comparison chart
Dra comparison chart Dra pamela santos
Dra pamela santos Mirella gomes de souza
Mirella gomes de souza Dra survivors
Dra survivors Dra daniela jakubowicz
Dra daniela jakubowicz Dra mariana gadelha
Dra mariana gadelha Dra margarita villar
Dra margarita villar Ucla dom dra
Ucla dom dra Hipocalcemia leve moderada severa
Hipocalcemia leve moderada severa