Eletroqumica II ELETRLISE Ao contrrio das pilhas a





















- Slides: 31

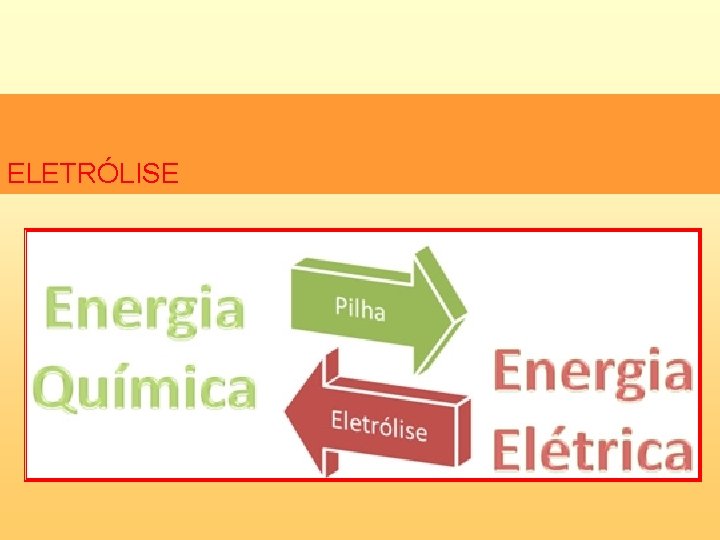
Eletroquímica (II)

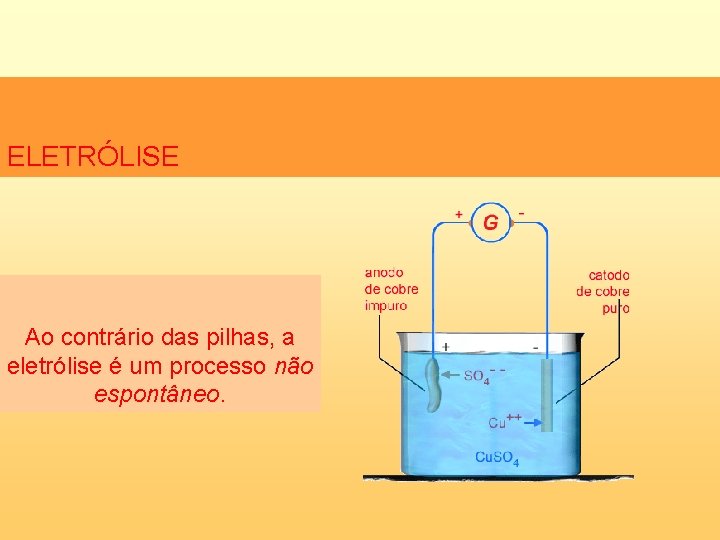
ELETRÓLISE Ao contrário das pilhas, a eletrólise é um processo não espontâneo.

ELETRÓLISE Na eletrólise ocorre uma reação de oxi-redução não espontânea que consome corrente elétrica de uma bateria ligada ao sistema.

ELETRÓLISE

ELETRÓLISE X PILHA 1. NODO a) Na pilha fornece elétrons, sinal (-); b) Na eletrólise recebe elétrons dos ânions do eletrólito, sinal (+). 2. CÁTODO a) Na pilha recebe elétrons, sinal (+); b) Na Eletrólise fornece elétrons dos cátions do eletrólito, sinal (-).

ELETRÓLISE ÍGNEA É o processo de decomposição de uma substância iônica fundida por meio da passagem de corrente elétrica.

ELETRÓLISE ÍGNEA A eletrólise ígnea exige eletrodos inertes que possuam elevado ponto de fusão. Geralmente são usados a platina ou grafita. A eletrólise do Na. Cℓ é um processo economicamente importante. O Na. Cℓ se funde à temperatura de 808 ºC. Na. Cℓ(sólido) Na. Cℓ (líquido) Ocorre, então, dissociação. . . Na. Cℓ Na 1+ + Cℓ 1 -

ELETRÓLISE ÍGNEA Os íons Cℓ 1 - se dirigem para o ânodo (pólo positivo), perdem seus elétrons e são transformados em gás cloro, Cℓ 2. 2 Cℓ 1 - Cℓ 2 + 2 e- (oxidação) Os íons Na 1+ se dirigem para o cátodo (pólo negativo), recebem um elétron e são transformados em sódio metálico (Na 0). * 2 Na 1+ + 2 e- 2 Na 0 (redução) *Duplica-se para igualar o número de elétrons na redução e na oxidação.

ELETRÓLISE ÍGNEA Considerando-se. . . 2 Na. Cℓ(l) 2 Na 1+(l) + 2 Cℓ 1 -(l) Cℓ 2(g) + 2 e- (oxidação) 2 Na 1+(l) + 2 e- 2 Na 0(l) (redução) A equação global da eletrólise é. . . 2 Na. Cℓ(l) Cℓ 2(g) + 2 Na 0(l)

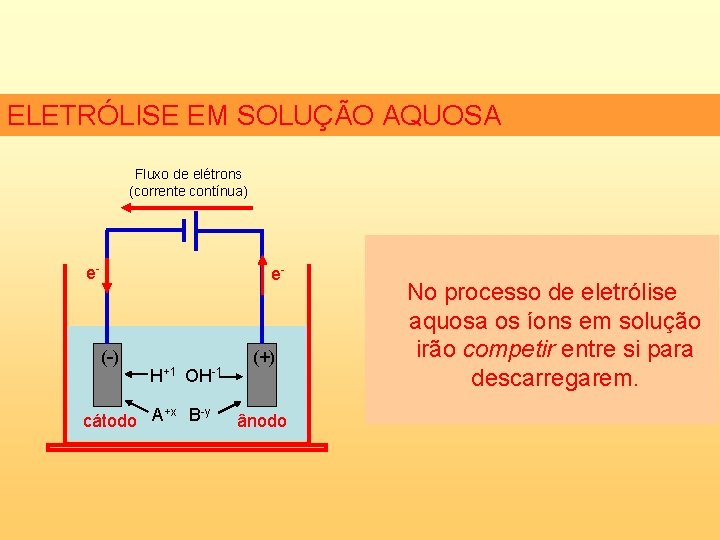
ELETRÓLISE EM SOLUÇÃO AQUOSA Fluxo de elétrons (corrente contínua) e- e- (-) H+1 OH-1 -y +x cátodo A B (+) ânodo No processo de eletrólise aquosa os íons em solução irão competir entre si para descarregarem.

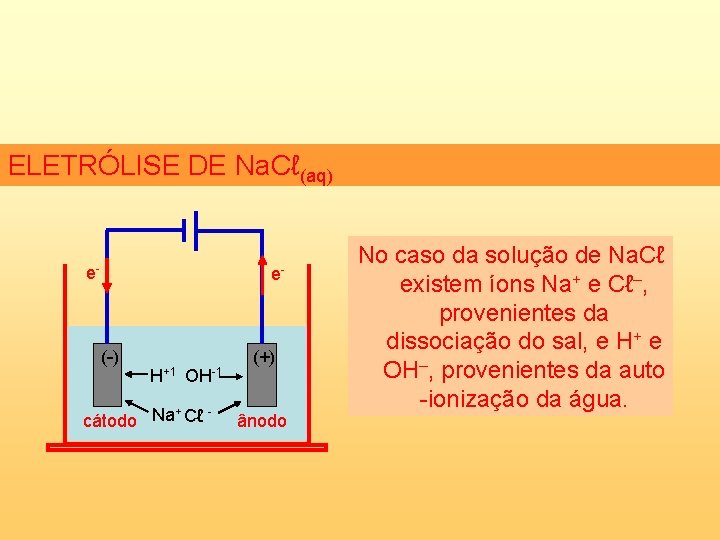
ELETRÓLISE DE Na. Cℓ(aq) e- e- (-) H+1 OH-1 + cátodo Na Cℓ (+) ânodo No caso da solução de Na. Cℓ existem íons Na+ e Cℓ–, provenientes da dissociação do sal, e H+ e OH–, provenientes da auto -ionização da água.

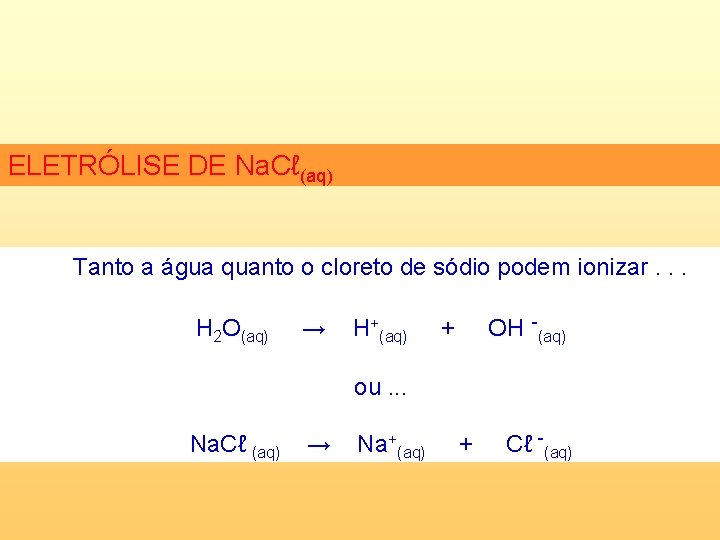
ELETRÓLISE DE Na. Cℓ(aq) Tanto a água quanto o cloreto de sódio podem ionizar. . . H 2 O(aq) → H+(aq) + OH -(aq) ou. . . Na. Cℓ (aq) → Na+(aq) + Cℓ -(aq)

ELETRÓLISE DE Na. Cℓ(aq) Significa que temos teremos uma competição. . . H 2 O(aq) → H+(aq) + OH -(aq) Competição Na. Cℓ (aq) → Na+(aq) + Cℓ -(aq)

ELETRÓLISE DE Na. Cℓ(aq) O que a experiência mostra? O POLO NEGATIVO DESCARREGA EM PRIMEIRO LUGAR, O CÁTION DE REDUÇÃO MAIS FÁCIL O POLO POSITIVO DESCARREGA EM PRIMEIRO LUGAR O NION DE OXIDAÇÃO MAIS FÁCIL

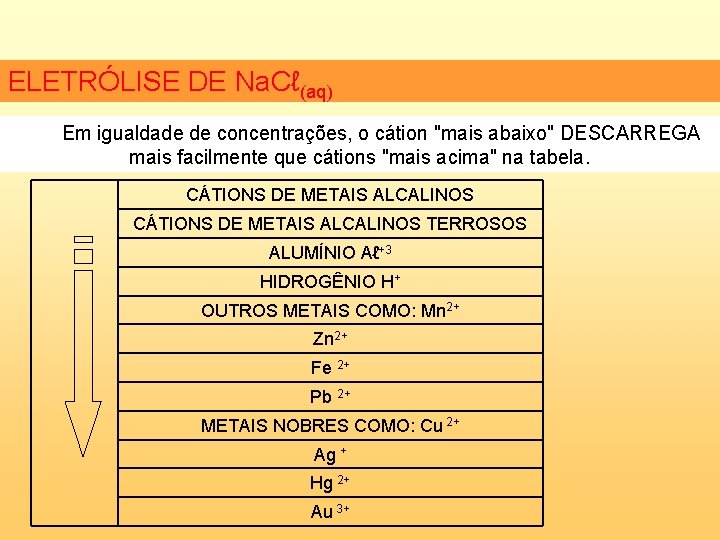
ELETRÓLISE DE Na. Cℓ(aq) Em igualdade de concentrações, o cátion "mais abaixo" DESCARREGA mais facilmente que cátions "mais acima" na tabela. CÁTIONS DE METAIS ALCALINOS TERROSOS ALUMÍNIO Aℓ+3 HIDROGÊNIO H+ OUTROS METAIS COMO: Mn 2+ Zn 2+ Fe 2+ Pb 2+ METAIS NOBRES COMO: Cu 2+ Ag + Hg 2+ Au 3+

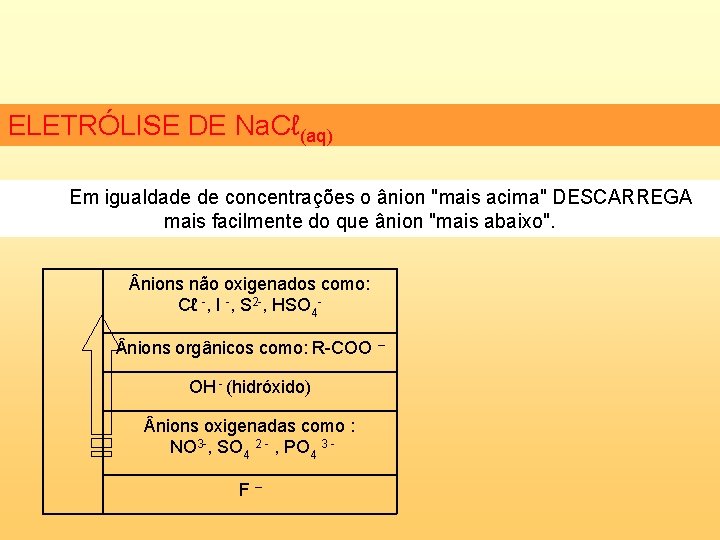
ELETRÓLISE DE Na. Cℓ(aq) Em igualdade de concentrações o ânion "mais acima" DESCARREGA mais facilmente do que ânion "mais abaixo". nions não oxigenados como: Cℓ -, I -, S 2 -, HSO 4 nions orgânicos como: R-COO – OH - (hidróxido) nions oxigenadas como : NO 3 -, SO 4 2 - , PO 4 3 - F –

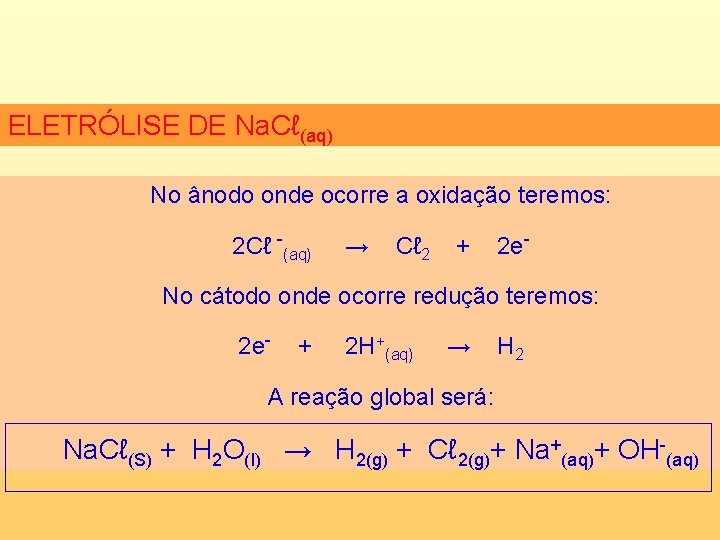
ELETRÓLISE DE Na. Cℓ(aq) No ânodo onde ocorre a oxidação teremos: 2 Cℓ -(aq) → Cℓ 2 + 2 e- No cátodo onde ocorre redução teremos: 2 e- + 2 H+(aq) → H 2 A reação global será: Na. Cℓ(S) + H 2 O(l) → H 2(g) + Cℓ 2(g)+ Na+(aq)+ OH-(aq)

ELETRÓLISE do KI(aq) No processo dessa eletrólise aquosa os íons em solução também irão competir entre si para descarregarem. No caso da solução de KI existem íons K+ e I–, provenientes da dissociação do sal, e H+ e OH–, provenientes da auto-dissociação da água.

ELETRÓLISE do KI(aq) De forma semelhante, observando-se a prioridade de descarga, na eletrólise do KI aquoso há formação de H 2(no cátodo) e I 2(no ânodo) e liberação de Na+OH-(aq). Experimento dos alunos Cassiane e Pedro.

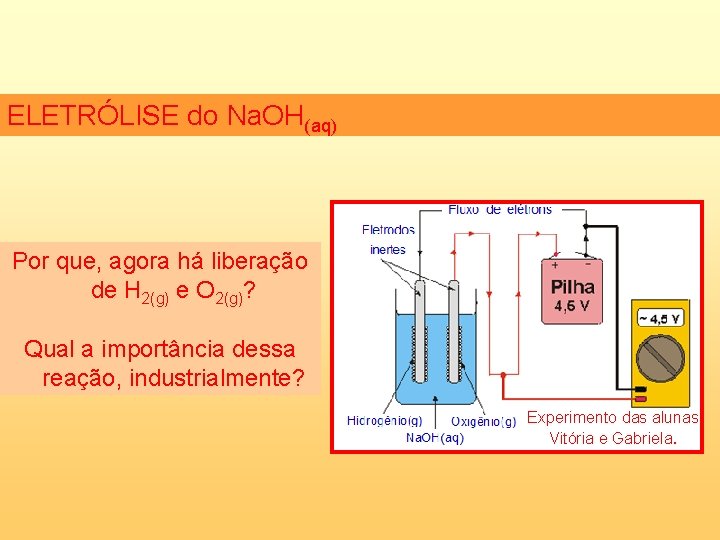
ELETRÓLISE do Na. OH(aq) Por que, agora há liberação de H 2(g) e O 2(g)? Qual a importância dessa reação, industrialmente? Experimento das alunas Vitória e Gabriela.

ELETRÓLISE QUANTITIVA Michael Faraday formulou duas leis que regem o aspecto quantitativo da eletrólise Michael Faraday (1791 — 1867)

ELETRÓLISE QUANTITIVA A primeira lei de FARADAY “A massa, “m”, de uma substância, formada ou transformada numa eletrólise, é diretamente proporcional à carga elétrica, Q, que atravessa o circuito. ” m = K 1. Q

ELETRÓLISE QUANTITIVA Sabe-se (da Física) que. . . Q = i. t Substituindo na lei de Faraday, temos. . . m = K 1. i. t * i é a intensidade da corrente elétrica e t é o tempo de reação.

ELETRÓLISE QUANTITIVA A segunda lei de FARADAY “A massa, m, de uma substância, formada ou transformada numa eletrólise, é diretamente proporcional ao equivalente-grama, E, dessa substância. ” m = K 2. E

ELETRÓLISE QUANTITIVA De forma semelhante ao raciocínio anterior. . . Sabendo que m = K 2. E E que Q = i. t Então. . . m = K 2. E. i. t

ELETRÓLISE QUANTITIVA Associando as duas leis e considerando K=1/96500 teremos. . . Constante de Faraday = 96500 C, ou seja, quantidade de carga elétrica transportada por 1 mol de elétrons (6, 02 x 1023 elétrons).

ELETRÓLISE QUANTITIVA: EXEMPLIFICANDO Uma solução de cloreto de prata é eletrolisada durante 965 segundos por uma corrente elétrica de 1 ampère (A). Qual a massa de prata depositada no cátodo? Dado da tabela periódica: Ag = 108 g / mol 1. ª parte *Um mol de elétrons transferidos pela Ag.

ELETRÓLISE QUANTITIVA Uma solução de cloreto de prata é eletrolisada durante 965 segundos por uma corrente elétrica de 1 ampère (A). Qual a massa de prata depositada no cátodo? Dado da tabela periódica: Ag = 108 g / mol 2. ª parte *C = A. s

ELETRÓLISE (GALVANOPLASTIA) * Banhos eletrolíticos de metais - cromo, níquel, zinco, cobre, ouro, prata, . . .

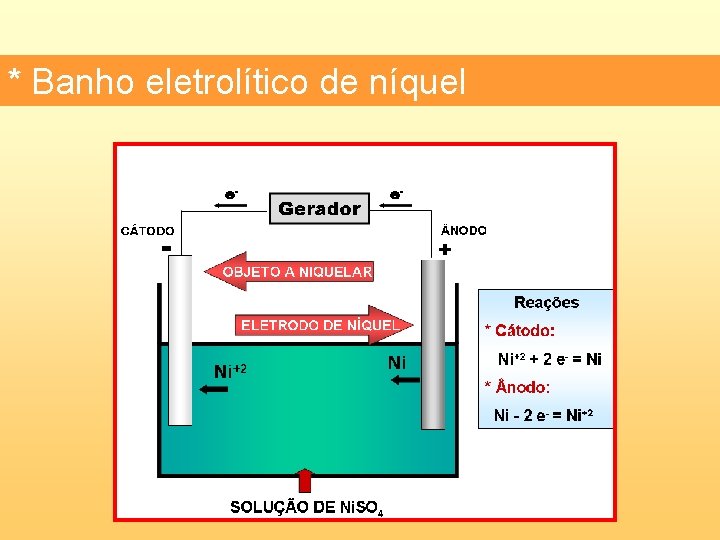
* Banho eletrolítico de níquel

F I M Colégio INEDI Prof. Luiz Antônio Tomaz
 M=eit/96500
M=eit/96500 Contrrio
Contrrio Pilhas comerciais
Pilhas comerciais Ecoponto metal
Ecoponto metal Jesus ich bin das licht der welt
Jesus ich bin das licht der welt Das alte ist vergangen das neue angefangen
Das alte ist vergangen das neue angefangen Reflexões do poeta canto v
Reflexões do poeta canto v Eu fico com pureza da resposta
Eu fico com pureza da resposta Das alles ist deutschland das alles sind wir
Das alles ist deutschland das alles sind wir Teorema das cevianas
Teorema das cevianas Binomische formeln wie geht das
Binomische formeln wie geht das Mahashweta das
Mahashweta das Wort roboter
Wort roboter Sete trombetas
Sete trombetas Granito faz efervescência
Granito faz efervescência Was das hirn alles kann
Was das hirn alles kann Lei de kirchhoff das correntes
Lei de kirchhoff das correntes Ciclo das briofitas
Ciclo das briofitas Os filhos das trevas são mais astutos
Os filhos das trevas são mais astutos Lei das expectativas iteradas
Lei das expectativas iteradas Divisão binária
Divisão binária Cemitério das polacas rio de janeiro
Cemitério das polacas rio de janeiro Inhaltsbezogene grammatik
Inhaltsbezogene grammatik Internet das coisas
Internet das coisas Strafen bei cybermobbing
Strafen bei cybermobbing Dr dwijen das silchar
Dr dwijen das silchar Na metodologia das partidas dobradas
Na metodologia das partidas dobradas Skkm richtlinie für das führen im katastropheneinsatz
Skkm richtlinie für das führen im katastropheneinsatz Manual unificado das sociedades internas
Manual unificado das sociedades internas O mapa é uma das mais antigas formas gráficas
O mapa é uma das mais antigas formas gráficas Spitze dass du da bist
Spitze dass du da bist Danke leben
Danke leben