PILHAS ELETROQUMICA FsicoQumica Prof Alex AULA 01 PILHAS













- Slides: 21

PILHAS ELETROQUÍMICA (Físico-Química) Prof: Alex AULA 01

PILHAS Eletroquímica Prof: Alex “Parte da físico -química que estuda o envolvimento das reações químicas com a eletricidade”

PILHAS Pilhas (Célula Voltaica ou Galvânica) Prof: Alex “Dispositivo elétrico que gera corrente elétrica a partir de reações de oxirredução ” Espontâneo Energia Química Elétrica

PILHAS Oxirredução Prof: Alex X o(s) X n+(aq) Aumentar o NOX Perder elétrons Agente redutor ou simplesmente redutor. Oxidar :

PILHAS Oxirredução Prof: Alex X n+(aq) X o(s) Diminuir o NOX Ganhar elétrons Agente oxidante ou simplesmente oxidante. Reduzir :

PILHAS Histórico Prof: Alex (1786) Galvani Propôs a “eletricidade animal” observando o contato de metais com os músculos (1800) da coxa. Volta de rãs. Construção da primeira pilha. “Rosário” (moedas de cobre+ placas de zinco e feltro

PILHAS Conceitos Importantes Prof: Alex Nas pilhas os elétrons fluem do eletrodo onde ocorre a oxidação (ânodo) para o eletrodo que sofre redução (cátodo), através de um fio externo. O voltímetro ligado a este fio irá medir a força eletromotriz (fem ou E). U=E-r. i Obs: Na química, as pilhas são geradores ideais, com r=zero. Assim: U=E , ou seja, a

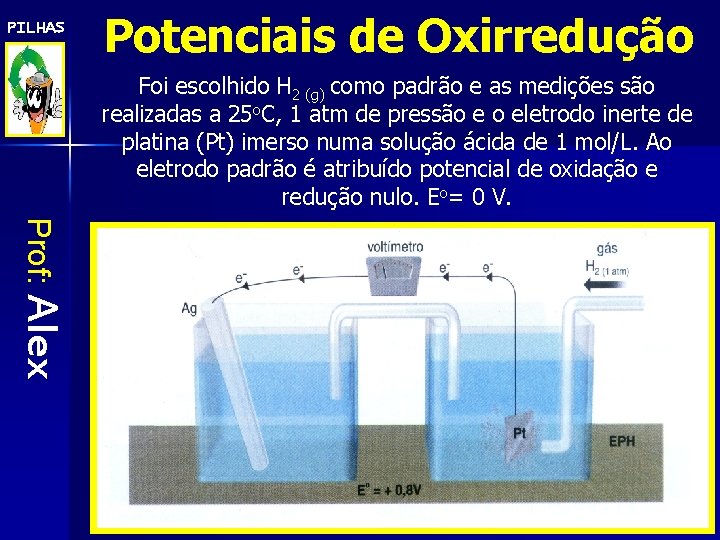
PILHAS Potenciais de Oxirredução Foi escolhido H 2 (g) como padrão e as medições são realizadas a 25 o. C, 1 atm de pressão e o eletrodo inerte de platina (Pt) imerso numa solução ácida de 1 mol/L. Ao eletrodo padrão é atribuído potencial de oxidação e redução nulo. Eo= 0 V. Prof: Alex

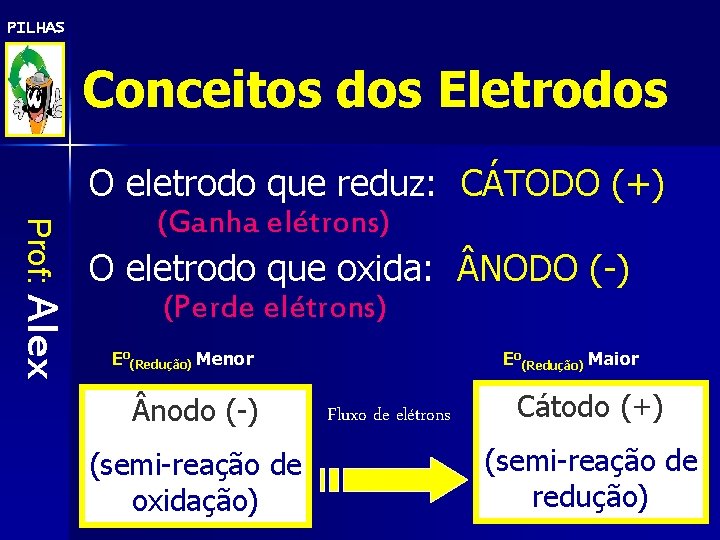
PILHAS Conceitos dos Eletrodos Prof: Alex O eletrodo que reduz: CÁTODO (+) (Ganha elétrons) O eletrodo que oxida: NODO (-) (Perde elétrons) Eo(Redução) Menor nodo (-) (semi-reação de oxidação) Eo(Redução) Maior Fluxo de elétrons Cátodo (+) (semi-reação de redução)

PILHAS Pilha de Daniell Em 1836, o químico e meteorologista inglês John Frederic Daniell construiu uma pilha diferente de Volta, substituindo as soluções ácidas por soluções de sais. Prof: Alex e. Eo=-0, 76 V (ânodo) - + Zn. SO 4 Cu. SO 4 Eo=+034 V (cátodo)

PILHAS As Equações: Dados: Cu 2+ + 2 e- Cu (mantém) Eo= +0, 34 V Zn 2+ + 2 e- Zn (inverte) Eo= -0, 76 V Prof: Alex Cu 2+ + 2 e- Cu Eo= +0, 34 V Zn 2+ + 2 e- Eo= +0, 76 V Zn(s) + Cu 2+(aq) Zn 2+(aq)+ Cu(s) (Equação global da pilha) (ddp= + 1, 1 V) ddp= Eo=voltagem=fem= Eo(maior) – Eo(menor)= 0, 34 – (-0, 76)= 1, 1 V Representação IUPAC para a pilha: Zn / Zn 2+ // Cu 2+ / Cu

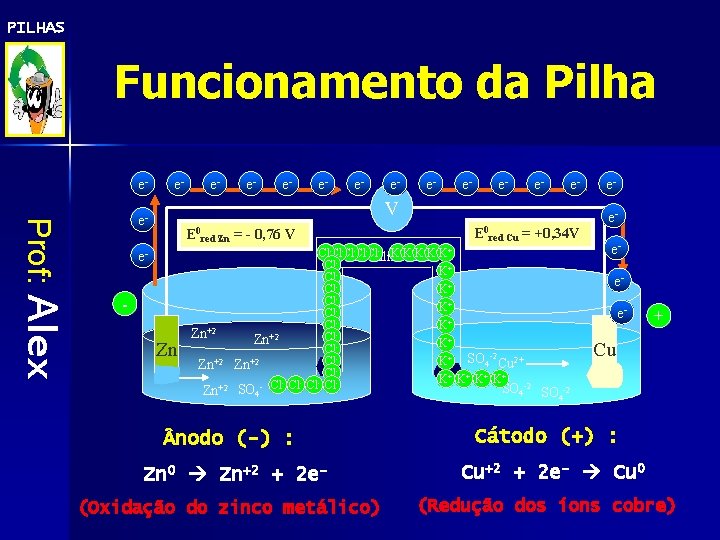
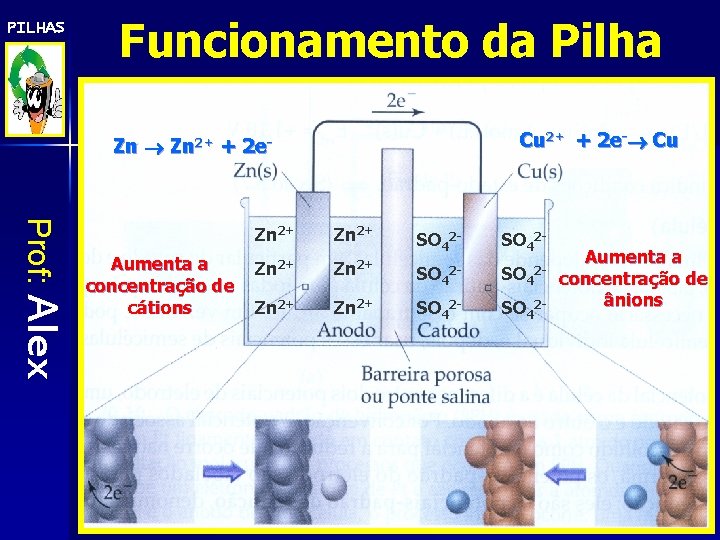
PILHAS Funcionamento da Pilha e- e- e- e- Prof: Alex V e- E 0 red Zn = - 0, 76 V e- - Zn Zn+2 E 0 red Cu = +0, 34 V -Cl-Cl-Cl- K+K+K+ Cl-Cl Ponte salina KCl Cl K+ Cl. Cl. K+ +2 Cl Zn K+ Cl. K+ SO 4 -2 Cu 2+ Zn+2 Cl. K+ K+ -2 Cl Cl SO SO 4 4 eeeee- Cu SO 4 -2 nodo (-) : Cátodo (+) : Zn 0 Zn+2 + 2 e- Cu+2 + 2 e- Cu 0 (Oxidação do zinco metálico) + (Redução dos íons cobre)

PILHAS Funcionamento da Pilha Cu 2+ + 2 e- Cu Zn 2+ + 2 e- Prof: Alex Aumenta a concentração de cátions Zn 2+ SO 42 - Zn 2+ SO 42 - 2 - 2 - SO 42 - Aumenta a concentração de ânions

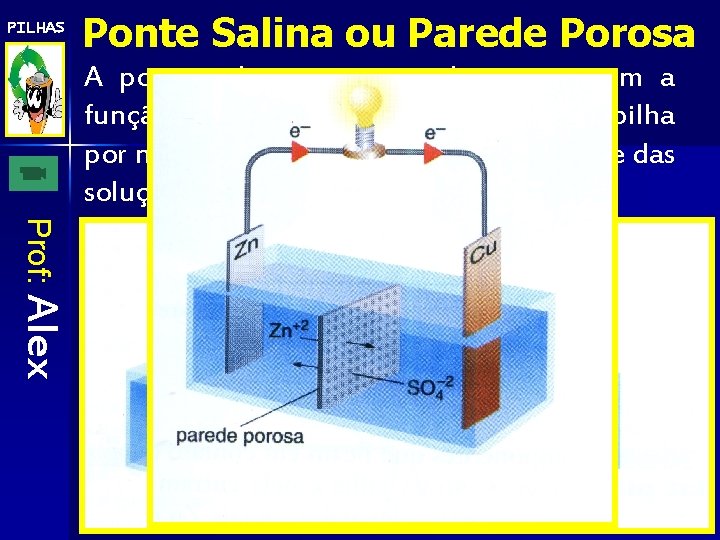
PILHAS Ponte Salina ou Parede Porosa A ponte salina ou a parede porosa tem a função de manter o funcionamento da pilha por mais tempo, mantendo a neutralidade das soluções de cada uma das células. Prof: Alex

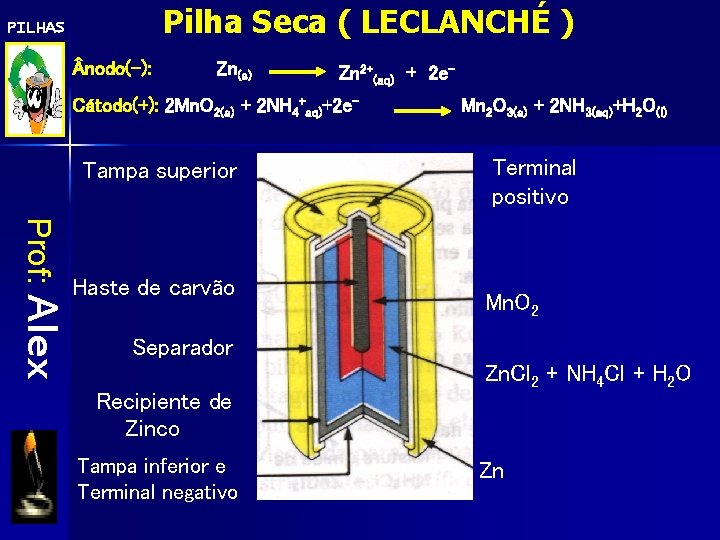
Pilha Seca ( LECLANCHÉ ) PILHAS nodo(-): Zn(s) Zn 2+(aq) + 2 e- Cátodo(+): 2 Mn. O 2(s) + 2 NH 4+aq)+2 e- Tampa superior Prof: Alex Haste de carvão Mn 2 O 3(s) + 2 NH 3(aq)+H 2 O(l) Terminal positivo Mn. O 2 Separador Recipiente de Zinco Tampa inferior e Terminal negativo Zn. Cl 2 + NH 4 Cl + H 2 O Zn

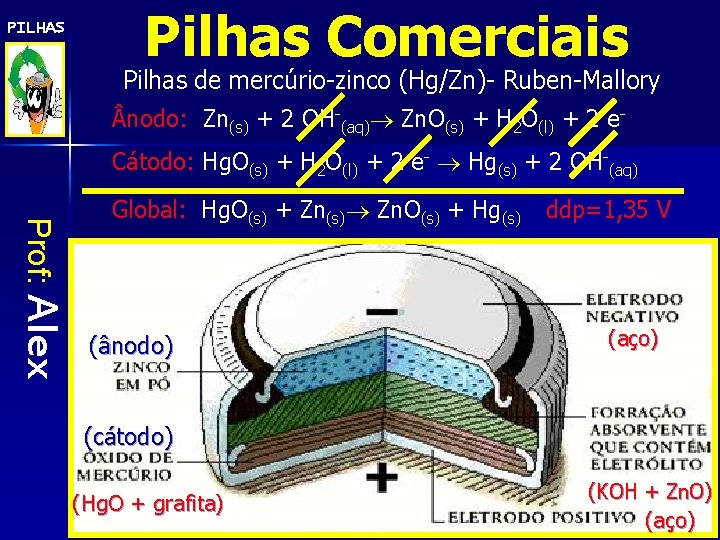
PILHAS Pilhas Comerciais Pilhas de mercúrio-zinco (Hg/Zn)- Ruben-Mallory nodo: Zn(s) + 2 OH-(aq) Zn. O(s) + H 2 O(l) + 2 e. Cátodo: Hg. O(s) + H 2 O(l) + 2 e- Hg(s) + 2 OH-(aq) Prof: Alex Global: Hg. O(s) + Zn(s) Zn. O(s) + Hg(s) (ânodo) ddp=1, 35 V (aço) (cátodo) (Hg. O + grafita) (KOH + Zn. O) (aço)

PILHAS Pilhas Comerciais Acumuladores ou baterias (chumbo-ácido) (ânodo) Pb(s)+HSO 4 -(aq)+H 2 O(l) Pb. SO 4 (s)+H 3 O+(aq)+2 e- Prof: Alex (cátodo) Pb. O 2(s)+HSO 4 -(aq)+3 H 3 O+(l)+2 e- Pb. SO 4(s)+5 H 2 O(l) (global) Pb(s)+Pb. O 2(s)+2 HSO 4 -(aq)+2 H 3 O+(aq) 2 Pb. SO 4(s)+4 H 2 O(l)

PILHAS Bateria Níquel/Cádmio nodo: Cd(s) + 2 OH-(aq) Cd(OH)2 (s) + 2 e- Prof: Alex Cátodo: 2 Ni. O(OH)(s) + 2 H 2 O(l) + 2 e- 2 Ni(OH)2 (s) + 2 OH-(aq) Global: Cd(s) + 2 Ni. O(OH)(s)+ 2 H 2 O(l) Cd(OH)2 (s) + 2 Ni(OH)2(s) ddp=1, 35 V

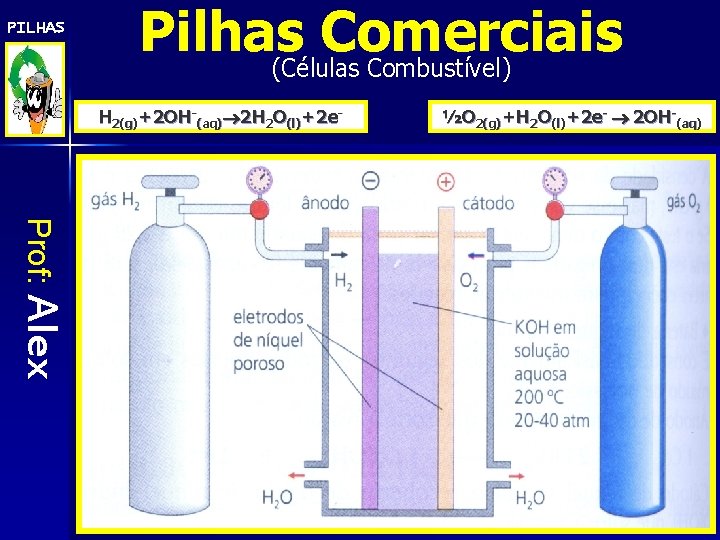
PILHAS Pilhas Comerciais (Células Combustível) H 2(g)+2 OH-(aq) 2 H 2 O(l)+2 e- ½O 2(g)+H 2 O(l)+2 e- 2 OH-(aq) Prof: Alex

PILHAS Corrosão Prof: Alex

PILHAS Metal de Sacrifício (A PROTEÇÃO CATÓDICA) Prof: Alex Uma forma eficiente de proteção contra a corrosão consiste em ligar placas de magnésio ou zinco, à placa de ferro. Zn 2+ + 2 e- Zn Eo=-0, 76 V Mg 2+ + 2 e- Mg Eo=-2, 38 V Fe 2+ + 2 e- Fe Eo=-0, 44 V
 Pilhas comerciais
Pilhas comerciais Ecoponto pilhas
Ecoponto pilhas Psychology
Psychology Alex what are you doing
Alex what are you doing Alex wild ants
Alex wild ants Alexander shneider
Alexander shneider Eduardo pezo castañeda
Eduardo pezo castañeda Alex gett
Alex gett Alex hugger
Alex hugger Alex c. snoeren
Alex c. snoeren Oxibutirina
Oxibutirina Kay walton artist
Kay walton artist Gladys
Gladys Pueblos
Pueblos Alex islet
Alex islet Alex espinoza giacomozzi
Alex espinoza giacomozzi Pdt alex
Pdt alex Alex sitar
Alex sitar Cardio alex
Cardio alex Alex pereira siblings
Alex pereira siblings Alexander kurk
Alexander kurk Alex erdmann
Alex erdmann