Dficits en sphingomylinase Olivier Lidove Au nom du

























- Slides: 39

Déficits en sphingomyélinase Olivier Lidove, Au nom du Groupe CETNP - Lipidoses Médecine Interne Hôpital Croix-Saint-Simon, 75020 Paris olidove@hopital-dcss. org Réunion Nationale CETL 20 Juin 2013 Toulouse

Liens d’intérêt • Billets d’avion et collaborations scientifiques : • GSK • Sanofi-Genzyme • Shire HGT

Groupe : • • • O Lidove, Médecine Interne I Durieu, Médecine Interne MT Vanier, Biochimie T Levade, Biochimie N Belmatoug, Médecine Interne • Et Groupe CETNP - Lipidoses

Niemann Pick type B • SMPD 1 = sphingomyelin phosphodiesterase 1 = acid sphigomyelinase (ASM) – Cultured skin fibroblasts or leucocytes • AR, 11 p 15. 4 • 0. 4 to 0. 6/100 000 newborns • 2 alleles A : type A; 2 alleles B : type B; 1 A and 1 B : type B • R 608 del – 42% of patients – 25% of alleles

Niemann Pick type B • Initial presentation – Spleen 78% – Liver 73% • Symptoms – Bleeding 49% – Pulmonary infections 42% – Shortness of breath 42% – Joint/limb pain : 39% Mc. Govern MM, et al. Paediatrics 2008.

Treatment ? • Stop tobacco • Risk of coronary artery disease – Atherogenic lipid profile • No specific treatment is available • « Quality of life seems to be normal in some cases »

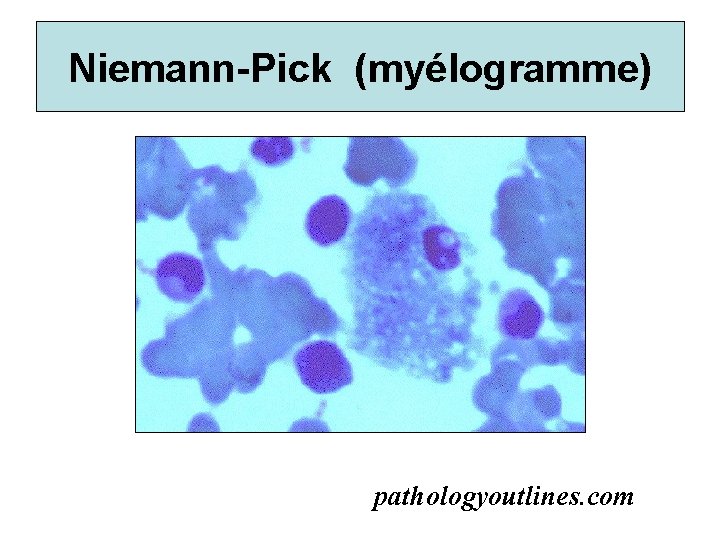
Niemann-Pick (myélogramme) pathologyoutlines. com

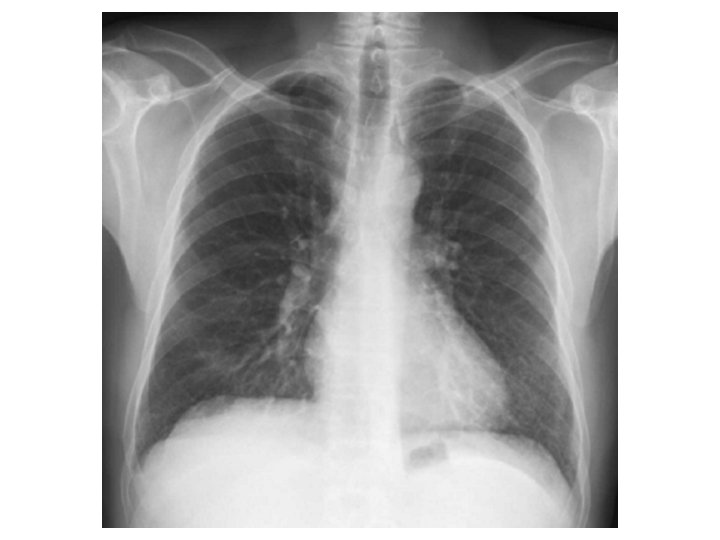
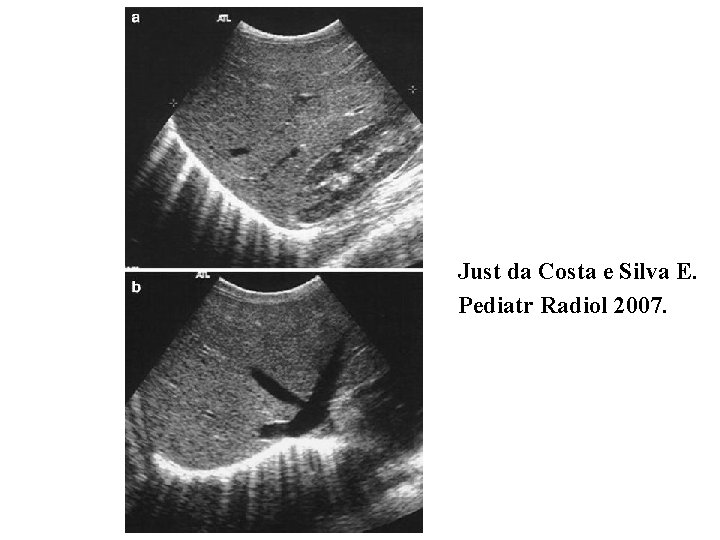
Radiographie thoracique



Just da Costa e Silva E. Pediatr Radiol 2007.

Risque de cirrhose • 1 patient décédé à 31 ans • Plusieurs autres patients français en insuffisance hépatique • Littérature récente Mc. Govern MM, et al. Genet Med 2013 [Epub ahead of print] Thurberg BL, et al. Am J Surg Pathol 2012; 36: 1234 -46.

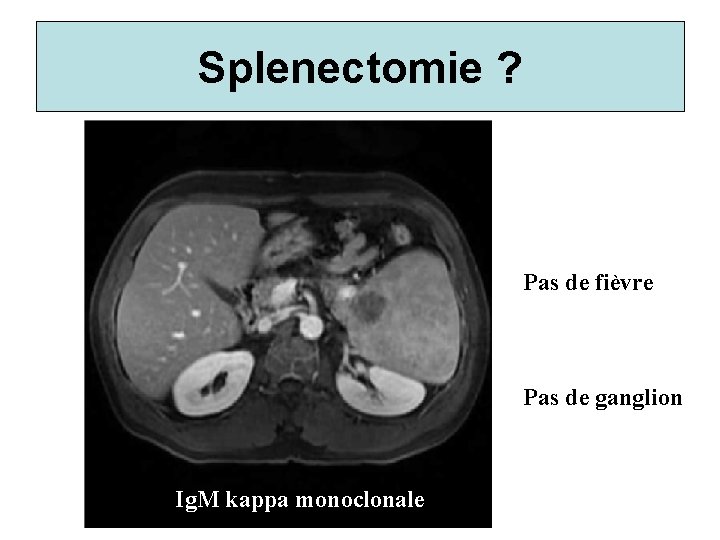
Splenectomie ? Pas de fièvre Pas de ganglion Ig. M kappa monoclonale

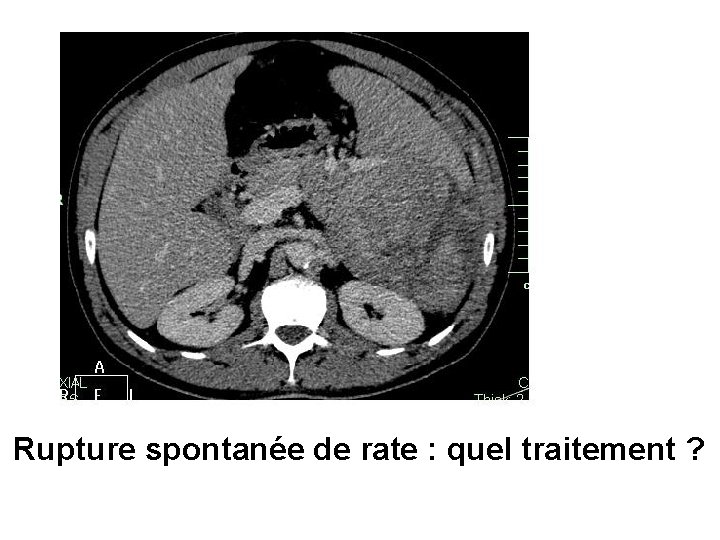
Rupture spontanée de rate : quel traitement ?

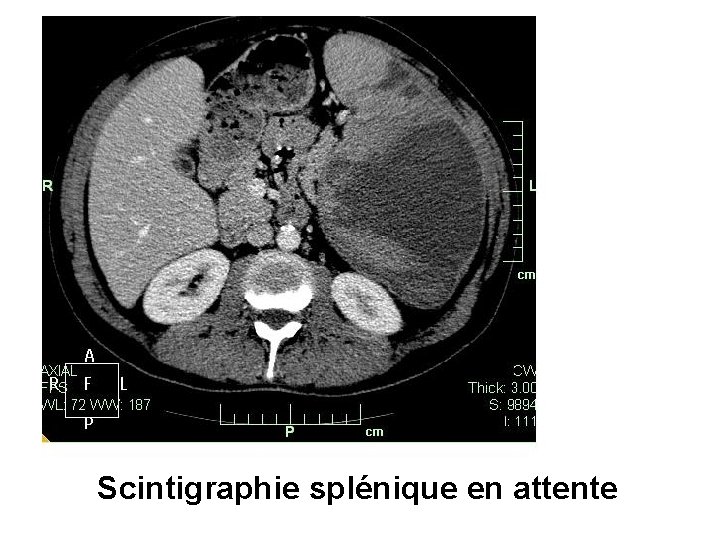
Scintigraphie splénique en attente

Etudes précliniques

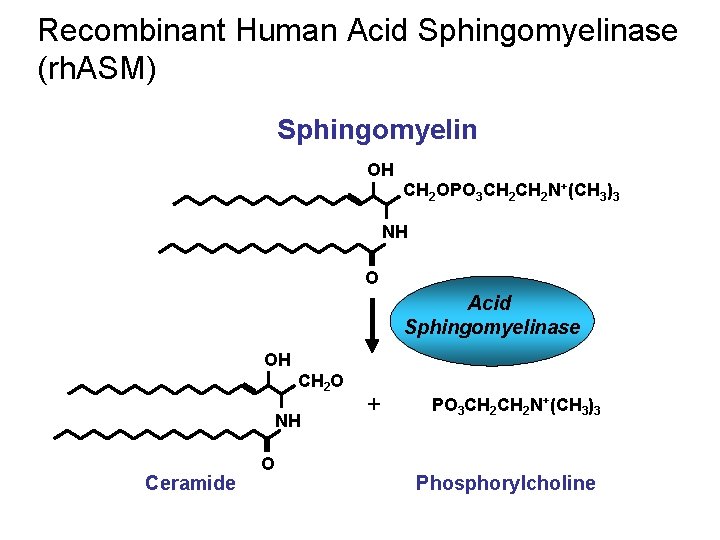
Recombinant Human Acid Sphingomyelinase (rh. ASM) Sphingomyelin OH CH 2 OPO 3 CH 2 N+(CH 3)3 NH O Acid Sphingomyelinase OH CH 2 O NH Ceramide O + PO 3 CH 2 N+(CH 3)3 Phosphorylcholine

rh. ASM • Over-expression of human c. DNA in CHO cells • Purification of rh. ASM glycoprotein • Preclinical studies in ASMKO mice provide proof of concept for ERT – Dose-dependent reduction of sphingomyelin in organs – Establish biweekly dosing regimen for human use

Perspectives thérapeutiques: Enzymothérapie substitutive • Modèle murin avec inactivation du gène de la sphingomyelinase (qui a une forme neurologique) • Sphingomyélinase humaine recombinante (Genzyme) • Etude préclinique princeps (2000) – Miranda et al, 2000 Faseb J : « Infusion of recombinant ASM into NP mice leads to visceral, but not neurological, correction of the pathophysiology » – Effet sur atteinte systémique mais pas sur atteinte neurologique

Preclinical Toxicity Studies of rh. ASM 1 • IV rh. ASM decreased sphingomyelin levels in ASMKO mice in a dosedependent manner (liver, spleen > lung) • High doses of rh. ASM (≥ 10 mg/kg) resulted in the deaths of ASMKO mice, but not of normal animals – Cardiovascular shock, cytokine elevations – Liver inflammation/degeneration, adrenal hemorrhage • Toxicity appeared related to rapid sphingomyelin degradation • Several low doses followed by high dose rh. ASM prevented toxicity and death • NOAEL: Single dose = 0. 3 mg/kg; Repeat dose > 3 mg/kg 1 Genzyme data on file NOAEL – no observable adverse effect level

Pourquoi la phase 1 a-t-elle été retardée? • Résultats inattendus lors des essais précliniques sur la souris ASM-ko – Doses très élevées (≥ 10 mg/kg) de rh. ASM tuent les souris ASM-ko mais pas les non atteintes • Choc cardiovasculaire, élévation des cytokines • Inflammation/dégénération hépatique, hémorragie surrénale – Cause: dégradation rapide de la sphingomyéline – Plusieurs injections de faibles doses précédant une forte dose: prévention – Définition des doses sans effet adverse (NOAEL): • Dose unique: 0. 3 mg/kg ; ultérieure: 3 mg/kg

Etudes cliniques

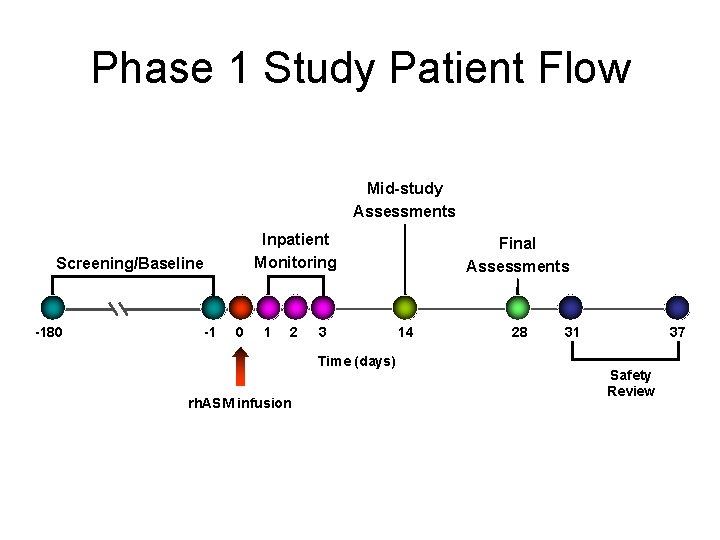
Phase 1 Study Patient Flow Mid-study Assessments Inpatient Monitoring Screening/Baseline -180 -1 0 1 2 3 Time (days) rh. ASM infusion Final Assessments 14 28 31 37 Safety Review

Niemann-Pick B : phase I Design et objectifs : single ascending dose study to evaluate the safety and pk profile of single doses of rh. ASM in ASMD patients § Janvier 2007 -> fin Mars 2009 ; 11 adultes § 1 seul centre (Mount Sinaï Hospital, New York) § Doses : – 0. 03 et 0. 1 mg/kg (3 patients / dose) – 0. 3 et 0. 6 mg/kg (2 patients /dose) – 1 mg/kg (1 patient) § Tolérance, p. K, p. D § Résultats présentés à plusieurs congrès et réunions d’associations NP (US et UK) en 2010 et 2011. 24

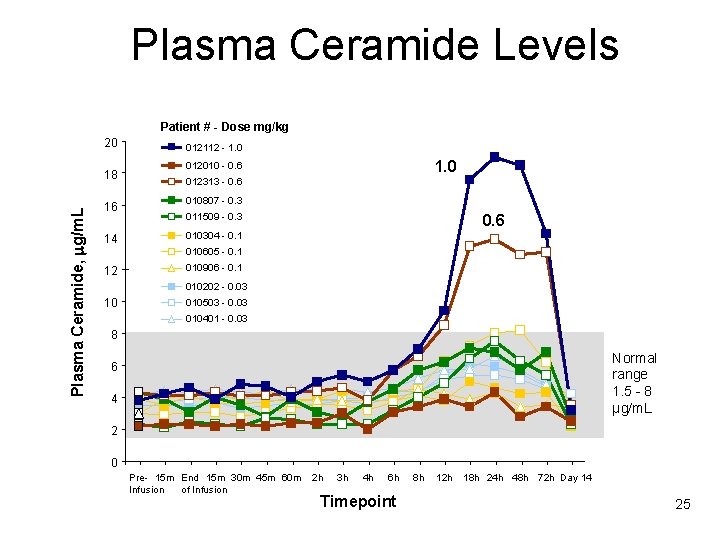
Plasma Ceramide Levels Patient # - Dose mg/kg 20 Plasma Ceramide, mg/m. L 18 16 14 012112 - 1. 0 012010 - 0. 6 012313 - 0. 6 010807 - 0. 3 011509 - 0. 3 0. 6 010304 - 0. 1 010605 - 0. 1 12 010906 - 0. 1 010202 - 0. 03 10 010503 - 0. 03 010401 - 0. 03 8 Normal range 1. 5 - 8 µg/m. L 6 4 2 0 Pre- 15 m End 15 m 30 m 45 m 60 m Infusion of Infusion 2 h 3 h 4 h 6 h Timepoint 8 h 12 h 18 h 24 h 48 h 72 h Day 14 25

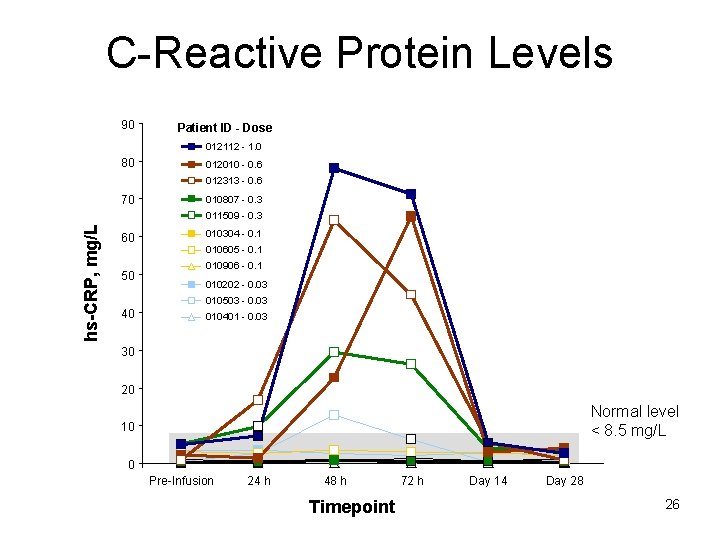
C-Reactive Protein Levels 90 Patient ID - Dose 012112 - 1. 0 80 012010 - 0. 6 012313 - 0. 6 70 010807 - 0. 3 hs-CRP, mg/L 011509 - 0. 3 60 50 010304 - 0. 1 010605 - 0. 1 010906 - 0. 1 010202 - 0. 03 010503 - 0. 03 40 010401 - 0. 03 30 20 Normal level < 8. 5 mg/L 10 0 Pre-Infusion 24 h 48 h Timepoint 72 h Day 14 Day 28 26

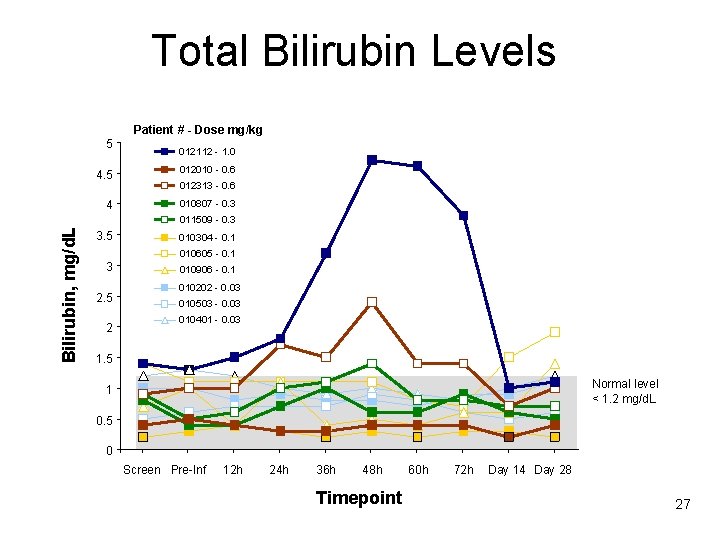
Total Bilirubin Levels 5 Patient # - Dose mg/kg 012112 - 1. 0 4. 5 012010 - 0. 6 4 010807 - 0. 3 012313 - 0. 6 Bilirubin, mg/d. L 011509 - 0. 3 3. 5 010304 - 0. 1 010605 - 0. 1 3 2. 5 2 010906 - 0. 1 010202 - 0. 03 010503 - 0. 03 010401 - 0. 03 1. 5 Normal level < 1. 2 mg/d. L 1 0. 5 0 Screen Pre-Inf 12 h 24 h 36 h 48 h Timepoint 60 h 72 h Day 14 Day 28 27

Phase 1 – Summary • rh. ASM was bioactive in vivo • Drug-related AEs after single doses of rh. ASM – Dose-related (≥ 0. 3 mg/kg) – Mostly moderate, transient – Constitutional symptoms began 12 -24 hrs post-dose – Hyperbilirubinemia and acute phase reactants peaked at 48 hrs post -dose and resolved by Day 14 • No cardiovascular or adrenal hormone dysfunction • Maximum tolerated single dose was 0. 6 mg/kg – Dose-limiting toxicity was hyperbilirubinemia • rh. ASM had a prolonged t 1/2 in plasma (10 -15 hr)

Essai de phase I : Conclusion • Des niveaux élevés de produits de dégradation de la sphingomyéline (tel le céramide) semblent induire une réponse inflammatoire et interférer avec le métabolisme de la bilirubine • Plusieurs biomarqueurs de suivi de la tolérance ont été identifiés – Céramide – Bilirubine – CRP, IL-8, calcitonine…. • Argumentaire en faveur de l’administration de doses croissantes chez un même patient pour diminuer l’apparition d’EIs => essai de phase 1 b

Phase 1 b “ An open-label Multicenter, ascending dose study of the tolerability and safety of recombinant Acid Sphingomyelinase (rh. ASM) in patients with Acid Sphingomyelinase Deficiency (ASMD)» • Obj : evaluate safety, tolerability, pharmacokinetic and pharmacodynamic profile of rh. ASM • 6 patients • Countries : UK (Manchester St Mary’s Hospital), US (Mount Sinai, NY) • FPI : April 2013 • Participants will receive rh. ASM of an initial dose of 0, 1 mg/kg, followed by several dose escalations, as tolerated, up to 3, 0 mg/kg. All doses are given 2 weeks apart. • Study duration : 26 weeks • Upon completion of the 6 month trial, participants may have option to continue receiving rh. ASM on a long-term basis under an extension protocol

Recombinant Human Acid Sphingomyelinase (rh. ASM) for ASM Deficiency (Niemann-Pick Disease) Phase 2 Trial (SPHINGO 00709)

Phase 2 – Design Overview • Study objectives : to evaluate the safety, efficacy, and pharmacokinetics of different doses of rh. ASM administered intravenously every 2 weeks for 52 weeks • Study design : phase 2, multinational, multicenter, randomized, openlabel, repeat-dose, dose-comparison study • • Study duration : Screening : up to 60 days Treatment period : 52 weeks Post-treatment period : up to 37 days • Samples size : at least 15 patients • Countries : US, UK, France, Germany, Italy, Brazil, Chile • First patient in : Jan 2014 32

Phase 2 – Endpoints • Primary Efficacy Endpoint - % reduction in spleen volume (MN) by MRI – 15 patient Trial (5 per arm) is powered (>90%) to detect a clinically meaningful reduction in spleen volume (>20%) and dose responsiveness (linear trend test by ANOVA) – Assumptions - spleen volume reductions of 30, 45, and 60% (0. 3, 1, and 3 mg/kg), standard deviation 10%, 15% dropouts, two-sided p<0. 05 • Secondary Endpoints – Liver volume - MRI – Pulmonary imaging – CXR, HRCT – Pulmonary function tests - % predicted DLco/FVC/FEV 1/TV – Exercise capacity by cycle ergometry - % predicted maximum workload, O 2 consumption, and CO 2 production – Physician global assessment – Efficacy biomarker – chitotriosidase – Hematology – platelet count, hemoglobin, WBC

Phase 2 : inclusion • • • Plus de 18 ans Déficit en sphingomyélinase acide 20 < patient >= 80% DLCO Rate > 6 N – splénectomie partielle Test grossesse négatif Contraception efficace

Phase 2 : exclusion • Co-morbidité sévère (INR > 1. 5, plaquettes < 60 000, HTAP, valvulopathie, FEVG < 40%, transaminases > 250, bilirubine > 1. 5 mg/dl) … • Greffe (moelle, foie) • Splénectomie • Traitements hépatotoxiques (dont statines) • Certains psychotropes • Allaitement • …

Remerciements Centre de Référence Maladies Lysosomales (Coordination : Dr Nadia Belmatoug) Hôpital Beaujon, Clichy Dr Jerôme Stirnemann Dr Frédéric Sedel Prof. Bruno Crestani, Pneumologie, Bichat Prof. Jean-Pierre Laissy, Radiologie, Bichat Dr. Pascal Jacquenod, Radiologie, Croix St Simon

Remerciements à Genzyme pour les informations détaillées concernant les résultats de la phase 1


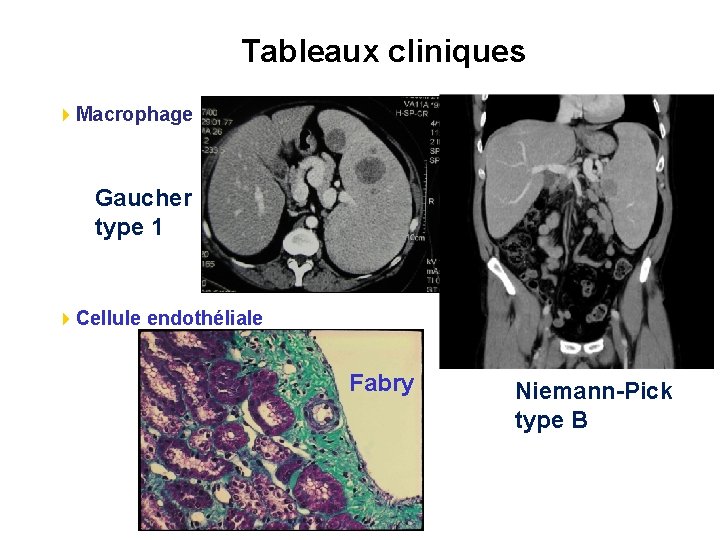
Tableaux cliniques 4 Macrophage Gaucher type 1 4 Cellule endothéliale Fabry Niemann-Pick type B
 Sphingomylinase
Sphingomylinase Synthèse nom propre nom commun
Synthèse nom propre nom commun úls
úls Olivier blanchard macroeconomia
Olivier blanchard macroeconomia Charles olivier bacri
Charles olivier bacri Juan carlos niebles
Juan carlos niebles Fernande olivier
Fernande olivier Eps olivier
Eps olivier Olivier sidokpohou
Olivier sidokpohou Olivier couet
Olivier couet Olivier thomann
Olivier thomann Tristan olivier
Tristan olivier Olivier rukundo
Olivier rukundo Olivier caleff
Olivier caleff Olivier veean
Olivier veean Olivier sacroug
Olivier sacroug Olivier callot
Olivier callot Olivier elemento
Olivier elemento Olivier palmieri
Olivier palmieri Olivier duchemin
Olivier duchemin Olivier lavalle
Olivier lavalle Olivier prompt
Olivier prompt Morizot baptiste
Morizot baptiste Olivier serrat
Olivier serrat Olivier martin cern
Olivier martin cern Julio olivier espiritismo
Julio olivier espiritismo Olivier trecco
Olivier trecco Olivier lenglet
Olivier lenglet Dr casez
Dr casez Besoekersboek
Besoekersboek Olivier senegas
Olivier senegas Olivier sacroug
Olivier sacroug Olivier ringoet
Olivier ringoet Wilson lowi matrix
Wilson lowi matrix Fabrizio gagliardi
Fabrizio gagliardi Olivier caleff
Olivier caleff Olivier revol tdah
Olivier revol tdah Olivier dusserre
Olivier dusserre Dassault
Dassault Olivier linaires
Olivier linaires