Dengeye Etki eden Faktrler Le Chatelier lkesi Dengeye

















- Slides: 18

Dengeye Etki eden Faktörler: Le Chatelier İlkesi Dengeye ulaşmış bir kimyasal reaksiyon, denge koşulları değiştirilmediği sürece dengede kalır. Bir başka ifade ile kurulmuş bir dengenin, sıcaklık, derişim ve basıncı değiştirilmedikçe denge konumu korunur. ancak dışarıdan bir etki yapıldığında denge bu etkiyi azaltacak yönde kendiliğinden kayar. Le Chatelier bu durumu "dengedeki bir sisteme etki edildiğinde, sistem bu etkiyi azaltacak yönde kayar" şeklinde ifade edilebilir. Bu ilke kimyasal denge için de geçerlidir.

1. Dengeye Derişim Etkisi Denge halindeki bir sistemdeki maddelerden her hangi birinin derişimi artırıldığında, sistem bu etkiyi azaltmak için sağa ve sola kayar. Mesela dengedeki bir reaksiyonda ürün olarak bulunan maddeden ortama bir miktar ilave ettiğimiz zaman (dengedeki derişimin değişmesi koşuluyla), "reaksiyon bu ilave edilen maddenin miktarını azaltacak yönde" ilerleyecek, yani reaksiyon geriye doğru yürüyecektir. Örnek H 2 (g) + I 2 (g) ↔ 2 HIg) Kapalı ve sabit hacimli bir kapta gerçekleşen tepkimede, ortama H 2 eklenirse; -Tepkime ürünler yönüne kayar. -HI’nın derişimi artar. -H 2 miktarı artar I 2 miktarı azalır. -K’ denge sabiti değişmez

2. Dengeye Basınç Hacim Etkisi Basınç artırıldığında başka bir ifadeyle, hacim küçültüldüğünde, denge gaz maddelerin mol sayılarını azaltacak yönde hareket eder. Her iki taraftaki gaz maddelerin mol sayıları eşitse dengede bir değişme olmaz. ÖRNEK: SO 3 + NO ↔ SO 2 + NO 2 Tepkimeyle ilgili olarak ; I. Hacim artırılırsa NO’nun derişimi azalır. II. Hacim küçültülürse NO’un derişimi artar. III. Hacim küçültülürse denge sabiti artar. İfadelerinden hangileri doğrudur ? ÇÖZÜM: Giren ve çıkan maddelerin mol sayıları eşit olduğundan hacmin küçülmesi; dengeye etki etmez, giren ve çıkan maddelerin mol sayılarını değiştirmez, ancak maddelerin derişimi değişir. I ve II doğrudur.

2. Dengeye Basınç Hacim Etkisi Denge halindeki bir sistemin sıcaklığı artırıldığında sistem bu etkiyi azaltacak yönde hareket eder. Ekzotermik tepkimelerde sıcaklık artırılırsa denge girenler tarafına kayar, K denge sabiti küçülür. Endotermik tepkimelerde sıcaklık artırılırsa denge ürünler tarafına kayar, K denge sabiti büyür. ÖRNEK N 2 + 3 H 2 2 NH 3 ΔH=- Kapalı bir kapta gaz fazında gerçekleşen denge tepkimesiyle ilgili olara I. Kabın hacmini artırmak II. Ortama H 2 eklemek III. Sıcaklığı artırmak İşlemlerinden hangileri K’ denge sabitinin değerini değiştirir ? ÇÖZÜM: Kabın hacminin ve maddelerin derişimlerinin denge sabitine etkileri yoktur. Ancak sıcaklığın artırılması, dengeyi girenler tarafına kaydıracağından K denge sabitinin değerini azaltır.

3. Dengeye Sıcaklığın Etkisi Denge halindeki bir sistemin sıcaklığı artırıldığında sistem bu etkiyi azaltacak yönde hareket eder. Ekzotermik tepkimelerde sıcaklık artırılırsa denge girenler tarafına kayar, K denge sabiti küçülür. Endotermik tepkimelerde sıcaklık artırılırsa denge ürünler tarafına kayar, K denge sabiti büyür. k e Örn N 2 + 3 H 2 ↔ 2 NH 3 ΔH=Kapalı bir kapta gaz fazında gerçekleşen denge tepkimesiyle ilgili olara I. Kabın hacmini artırmak II. Ortama H 2 eklemek III. Sıcaklığı artırmak İşlemlerinden hangileri K’ denge sabitinin değerini değiştirir ? üm Çöz ÇÖZÜM: Kabın hacminin ve maddelerin derişimlerinin denge sabitine etkileri yoktur. Ancak sıcaklığın artırılması, dengeyi girenler tarafına kaydıracağından K denge sabitinin değerini azaltır.

Denge bağıntısıyla sıcaklı arasındaki matematiksel bağıntı aşağıdaki gibidir. R : Genel gaz sabiti (değeri 8, 314 J/K mol) K 2 : T 2 sıcaklığındaki denge sabiti K 1 : T 1 sıcaklığındaki denge sabiti, ΔH : Reaksiyon entalpisi NOT: Reaksiyon entalpisi (ΔH) sıcaklığa bağlılık göstermesine rağmen, yaklaşık çözümler için sabit kabul edilebilir. Ayrıca bu formül büyük ihtimalle müfredat dışı tutulacaktır.

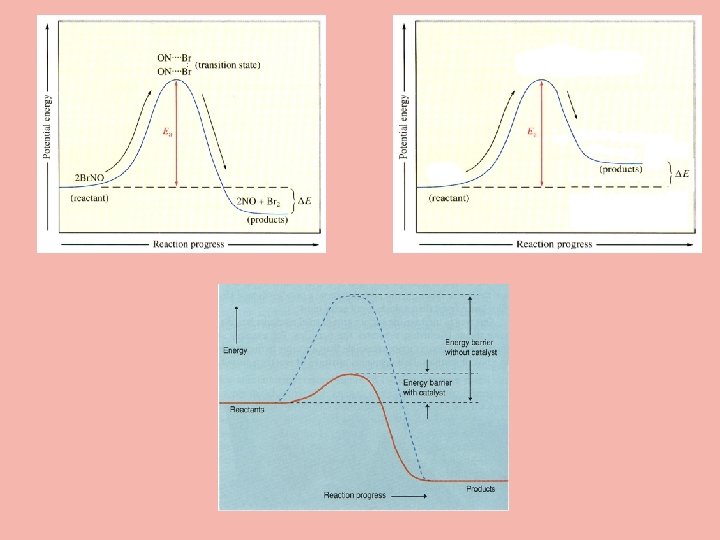
4. Dengeye Katalizör Etkisi Katalizörler dengeye etki etmezler ancak dengeye ulaşma süresine etki ederler. Katalizörler hız sabitine etki eder ancak ileri ve geri hız sabitlerine aynı ölçüde etki ederler. Katalizörler tepkime mekanizmasını da değiştirir. Ancak denge bağıntısı net tepkimeye göre yazıldığından bu durumun dengeye etkisi yoktur. Örnek: N 2 + 3 H 2 ↔ 2 NH 3 ΔH=-92, 22 k. J tepkimesinde Amonyak verimini artırmak için; 1. Sıcaklığı artırmak 2. Basıncı artırmak 3. Katalizör kullanmak işlemlerinden hangileri kullanılmalıdır? Çözüm: 1. 2. 3. Sıcaklığı artırmak: Sıcaklığın artırılması ileri ve geri tepkime hızını artırır. Ancak bu tepkimede geri tepkime hızını daha fazla artırdığından NH 3 miktarı sıcaklık arttıkça azalır. Basıncın artırılması dengeyi ürünler lehine kaydırdığından oluşan NH 3 miktarı artacaktır. Katalizör kullanılması ileri ve geri tepkimeleri aynı derecede hızlandırdığından birim zamanda oluşan NH 3 miktarı artar ancak ortamdan uzaklaştırılmazsa tekrar bozunur.

K Denge Sabitinin Birimi ve K denge Sabitine Etki Eden Faktörler: Denge sabitinin birimi, girenlerin ve ürünlerin miktarını gösteren birimler ve bu maddelerin katsayılarına bağlıdır. ÖRNEK: N 2 O 4(g) ↔ 2 NO 2(g) [NO 2] 2 [Mol/L] 2 K d= = = [Mol/L] [N 2 O 4] [Mol/L] ÖRNEK: NO 2(g) + CO(g) ↔ CO 2(g) + NO(g) K d= ÖRNEK: 2 SO 2(g) + O 2 (g) ↔ 2 SO 3(g) K P= [NCO 2] [NO 2] [CO] [Mol/L] [p. SO 3 I] 2 [PSO 2 ]2 [P O 2] [Mol/L] = = [birimsiz] [atm] 2 [atm] = 1 atm

ÖRNEK: Sitrik asit, (C 3 H 4 OH)(COOH)3 , 3 tane asidik proton içerir ve bunları 3 basamakta kaybederek (C 3 H 4 OH)(COO-) 3 haline dönüşebilir. Üç basamak için denge sabitleri = 7, 10 x 10 -4 , K 2 = ve K 3 = olduğuna göre toplam reaksiyonun denge sabiti aşağıdakilerden nedir? ÇÖZÜM: K= K 1 x K 2 K= 7, 10 x 10 -4 x 1, 68 x 10 -5 x 4, 11 x 10 -7 K=49 10 -16 =4, 9 10 -15

K Denge Sabitinin Birimi ve K denge Sabitine Etki Eden Faktörler: 1. Bir denge reaksiyonu ters çevrilirse, K denge sabiti 1/K olur. N 2 + 3 H 2 ↔ 2 NH 3 K=25 2 NH 3 ↔ N 2 + 3 H 2 K’=1/25 2. Bir denge reaksiyonu n gibi bir rakamla genişletilirse, K denge sabiti Kn olur. H 2 + I 2 ↔ 2 HI K=4 2 H 2 + 2 I 2 ↔ 4 HI K’=16 3. Kademeli tepkimelerde toplam tepkimenin K denge sabiti ayrı-ayrı tepkimelerin denge Sabitleri çarpımına eşittir. SO 2 + ½O 2 ↔ CO 2 ↔ SO 3 CO +½ O 2 K 1=4 K 2=1/8 SO 2 + CO 2 ↔ SO 3 +CO K=1/2

% Verim Hesaplamaları Kimyasal tepkimelerde elde edilecek ürün miktarı, reaksiyon başlangıcında bulunan sınırlayıcı reaktifin (reaksiyonda ilk tüketilen reaktan oluşacak ürünün maksimum miktarını belirleyeceğinden "sınırlayıcı reaktif" diyebilinir ) miktarına bağlıdır. Kimyasal reaksiyon hesaplamalarında başlıca üç tip verim kullanılır: 1. Teorik verim; sınırlayıcı reaktifin hepsinin reaksiyona girdiği düşünülerek, denkleştirilmiş denklem ile hesaplanan ürün miktarıdır. Teorik verim, elde edilebilecek maksimum verimdir. 2. Gerçek verim; uygulamada elde edilebilen ürün miktarıdır ve hemen her zaman teorik verimden daha düşüktür. (Bu duruma sebep olan etkenler. a) Birçok reaksiyon tersinirdir ve yüzde yüz soldan sağa doğru ilerlemezler. b) Reaksiyonun yüzde yüz tamamlandığı durumda bile, gerçek verim düşük olabilir. Çünkü reaksiyon ortamından, ürünün tamamını saf halde etmek güç olabilir. c) Bazı reaksiyonlar ise karmaşık olabilir veya yan ürünler oluşabilir, oluşan ürünler kendi aralarında veya reaktantlarla başka ürünler oluşturmak üzere reaksiyona girebilirler. Bu tür reaksiyonlar verimi düşürürler. 3. Yüzde verim; gerçek verimin, teorik verime oranı şeklinde ifade edilir.

Örnek: N 2 + 3 H 2 ↔ 2 NH 3 ΔH=-92, 22 k. J tepkimesinde Amonyak verimini artırmak için; 1. Sıcaklığı artırmak, 2. Basıncı artırmak, 3. Katalizör kullanmak, 4. Oluşan madde miktarını ortamdan uzaklaştırmak, işlemlerinden hangileri kullanılmalıdır? Çözüm: 1. Sıcaklığı artırmak: Sıcaklığın artırılması ileri ve geri tepkime hızını artırır. Ancak bu tepkimede geri tepkime hızını daha fazla artırdığından NH 3 miktarı sıcaklık arttıkça azalır. 2. Basıncın artırılması dengeyi ürünler lehine kaydırdığından oluşan NH 3 miktarı artacaktır. 3. Katalizör kullanılması ileri ve geri tepkimeleri aynı derecede artırır. 4. 1. ve 3. işlemlerde tepkime hızı artacağından birim zamanda oluşan NH 3 miktarı artar, ancak oluşan NH 3 devamlı olarak ortamdan uzaklaştırılmazsı gerekmektedir.

Örnek: 6 gram C yeteri miktar O 2 ile yandığında N. Ş. A da 8, 96 litre CO 2 elde ediliyor. Tepkime verimi % de kaçtır ? (C=12) Çözüm: n=8, 96/22, 4= 0, 4 mol CO 2 dir. C + O 2 →CO 2 0, 4 mol 0, 4 x 12=4, 8 gram C yanmıştır. 6 gram C un 4, 8 gramı yanmışsa 100 gramda x x= 80 verim %80 Not: Bu örnekte tepkime tek yönlüdür. Ancak karbon safsızlık içermektedir.

Örnek: Ca. CO 3(k) ↔ Ca. O(k)+ CO 2 (g) Yukarıdaki reaksiyona göre, 150 ton Ca. CO 3 ün ısıtılmasıyla 56 ton Ca. O elde ediliyor. Tepkimenin verimi % kaçtır? Çözüm: Ca. CO 3(k) → Ca. O(k)+ CO 2 (g) -100 g +56 g -100 ton +56 ton Not: Bu örnekte tepkime çift yönlüdür. Verimin düşmesi bu sebeple olabilir. Ca. CO 3=150 -100= 50 ton saf olmayan kısmı 150 Ton Ca. CO 3 ün 100 tonu tepkimeye giriyorsa 100‘ de X tonu girer. X=%66, 6

Örnek: C 4 H 9 OH + Na. Br +H 2 SO 4 → C 4 H 9 Br + Na. HSO 4 + H 2 O (s) Yukarıdaki reaksiyona göre, 13 g C 4 H 9 OH, 21, 6 g Na. Br ve 33, 8 g H 2 SO 4 ten 16, 8 g C 4 H 9 Br elde ediliyor. Buna göre; teorik, gerçek ve yüzde verim nedir? C 4 H 9 OH : 74, Na. Br: 103 , H 2 SO 4: 98, C 4 H 9 Br: 137 Çözüm: C 4 H 9 OH + Na. Br + H 2 SO 4 → C 4 H 9 Br + Na. HSO 4 + H 2 O 74 g 103 g 13 g 34, 6 g Teorik Verim: 74 g 13 g X =24, 0 137 g Xg 98 g 137 g 32, 6 g 16, 8 g g Gerçek Verim: X =16, 8 g Bu tepkimede sınırlayıcı reaktif C 4 H 9 OH dir. % Verim: 24 g 16, 8 g 100 g X =% 70 Xg

Örnek: N. Ş. A da 8, 96 litre SO 2 gazı elde edebilmek için kaç gram S %80 verimle yakılmalıdır ? (S=32) Çözüm: n=8, 96/22, 4= 0, 4 mol SO 2 S + O 2 → SO 2 0, 4 mol 0, 4 x 32= 12, 8 gram. 100 gram S nin 80 gramı yanıyorsa x gram X= 16 gram 12, 8 gram

Örnek: CO + Cl 2 → COCl 2 yukarıdaki tepkimeye göre 21 gram CO ile 35, 5 gram Cl 2 den 39, 6 gram COCl 2 elde edilmiştir. Tepkime verimi % de kaçtır ? (Cl=35, 5 C=12 O=16) Çözüm: CO + Cl 2 → COCl 2 28 g 71 g 99 g 21 g 35, 5 g 39, 6 Teorik Verim: 71 g 99 g 35, 5 g Xg X =49, 5 g Bu tepkimede sınırlayıcı reaktif Cl 2 dir. O zaman teorik verim Cl 2 üzerinden yapılmalıdır. Gerçek Verim: X =39, 6 g % Verim: 49, 5 g 39, 6 g 100 g X =% 80 Xg

 Denge sabitine etki eden faktörler
Denge sabitine etki eden faktörler Cottrell atmosferi
Cottrell atmosferi Korozyona etki eden faktörler
Korozyona etki eden faktörler Iş doyumuna etki eden örgütsel faktörler
Iş doyumuna etki eden örgütsel faktörler Afetin büyüklüğüne etki eden faktörler
Afetin büyüklüğüne etki eden faktörler Talep türleri
Talep türleri çözünürlüğe etki eden faktörler
çözünürlüğe etki eden faktörler Trans ayka
Trans ayka Tepkime hızı
Tepkime hızı Fotosentez hızına etki eden faktörler
Fotosentez hızına etki eden faktörler Manuel kas testi değerlendirmesi
Manuel kas testi değerlendirmesi Ampere kanunu
Ampere kanunu Karayolları haritasında kırmızı renk neyi gösterir
Karayolları haritasında kırmızı renk neyi gösterir Menü planlamasına etki eden faktörler
Menü planlamasına etki eden faktörler Enzimlerin çalışmasına etki eden faktörler
Enzimlerin çalışmasına etki eden faktörler Valitutti zanichelli
Valitutti zanichelli Definition of le chatelier's principle
Definition of le chatelier's principle Lechateliers principle
Lechateliers principle Principio di lechatelier
Principio di lechatelier