Como avaliar o estado hemodinmico em recmnascidos muito































































- Slides: 65

Como avaliar o estado hemodinâmico em recémnascidos muito prematuros na primeira semana de vida? How to assess hemodynamic status in very preterm newborns in the first week of life? Escourrou G, Renesme L, Zana E, Rideau A, Marcoux MO, Lopez E, Gascoin G, Kuhn P, Tourneux P, Guellec I, Flamant C. J Perinatol. 2017 Sep; 37(9): 987 -993. doi: 10. 1038/jp. 2017. 57. Epub 2017 May 4. PMID: 28471441 Faculdade de Medicina da Universidade Católica de Brasília (6ª Série, Neonatologia) Hospital Materno Infantil de Brasília, SES/DF Apresentação: Marcus Lobo, Marcos Khouri, Gustavo Simão Coordenação: Paulo R. Margotto www. paulomargotto. com. br Brasília, 25 de novembro de 2017

INTRODUÇÃO • • O estado hemodinâmico do recém-nascido (RN) resulta de muitos parâmetros fisiológicos nos primeiros dias de vida e está intimamente relacionado com a morbidade. (1, 2) Transição hemodinâmica fisiológica (0 -1 h) resulta(3): – na perda da baixa resistência da circulação placentária (clampeamento do cordão); – aumento da resistência venosa sistêmica; – diminuição da resistência vascular pulmonar. Fase transicional (1 a 48 -72 h) segue com(3) – aumento maior na resistência venosa sistêmica; – -diminuição da resistência vascular sistêmica – fechamento do ducto arterial patente. Fase pós-transicional (dia 3 até alta) resultam em: – aumento adicional na pré e pós-carga. Assim, avaliar o estado hemodinâmico em recém-nascidos prematuros nesse período de transição é desafiador

INTRODUÇÃO • Na última década, a ecocardiografia funcional tem melhorado o tratamento hemodinâmico não-invasivo em recém-nascidos permitindo a rápida avaliação do débito cardíaco. • Também tem melhado a nossa compreensão da fisiopatologia de um eventual choque. • No entanto, esta técnica requer equipamento específico de treinamento e upto-date, e não pode ser realizada 24 h por dia em todos os neonatais nas Unidades de terapia intensivas. • Em contraste, a pressão arterial (PA) avaliada por um monitor oscilométrico constitui um parâmetro hemodinâmico que pode ser monitorado continuamente com pouco custo e sem efeitos colaterais, é amplamente utilizado. • No entanto, nem sempre é correlacionado com o fluxo sanguíneo central, fluxo sanguíneo que chega aos órgãos, assim como ao oxigênio que chega aos órgão (5)

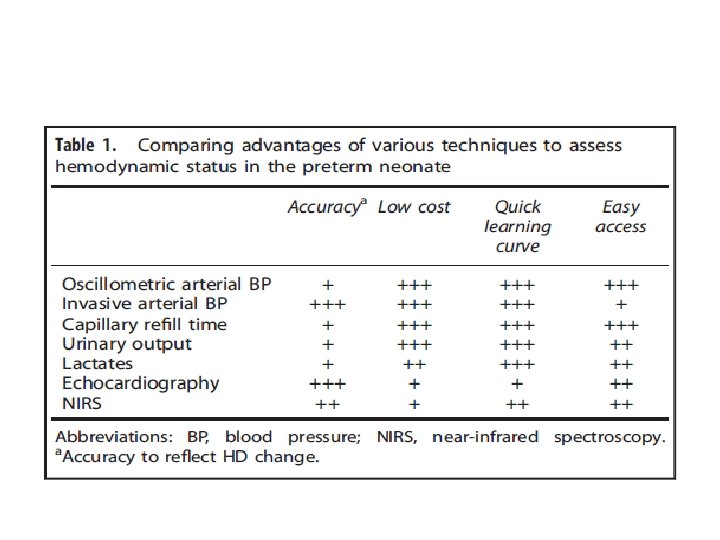
OBJETIVO Descrever ferramentas para avaliação do estado hemodinâmico de prematuros (Tabela 1), incluindo: – Parâmetros clínicos: pressão arterial (PA), tempo de enchimento capilar, diurese; – Parâmetros biológicos: análise de lactato; – Ecocardiografia; – Espectroscopia da luz próximo ao vermelho (NIRS).


PRESSÃO ARTERIAL Medida permanece controversa, embora hipotensão associe-se a morbidade (hemorragia neonatal)(6); • Uma revisão sistemática mostrou que a incidência de hipotensão no RN debaixo peso ao nascer(VLBW) pré-termo difere entre as Unidades de Terapia Intensiva Neonatal e a freqüência de intervenção do médico variam amplamente, de 29 para 98%. (2) Este trabalho reforça a necessidade de esclarecimentos sobre os métodos de medição e a definição de "hipotensão sintomática" que requer tratamento.

PRESSÃO ARTERIAL Como medir a Pressão Arterial? • Cateter arterial por no máximo 4 dias (7) (padrão-ouro); – Precisão; – Desvantagens: • É invasivo; • Pequeno diâmetro do cateter da artéria umbilical, que age como um filtro; • Perda de frequências mais altas e introdução de microbolhas medidas imprecisas (8) • Monitor oscilométrico automático (+ popular): – Não invasivo; – Crítica: localização da medida e tamanho do manguito; – Boa correlação entre medidas invasivas e não invasivas em 32 RN (9, 10); – No entanto, em outro estudo com RN hpotensivos com peso ao nascer <1500 relatou frequentes superestimação em monitoramento não invasivo (11).

PRESSÃO ARTERIAL Qual a definição de PA? -Fanaroff et al determinaram a a pressão arterial média (MAP) normal fisiológica nos RN de extremo baixo peso nas primeiras 72 horas (12) -A regra geral mais aceita: baixa pressão arterial é aquela inferior a idade gestacional (13) -Outra definição de MAP baixa: para RN < 31 semanas de IG, < 30 mm. Hg (6); (estas definições acabam levando a um tratamento desnecessário!) -RN tratados para hipotensão não apresentam diminuição da microcirculação ou na oxigenação tecidual 4, 5. -Baixa MAP é frequentemente associado com débito ventricular esquerdo normal ou alto (5) -A expansão com volume é potencialmente associada com hemorragia cerebral (14) -Valores de PA aumentam espontaneamente nas primeiras 48 h, mesmo que inicialmente seja menor do que a IG; (15) Expansão de volume associa-se a hemorragia cerebral (14). -PA baixa está associada a débito cardíaco normal ou alto (5);

PRESSÃO ARTERIAL Devemos tratar PA baixa? Devemos tolerar ou não a baixa PA se outros parâmetros hemodinâmicos estão na faixa do normal: • Estudos tem mostrado resultado neurológico ruim com aumento da hemorragia intraventricular e leucomalácia quando utilizada a terapia anti-hipotensiva (16, 17). • No entanto a hipotensão, por si só, pode ser responsável pela hemorragia intraventricular (18); Assim, devemos analisar outros fatores clínicos e biológicos em conjunto para instituição do tratamento de suporte hemodinâmico.

TEMPO DE ENCHIMENTO CAPILAR (TEC) • • Amplamente utilizado para avaliar estado hemodinâmico; Pesquisa recente encontrou a medida no tórax para ser usada com mais frequência (95%) em prematuros (19); Valores normais: 5 -7 s em RN (20); Apesar de significante correção com o TEC e o índice cardíaco, há uma fraca correlação com o fluxo sanguíneo sistêmico (21): Pressão arterial e TEC são ruins para determinar fluxo sanguíneo nos RN muito prematuros (22); Valores centrais de TEC≥ 4 s pode determinar fluxo sanguíneo de órgãos significativamente reduzido (taxa de verossimilhança de 7, 25 para RN < 30 de IG (19); Um dos critérios mais apropriados parar a ressuscitação, sendo normal em 70% dos sobreviventes em 6 h (23); Um ensaio controlado randomizado (HIP Trial) para validar um sistema de pontuação clínica para o diagnóstico de choque ou falha na perfusão sistêmica em recém-nascidos prematuros está em curso, a TEC estará entre os parâmetros clínicos e bioquímicos avaliado para determinar a adequação da perfusão (25)

DIURESE • A pressão arterial fisiológica pode ser definida como a pressão arterial que permite uma perfusão normal aos órgãos (26) • Hipoperfusão renal pode levar a diurese diminuída por prejuízo da filtração glomerular; (28) • A diurese pode ser avaliada por pesagem de fraldas; (27) • Oligúria definida por diurese de 0, 5 m. L/kg/h por pelo menos 16 h e associa-se com de mortalidade; (29) • A lesão renal não oligúrica é comum nos prematuros devido a a função tubular imatura; (30) • Um estudo com diurese de 1, 5 ml/kg/h associou a aumento da mortalidade hospitalar 31, excluindo as primeiras 24, considerada fase “pré-diurética” (frequentemente <1 m. L/kg/h)(32) e também depende da perfusão renal (33) Hipotensão associada a diurese < 1, 5 m. L/kg/h após 24 h de vida deve ser preocupante.

LACTATO E AVALIAÇÃO HEMODIN MICA • Em adição aos parâmetros clínicos e biológicos, parâmetros que refletem a perfusão tecidual, como a acidose metabólica, deve ser considerada na avaliação do estado hemodinâmico (34) • Em caso de hipoperfusão e hipóxia há aumento do ácido lático (devido a glicólise anaeróbica); • Em pesquisa internacional, para diagnóstico de hipotensão, a medida do lactato foi o método mais utilizado (70%); (35) • Lactato foi previamente usado como critério de transfusão de glóbulos vermelhos em anemia, sepse e enterocolite necrosante, com forte correlação com o prognóstico; (36, 37, 38) • Aumento de 57% na mortalidade com 2 medidas acima de 5 mmol/l em RN de 23 -40 de IG; (39) • Valor preditivo positivo para mortalidade ou adversidade neurológica de 0, 47 e preditivo negativo de 0, 97 para valor de 5, 7 mmo. L/l dentro de 3 h após nascimento; (40)

LACTATO E AVALIAÇÃO HEMODIN MICA • Estudo 1: Não encontrou diferenças nas concentrações séricas de RN prematuros e hipotensos prematuros; [41](neste estudo a hipotensão foi definida PA invasiva abaixo do percentil 10 para o peso e idade pós-natal[42]) • Estudo 2: Fraca correlação negativa entre o lactato e o fluxo sanguíneo da veia cava superior. Lactato maior quando houve baixo fluxo; (43) • Metabolismo hepático reduzido (44), eleva nível de lactato e assim nem sempre a concentração do lactato se correlaciona com a a hipoperfusão tecidual[44]( o fígado é o maior órgão que metaboliza o ácido láctico aumentado produzido pelos tecidos regionais)

ECOCARDIOGRAFIA • Durante a primeira semana os RN extremamente prematuros podem apresentar baixo fluxo sanguíneo sistêmico sem hipotensão; • Usada para orientar a estratégia terapêutica de acordo com a principal disfunção : 45 -47) – Miocárdica; – Hipertensão pulmonar; – Hipovolemia; – Vasoplegia.

FLUXO SANGUÍNEO CENTRAL • Ejeção ventricular esquerda e direita podem ser usados para determinar o volume de shunt e a função cardiovascular global (podem ser calculados usando métodos semelhante aos dos adultos; [48]) • Aumentam durante os primeiros dias de vida e não podem ser usados para detectar baixo débito em grandes shunts; (48) • Em RN com ducto arterial patente, a melhor medida se dá pela ejeção do ventrículo direito (VD) se pequeno shunt via foramen ovale; (49) • Com shunts, pode-se usar o fluxo da veia cava superior como medida 50; (evita contaminações) • Há correlação entre o fluxo sanguíneo cerebral, NIRS cerebral, tempo de enchimento capilar, lactato em prematuros e critério associado a comprometimento do desenvolvimento neurológico. (43, 51, 52)

DISFUNÇÃO MIOCÁRDICA • O desempenho aumenta nas primeiras 48 h de vida; • Alterações maturatórias na função diastólica ocorrem relativamente independentes do momento do parto (geralmente IG de 30 -32); • Contratilidade cardíaca não muda muito em prematuros devido aumento equilibrado da pré e pós-carga. (53 -56)

FUNÇÃO SISTÓLICA E DIASTÓLICA VENTRÍCULO ESQUERDO (VE) • Não é mais utilizada; • Avaliação do Débito Cardíaco pelo método de Simpson é melhor. (57, 58, 59)

FUNÇÃO SISTÓLICA E DIASTÓLICA DE VD • A avaliação funcional do ventrículo direito (recentemente revista[60 -61]) inclui dimensões lineares e medições da área da cavidade com a mudança de área global fracionada do VD • (FAC global = (FAC − 4 C+FAC − 3 C)/2) • A função sistólica de VD pode ser mensurada pelas velocidades miocárdicas derivadas de imagem de Doppler tecidual do anel tricúspide lateral, excursão do plano tricúspide e imagem de deformação

FUNÇÃO SISTÓLICA E DIASTÓLICA DE VD • Função diastólica do VD em bebês pré-termo é avaliada pelo perfil de fluxo transtricúspide • (E, A e razão E/A ) • E pela imagem de Doppler tecidual • (e ', a' e e '/ a' e E / e ') • A função diastólica do VD muda significativamente durante o período de transição em prematuros (51) com diminuição do relaxamento de ambos os ventrículos

FUNÇÃO SISTÓLICA E DIASTÓLICA DE VD O choque obstrutivo de VD secundário à hipertensão pulmonar é notado através de • dilatação das cavidades direitas • alta pressão sistólica do VD e pressão arterial pulmonar elevada, com base em medidas de jatos tricúspides e pulmonares regurgitados e um shunt de direita para esquerda através de da PCA.

FUNÇÃO SISTÓLICA E DIASTÓLICA DE VD SITUAÇÕES DE ALTO RISCO • Na primeira semana de vida, são conhecidas situações comuns de distúrbios hemodinâmicos em bebês muito prematuros • Primeiro, imediatamente após o nascimento (antes das 1 h), ocorre um situação de hipertensão pulmonar ou má função cardíaca com sobrecarga variável. • Durante a fase de transição (1 a 48 h), pode ocorrer hipotensão (desrregulação da resistência venosa sistêmica com baixa carga) e / ou baixa circulação sanguínea sistêmica (insuficiência cardíaca função com alta carga). • Em terceiro lugar, uma pós-transição fase (dia 3 e posterior) com risco de pós-carga da PCA (alta pré-carga com baixa pós-carga) ou sepse (baixa pós-carga). (62)

FUNÇÃO SISTÓLICA E DIASTÓLICA DE VD ECOCARDIOGRAFIA NEONATAL A hipotensão em recém-nascidos prematuros na Concluindo. . . primeira semana de vida pode ser explorada por ecocardiografia neonatal direcionada, por meio da avaliação do fluxo sanguíneo sistêmico • fluxo aumentado da veia cava superior no caso de grandes shunts de esquerda para direita e seus componentes (função global do miocárdio, hipertensão pulmonar e volume intravascular)

FUNÇÃO SISTÓLICA E DIASTÓLICA DE VD ECOCARDIOGRAFIA NEONATAL • A ecocardiografia neonatal específica é útil na orientação decisões terapêuticas, como a administração de fluidos, e o uso de agentes inotrópicos ou vasoativos. (45) • No entanto, a ecocardiografia não apenas explora a hipotensão. O Baixo Fluxo Sanguíneo Sistêmico ocorre frequentemente sem hipotensão, então a avaliação sistêmica é recomendada para todos os bebês em risco

NIRS • NIRS em hipotensão precoce em recémnascidos prematuros: uma ferramenta promissora para orientar as decisões de tratamento?

NIRS • NIRS tem o potencial de avaliar o bem-estar circulatório de prematuros. • O NIRS consiste de uma técnica que permite a medida não invasiva da oxigenação tecidual regional (r. SO 2) e perfusão, avaliando níveis de hemoglobina oxigenada (Hb. O 2) e hemoglobina desoxigenada (HHb) • Medida em tempo real de um transdutor neonatal fixado no corpo do bebê

NIRS • Esta técnica é utilizada com frequência para avaliar a oxigenação cerebral, renal, oxigenação muscular, esplâncnica ou periférica • A medição concomitante da porcentagem de saturação de oxigênio no sangue arterial (Sa. O 2) e r. SO 2 no cérebro permite a estimativa da extração fracional de oxigênio do tecido (FTOE), um parâmetro que reflete variações na oxigenação cerebral independentemente da oxigenação sistêmica, usando o seguinte fórmula (FTOE = (Sa. O 2 - r. SO 2) / Sa. O 2). • O FTOE se correlaciona positivamente com índice de oxigenação tecidual. (63)

CONFIABILIDADE DO NIRS • Existem preocupações quanto à validade do NIRS, • Entre diferentes sensores e dispositivos NIRS, em prematuros, os valores de NIRS podem diferir tanto quanto 15 (média 10%). (64, 66) Portanto, análise dos resultados que avaliam NIRS em pré-termo devem ser interpretados com cautela e levando em consideração o dispositivo e os sensores utilizados.

CONFIABILIDADE DO NIRS • Uma revisão sistemática recente da literatura concluiu que as medidas NIRS do músculo periférico sozinhas ou em combinação com medições de NIRS cerebral ou multisítio poderiam permitir o reconhecimento de estados iniciais de choque compensado durante o atendimento de neonatos criticamente doentes. (69)

CONFIABILIDADE DO NIRS • NIRS poderia ser uma ferramenta de monitoramento adicional para avaliar status hemodinâmico e a necessidade de mais intervenção ou avaliação. NIRS é benéfico no gerenciamento de recém-nascidos durante a cirurgia cardíaca e é amplamente utilizado para esta indicação. (70)

PATÊNCIA DO CANAL ARTERIAL • O uso do NIRS como ferramenta para rastreio de PCA ainda é controverso. (71, 72) • Tem sido evidenciado saturação renal<66% em RN <29 semanas com canal arterial hemodinamicamente significativo(71), diferente de outros autores que não demonstraram esta associação em RN<32 semanas. (72) • NIRS permite a identificação de lactentes susceptíveis de se beneficiar de ecocardiografia precoce e intervenção subsequente. 73 • Nos infantis pré-termo com PCA significante à ecocardiografia, ajudou na EVALIAÇÃO com os níveis de r. SO 2, que pode estar diminuído na mesentérica, mas não na renal e cerebral. (74) Assim o NIRS pode provê informação complementar à ecocardiografia na avaliação da PCA e guia de tratamento

AUTORREGULAÇÃO CEREBRAL E DESFECHO NEUROLÓGICO • O sistema de autorregulação cerebral mantém o fluxo sanguíneo constante durante as variações de pressão arterial. Na falha desse sistema, leva à circulação por pressão passiva, onde a circulação cerebral está em relação linear direta com a pressão arterial. (75) • O NIRS em associação com a PAM (pressão arterial média), reflete a autorregulação cerebral. (76) • Em pré-termos, a autorregulação cerebral é mais importante que a variação da PAM, para manter o fluxo sanguíneo cerebral, devido a sua perda estar mais relacionada com mais desfechos neurológicos adversos. (77) • Observando apenas a saturação cerebral, um estudo sugere que SO 2<50% está relacionada com pobre desenvolvimento neurológico aos 18 meses, idade corrigida. (78)

ABORDAGEM DE NIRS EM MULTISÍTIO PARA AVALIAÇÃO HEMODIN MICA • Foi mostrado em um modelo de choque hemorrágico em animais que o fluxo sanguíneo renal é afetado antes do cerebral e da PAM. (79) • A SO 2 abdominal mostrou uma variação-individual maior que a renal e a cerebral, mostrando a incerteza sobre qual tecido estava sendo aferido. (80) Por isso, o renal tem sido mais confiável. • O NIRS multisítio tem se mostrado eficaz em avaliar a hipoperfusão sistêmica, no entanto, mais pesquisas são necessárias. (81) • Em recente estudo, o NIRS multisítio (renal, cerebral e intestinal) foi usado em 28 muito pré-termo com quadro de sepse e mostrouse mais eficaz para prevenir desfechos adversos que os sinais clínicos rotineiros de falência circulatória. (82)

MONITORIZAÇÃO DA OXIGENAÇÃO CEREBRAL POR NIRS PARA GUIAR TRATAMENTO EM PRÉTERMOS • A monitorização cerebral por NIRS com um préespecificado algorítimo teve mais sucesso em estabilizar a oxigenação cerebral e manter a SO 2 cerebral dentro de um valor específico (55 -85%). (83) 83 • Para se tornar rotineiro esta prática, precisa-se provar que a médio e longo prazo, será garantido esta taxa de sucesso através de marcadores precoces de injúria cerebral e acompanhamento de imagem cerebral. (84) 84 • A SO 2 de alarme leva a intervenção clínica em apenas 25% dos casos que diferenciam entre os sítios. (85) • Sabe-se que mais três grandes estudos randomizado multicêntrico intervencionista estão em andamento. (86)

FUTURO • Outras ferramentas promissoras são: o Doppler a laser para avaliar o tônus da microvascular periférica 87 ou velocimetria elétrica não invasiva para pacientes cardíacos (88) • O monitoramento contínuo de saída (88)é promissor, mas requer mais estudos para definir valores de alcance normais e permitir o uso rotineiro destas novas técnicas

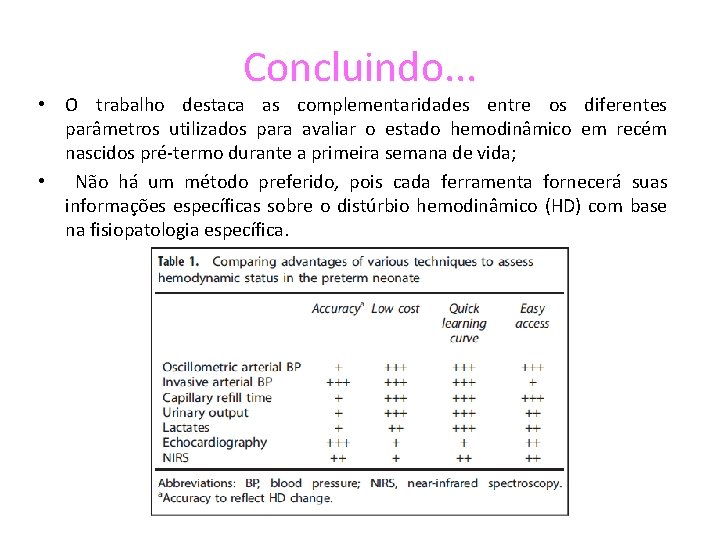
Concluindo. . . Esta revisão destaca as complementaridades entre diferentes parâmetros utilizados para avaliar o estado hemodinâmico dos recém-nascidos pré-termo durante a primeira semana de vida (Tabela 1 a seguir). • A pressão arterial medida com um monitor oscilométrico deve ser analisada levando em consideração outros dados clínicos, em particular, o tempo de enchimento capilar, o débito urinário e dados biológicos, como a análise de lactato. Ecocardiografia cardíaca melhora o manejo hemodinâmico não invasivo nos recémnascidos, mas requer treinamento específico. • O NIRS pode ser útil no monitoramento do curso clínico de lactentes em risco ou apresentando hipotensão, , mas também precisa de treinamento antes que os sinais possam ser interpretados com confiabilidade. • O monitoramento hemodinâmico por si só parece melhorar os resultados em alguns estudos (85, 89), mas ainda não está claro quais limites devem ser usados, pois o tratamento do distúrbio hemodinâmico comprometido não é necessariamente melhorar os resultados a longo prazo. • Provavelmente não há preferência de método, uma vez que cada ferramenta fornecerá suas informações específicas no distúrbio hemodinâmico com base na fisiopatologia específica. • Alvo de tratamento para um fisiopatologia compreensão dos componentes centrais (função miocárdica, pré-carga e pós-carga), componentes vasculares (pressão arterial, perfusão e oxigenação) e componentes orgânicos (oxigenação, produção de urina e lactato) podem melhorar os resultados. •

Concluindo. . . • O trabalho destaca as complementaridades entre os diferentes parâmetros utilizados para avaliar o estado hemodinâmico em recém nascidos pré-termo durante a primeira semana de vida; • Não há um método preferido, pois cada ferramenta fornecerá suas informações específicas sobre o distúrbio hemodinâmico (HD) com base na fisiopatologia específica.

ABSTRACT

REFERÊNCIAS • • • 1 de Boode WP. Clinical monitoring of systemic hemodynamics in critically ill newborns. Early Hum Dev 2010; 86(3): 137– 141. 2 Dempsey EM, Barrington KJ. Treating hypotension in the preterm infant: when and with what: a critical and systematic review. J Perinatol 2007; 27(8): 469– 478. 3 Abman SH. Recent advances in the pathogenesis and treatment of persistent pulmonary hypertension of the newborn. Neonatology 2007; 91(4): 283– 290. 4 Lakkundi A, Wright I, de Waal K. Transitional hemodynamics in preterm infants with a respiratory management strategy directed at avoidance of mechanical ventilation. Early Human Dev 2014; 90(8): 409– 412. 5 Kluckow M, Evans N. Relationship between blood pressure and cardiac output in preterm infants requiring mechanical ventilation. J Pediatr 1996; 129(4): 506– 512. 6 Miall Allen VM, de Vries LS, Dubowitz LM, Whitelaw AG. Blood pressure fluctuation and intraventricular hemorrhage in the preterm infant of less than 31 week’s gestation. Pediatrics 1989; 83(5): 657– 661. 7 Shahid S, Dutta S, Symington A, Shivananda S, Mc. Master University NICU. Standardizing umbilical catheter usage in preterm infants. Pediatrics 2014; 133(6): e 1742–e 1752. 8 Weindling AM. ‘Blood pressure monitoring in the newborn’. Arch Dis Child 1989; 64: 444– 447. 9 Kimble KJ, Darnall RA Jr, Yelderman M, Ariagno RL, Ream AK. An automated oscillometric technique for estimating mean arterial pressure in critically ill newborns. Anesthesiology 1981; 54(5): 423– 425.

REFERÊNCIAS • • • 10 Colan SD, Fujii A, Borow KM, Mac. Pherson D, Sanders SP. Noninvasive determination of systolic, diastolic and end-systolic blood pressure in neonates, infants and young children: comparison with central aortic pressure measurements. Am J Cardiol 1983; 52(7): 867– 870. 11 Diprose GK, Evans DH, Archer LN, Levene MI. Dinamap fails to detect hypotension in very low birthweight infants. Arch Dis Child 1986; 61(8): 771– 773. 12 Fanaroff JM, Fanaroff AA. Blood pressure disorders in the neonate: hypotension and hypertension. Semin Fetal Neonatal Med 2006; 11(3): 174– 181. 13 Development of audit measures and guidelines for good practice in the management of neonatal respiratory distress syndrome. Report of a Joint Working Group of the British Association of Perinatal Medicine and the Research Unit of the Royal College of Physicians. Arch Dis Child 1992; 67 (10 Spec No): 1221– 1227. 14 Goldberg RN, Chung D, Goldman SL, Bancalari E. The association of rapid volume expansion and intraventricular hemorrhage in the preterm infant. J Pediatr 1980; 96(6): 1060– 1063. 15 Batton B, Batton D, Riggs T. Blood pressure during the first 7 days in premature infants born at postmenstrual age 23 to 25 weeks. Am J Perinatol 2007; 24(2): 107– 115. 16 Kuint J, Barak M, Morag I, Maayan-Metzger A. Early treated hypotension and outcome in very low birth weight infants. Neonatology 2009; 95(4): 311– 316. 17 St Peter D, Gandy C, Hoffman SC. Hypotension and adverse outcomes in prematurity: comparing definitions. Neonatology 2016; 111(3): 228– 233. 18 Faust K, Härtel C, Preuß M, Rabe H, Roll C, Emeis M et al. Short-term of very-lowbirthweight infants with arterial hypotension in the first 24 h of life. Arch Dis Child Fetal Neonatal Ed 2015; 100(5): F 388–F 392.

REFERÊNCIAS • • • 19 Stranak Z, Semberova J, Barrington K, O'Donnell C, Marlow N, Naulaers G et al. HIP consortium. International survey on diagnosis and management of hypotension in extremely preterm babies. Eur J Pediatr 2014; 173(6): 793– 798. 20 Gale C. Question 2 Is capillary refill time a useful marker of haemodynamic status in neonates? Arch Dis Child 2010; 95(5): 395– 397. 21 Wodey E, Pladys P, Bétrémieux P, Kerebel C, Ecoffey C. Capillary refilling time and hemodynamics in neonates: a Doppler echocardiographic evaluation. Crit Care Med 1998; 26(8): 1437– 1440. 22 Osborn DA, Evans N, Kluckow M. Clinical detection of low upper body blood flow in very premature infants using blood pressure, capillary refill time, and centralperipheral temperature difference. Arch Dis Child Fetal Neonatal Ed 2004; 89(2): F 168–F 173. 23 Hernandez G, Luengo C, Bruhn A, Kattan E, Friedman G, Ospina-Tascon GA et al. When to stop septic shock resuscitation: clues from a dynamic perfusion monitoring. Ann Intensive Care 2014; 4: 30. 24 Hernandez G, Pedreros C, Veas E, Bruhn A, Romero C, Rovegno M et al. Evolution of peripheral vs metabolic perfusion parameters during septic shock resuscitation. A clinical-physiologic study. J Crit Care 2012; 27(3): 283– 288. 25 Dempsey EM, Barrington KJ, Marlow N, O'Donnell CP, Miletin J, Naulaers G et al. Management of hypotension in preterm infants (The HIP Trial): a randomised controlled trial of hypotension management in extremely low gestational age newborns. Neonatology 2014; 105(4): 275– 281. 26 Seri I. Circulatory support of the sick preterm infant. Semin Neonatol 2001; 6: 85– 95. 27 Cooke RJ, Werkman S, Watson D. Urine output measurement in premature infants. Pediatrics 1989; 83: 116– 118. 28 Bellomo R. Acute renal failure - definition, outcome measures, animal models, fluid therapy and information technology needs the Second International Consensus Conference of the Acute Dialysis Quality Initiative (ADQI) Group. Crit Care 2004; 8: R 204–R 212.

REFERÊNCIAS • • • 29 Akcan-Arikan A, Zappitelli M, Loftis LL, Washburn KK, Jefferson LS, Goldstein SL. Modified RIFLE criteria in critically ill children with acute kidney injury. Kidney Int 2007; 71: 1028– 1035. 30 Jetton JG, Askenazi DJ. Update on acute kidney injury in the neonate. Curr Opin Pediatr 2012; 24: 191– 196. 31 Bezerra CT, Vaz Cunha LC, Liborio AB. Defining reduced urine output in neonatal ICU: importance for mortality and acute kidney injury classification. Nephrol Dial Transplant 2013; 28: 901– 909. 32 Lorenz JM, Kleinman LI, Ahmed G, Markarian K. Phases of fluid and electrolyte homeostasis in the extremely low birth weight infant. Pediatrics 1995; 96: 484– 489. 33 Kluckow M, Evans N. Low systemic blood flow and hyperkalemia in preterm infants. J Pediatr 2001; 139: 227– 232. 34 Dasgupta SJ, Gill AB. Hypotension in the very low birthweight infant: the old, the new, and the uncertain. Arch Dis Child Fetal Neonatal Ed 2003; 88(6): F 450–F 454. 35 Stranak Z, Semberova J, Barrington K, O'Donnell C, Marlow N, Naulaers G et al. International survey on diagnosis and management of hypotension in extremely preterm babies. Eur J Pediatr 2014; 173(6): 793– 798. 36 Izraeli S, Ben-Sira L, Harell D, Naor N, Ballin A, Davidson S. Lactic acid as a predictor for erythrocyte transfusion in healthy preterm infants with anemia of prematurity. J Pediatr 1993; 122(4): 629– 631. 37 Fitzgerald MJ, Goto M, Myers TF, Zeller WP. Early metabolic effects of sepsis in the preterm infant: lactic acidosis and increased glucose requirement. J Pediatr 1992; 121(6): 951– 955. 38 Abubacker M, Yoxall CW, Lamont G. Peri-operative blood lactate concentrations in pre-term babies with necrotising enterocolitis. Eur J Pediatr Surg 2003; 13(1): 35– 39. 39 Deshpande SA, Platt MP. Association between blood lactate and acid-base status and mortality in ventilated babies. Arch Dis Child Fetal Neonatal Ed 1997; 76(1): F 15–F 20.

REFERÊNCIAS • • • 40 Groenendaal F, Lindemans C, Uiterwaal CS, de Vries LS. Early arterial lactate and prediction of outcome in preterm neonates admitted to a neonatal intensive care unit. Biol Neonate 2003; 83(3): 171– 176. 41 Wardle SP, Yoxall CW, Weindling AM. Peripheral oxygenation in hypotensive preterm babies. Pediatr Res 1999; 45(3): 343– 349. 42 Watkins AM, West CR, Cooke RW. Blood pressure and cerebral haemorrhage and ischaemia in very low birthweight infants. Early Hum Dev 1989; 19(2): 103– 110. 43 Miletin J, Pichova K, Dempsey EM. Bedside detection of low systemic flow in the very low birth weight infant on day 1 of life. Eur J Pediatr 2009; 168(7): 809– 813. 44 Burton BK. Inborn errors of metabolism in infancy: a guide to diagnosis. Pediatrics 1998; 102(6): E 69. 45 Sehgal A, Mc. Namara PJ. Does point-of-care functional echocardiography enhance cardiovascular care in the NICU? J Perinatol 2008; 28(11): 729– 735. 46 Moss S, Kitchiner DJ, Yoxall CW, Subhedar NV. Evaluation of echocardiography on the neonatal unit. Arch Dis Child Fetal Neonatal Ed 2003; 88(4): F 287–F 289. 47 de Boode WP, Singh Y, Gupta S, Austin T, Bohlin K, Dempsey E et al. Recommendations for neonatologist performed echocardiography in Europe: consensus statement endorsed by European Society for Paediatric Research (ESPR) and European Society for Neonatology (ESN). Pediatr Res 2016; 80(4): 465– 471. 48 Evans N, Kluckow M. Early determinants of right and left ventricular output in ventilated preterm infants. Arch Dis Child Fetal Neonatal Ed 1996; 74(2): F 88–F 94. 49 Skinner JR, Alverson D, Hunter S. Echocardiography for the Neonatologist, Churchill Livingstone, Michigan, 2000. 50 Kluckow M, Evans N. Superior vena cava flow in newborn infants: a novel marker of systemic blood flow. Arch Dis Child Fetal Neonatal Ed 2000; 82(3): F 182–F 187.

REFERÊNCIAS • • • 51 Dempsey EM, Barrington KJ, Marlow N, O'Donnell CP, Miletin J, Naulaers G et al. HIP Consortium. Management of hypotension in preterm infants (The HIP Trial): a randomised controlled trial of hypotension management in extremely low gestational age newborns. Neonatology 2014; 105(4): 275– 281. 52 Hunt RW, Evans N, Rieger I, Kluckow M. Low superior vena cava flow and neurodevelopment at 3 years in very preterm infants. J Pediatr 2004; 145(5): 588– 592. 53 Murase M, Morisawa T, Ishida A. Serial assessment of right ventricular function using tissue Doppler imaging in preterm infants within 7 days of life. Early Hum Dev 2015; 91(2): 125– 130. 54 Murase M, Morisawa T, Ishida A. Serial assessment of left-ventricular function using tissue Doppler imaging in premature infants within 7 days of life. Pediatr Cardiol 2013; 34(6): 1491– 1498. 55 Hirose A, Khoo NS, Aziz K, Al-Rajaa N, van den Boom J, Savard W et al. Evolution of left ventricular function in the preterm infant. J Am Soc Echocardiogr 2015; 28(3): 302– 308. 56 De Waal K, Phad N, Lakkundi A, Tan P. Post-transitional adaptation of the left heart in uncomplicated, very preterm infants. Cardiol Young 2017; 24: 1– 7. 57 Eriksen BH, Nestaas E, Hole T, Liestøl K, Støylen A, Fugelseth D. Myocardial function in premature infants: a longitudinal observational study. BMJ Open 2013; 3(3): e 002441. 58 Saleemi MS, Bruton K, El-Khuffash A, Kirkham C, Franklin O, Corcoran JD. Myocardial assessment using tissue Doppler imaging in preterm very low-birth weight infants before and after red blood cell transfusion. J Perinatol 2013; 33(9): 681– 686. 59 Eriksen BH, Nestaas E, Hole T, Liestøl K, Støylen A, Fugelseth D. Myocardial function in term and preterm infants. Influence of heart size, gestational age and postnatal maturation. Early Hum Dev 2014; 90(7): 359– 364. 60 Levy PT, Dioneda B, Holland MR, Sekarski TJ, Lee CK, Mathur A et al. Right ventricular function in preterm and term neonates: reference values for right ventricle areas and fractional area of change. J Am Soc Echocardiogr 2015; 28(5): 559– 569.

REFERÊNCIAS • • • 61 Jain A, Mohamed A, El-Khuffash A, Connelly KA, Dallaire F, Jankov RP et al. A comprehensive echocardiographic protocol for assessing neonatal right ventricular dimensions and function in the transitional period: normative data and z scores. J Am Soc Echocardiogr 2014; 27(12): 1293– 1304. 62 Saini SS, Kumar P, Kumar RM. Hemodynamic changes in preterm neonates with septic shock: a prospective observational study. Pediatr Crit Care Med 2014; 15(5): 443– 450. 63 Naulaers G, Meyns B, Miserez M, Leunens V, Van Huffel S, Casaer P et al. Use of tissue oxygenation index and fractional tissue oxygen extraction as non-invasive parameters for cerebral oxygenation. A validation study in piglets. Neonatology 2007; 92(2): 120– 126. 64 Dix LML, Van Bel F, Baerts W, Lemmers PMA. Comparing near-infrared spectroscopy devices and their sensors for monitoring regional cerebral oxygen saturation in the neonate. Pediatr Res 2013; 74(5): 557– 563. 65 Alderliesten T, Dix L, Baerts W, Caicedo A, Van Huffel S, Naulaers G et al. Reference values of regional cerebral oxygen saturation during the first 3 days of life in preterm neonates. Pediatr Res 2016; 79(1 -1): 55– 64. 66 Pocivalnik M, Pichler G, Zotter H, Tax N, Müller W, Urlesberger B. Regional tissue oxygen saturation: comparability and reproducibility of different devices. J Biomed Opt 2011; 16(5): 057004. 67 Pichler G, Wolf M, Roll C, Weindling MA, Greisen G, Wardle SP et al. Recommendations to increase the validity and comparability of peripheral measurements by near infrared spectroscopy in neonates. ‘Round table’, section of haematology, oxygen transport and microcirculation, 48 th annual meeting of ESPR, Prague 2007. Neonatology 2008; 94(4): 320– 322. 68 van Bel F, Lemmers P, Naulaers G. Monitoring neonatal regional cerebral oxygen saturation in clinical practice: value and pitfalls. Neonatology 2008; 94(4): 237– 244.

REFERÊNCIAS • • • 69 Höller N, Urlesberger B, Mileder L, Baik N, Schwaberger B, Pichler G. Peripheral muscle nearinfrared spectroscopy in neonates: ready for clinical use? A systematic qualitative review of the literature. Neonatology 2015; 108(4): 233– 245. 70 Hoffman GM, Ghanayem NS, Tweddell JS. Noninvasive assessment of cardiac output. Semin Thorac Cardiovasc Surg Pediatr Card Surg Annu 2005; 12– 21. 71 Chock VY, Rose LA, Mante JV, Punn R. Near-infrared spectroscopy for detection of a significant patent ductus arteriosus. Pediatr Res 2016; 80(5): 675– 680. 72 Van der Laan ME, Roofthooft MTR, Fries MWA, Berger RMF, Schat TE, Van Zoonen AGJF et al. A hemodynamically significant patent ductus arteriosus does not affect cerebral or renal tissue oxygenation in preterm infants. Neonatology 2016; 110(2): 141– 147. 73 Underwood MA, Milstein JM, Sherman MP. Near-Infrared Spectroscopy as a screening tool for patent ductus arteriosus in extremely low birth weight infants. Neonatology 2007; 91(2): 134– 139. 74 Petrova A, Bhatt M, Mehta R. Regional tissue oxygenation in preterm born infants in association with echocardiographically significant patent ductus arteriosus. J Perinatol 2011; 31(7): 460– 464. 75 Soul JS, Hammer PE, Tsuji M, Saul JP, Bassan H, Limperopoulos C et al. Fluctuating pressurepassivity is common in the cerebral circulation of sick premature infants. Pediatr Res 2007; 61(4): 467– 473. 76 Caicedo A, De Smet D, Vanderhaegen J, Naulaers G, Wolf M, Lemmers P et al. Impaired cerebral autoregulation using near-infrared spectroscopy and its relation to clinical outcomes in premature infants. Adv Exp Med Biol 2011; 701: 233– 239. 77 Tsuji M, Saul JP, du Plessis A, Eichenwald E, Sobh J, Crocker R et al. Cerebral intravascular oxygenation correlates with mean arterial pressure in critically ill premature infants. Pediatrics 2000; 106(4): 625– 632.

REFERÊNCIAS • • 78 Alderliesten T, Lemmers PMA, Van Haastert IC, De Vries LS, Bonestroo HJC, Baerts W et al. Hypotension in preterm neonates: low blood pressure alone does not affect neurodevelopmental outcome. J Pediatr 2014; 164(5): 986– 991. 79 Rhee CJ, Kibler KK, Easley RB, Andropoulos DB, Czosnyka M, Smielewski P et al. Renovascular reactivity measured by near-infrared spectroscopy. J Appl Physiol 2012; 113(2): 307– 314. 80 Mc. Neill S, Gatenby JC, Mc. Elroy S, Engelhardt B. Normal cerebral, renal and abdominal regional oxygen saturations using near-infrared spectroscopy in preterm infants. J Perinatol 2011; 31(1): 51– 57. 81 Cerbo RM, Maragliano R, Pozzi M, Strocchio L, Mostert M, Manzoni P et al. Global perfusion assessment and tissue oxygen saturation in preterm infants: where are we? Early Hum Dev 2013; 89(Suppl 1): S 44–S 46. 82 van der Laan ME, Schat TE, Olthuis AJ, Boezen HM, Bos AF, Kooi EM. The association between multisite near-infrared spectroscopy and routine hemodynamic measurements in relation to shortterm outcome in preterms with clinical sepsis. Neonatology 2015; 108(4): 297– 304. 83 Hyttel-Sorensen S, Pellicer A, Alderliesten T, Austin T, van Bel F, Benders M et al. Cerebral near infrared spectroscopy oximetry in extremely preterm infants: phase II randomised clinical trial. BMJ 2015; 5(350): g 7635. 84 Plomgaard AM, van Oeveren W, Petersen TH, Alderliesten T, Austin T, van Bel F et al. The Safe. Boos. C II randomized trial: treatment guided by near-infrared spectroscopy reduces cerebral hypoxia without changing early biomarkers of brain injury. Pediatr Res 2016; 79(4): 528– 535. 85 Riera J, Hyttel-Sorensen S, Bravo MC, Cabañas F, López-Ortego P, Sanchez L et al. The Safe. Boos. C phase II clinical trial: an analysis of the interventions related with the oximeter readings. Arch Dis Child Fetal Neonatal Ed 2016; 101(4): F 333–F 338.

REFERÊNCIAS • 86 Kenosi M, Naulaers G, Ryan CA, Dempsey EM. Current research suggests that the future looks brighter for cerebral oxygenation monitoring in preterm infants. Acta Paediatr 2015; 104(3): 225– 231. • 87 Corbisier DE, Meautsart C, Dyson RM, Latter JL, Berry MJ, Clifton VL et al. Influence of sympathetic activity in the control of peripheral microvascular tone in preterm infants. Pediatr Res 2016; 80(6): 793– 799. • 88 Freidl T, Baik N, Pichler G, Schwaberger B, Zingerle B, Avian A et al. Haemodynamic transition after birth: a new tool for non-invasive cardiac output monitoring. Neonatology 2017; 111(1): 55– 60. • 89 Rozé JC, Cambonie G, Marchand-Martin L, Gournay V, Durrmeyer X, Durox M et al. Association between early screening for patent ductus arteriosus and in-hospital mortality among extremely preterm infants. JAMA 2015; 313(24): 2441– 2448.

Nota do Editor do site, Dr. Paulo R. Margotto. Estudando juntos! Aqui e Agora • Como definir a hipotensão arterial neonatal? • Expansão de volume excessiva e morte • Suporte cardiovascular no pré-termo extremo

O que devemos fazer sobre a baixa pressão arterial em prematuros. 2017 What Should We Do about Low Blood Pressure in Preterm Infants. Dempsey EM. Neonatology. 2017; 111(4): 402 -407. doi: 10. 1159/000460603. Epub 2017 May 25. PMID: 28538235 Similar articles • O manuseio de recém nascidos prematuros com baixa pressão arterial logo após o nascimento ainda não foi resolvida. A definição do que constitui pressão sanguínea baixa é incerta. Ao nascer, a pressão arterial média parece ser específica para a gestação e aumenta nos primeiros dias de vida. Os esteróides antenatais, o bloqueio retardado do cordão e evitar a ventilação mecânica estão associados a maior pressão arterial média e menor hipotensão após o nascimento. As taxas de hipotensão de 15 -50% foram relatadas em vários estudos de bebês extremamente prematuros. No entanto, apenas cerca de 10% de todos os recém-nascidos extremamente prematuros recebem inotrópicos, sugerindo que os clínicos tenham em conta outros fatores, como achados clínicos, bioquímicos e ecocardiográficos antes de decidir intervir. O papel exato da ecocardiografia funcional na avaliação da necessidade de tratamento da pressão arterial baixa em bebês extremamente prematuros continua a ser determinado. A espectroscopia do infravermelho próximo para avaliar a perfusão cerebral também pode ter um papel a desempenhar. A expansão do volume (geralmente 10 m. L / kg de solução salina) continua a ser a intervenção mais utilizada para a baixa pressão arterial, mas a evidência de benefício está faltando e pode haver problemas de segurança. Embora a dopamina seja o fármaco inotrópico mais utilizado, dobutamina, epinefrina, corticosteróides, milrinona e vasopressina também foram utilizados em recém-nascidos prematuros com baixa pressão arterial. Ensaios clínicos com resultados a longo prazo são necessários para determinar o inotrópico mais adequado e quando usá-lo. A hipotensão precoce difere da hipotensão tardia em relação à causa, ao tratamento e ao desfecho. Uma série de estudos recentes destinados a melhorar a base de evidências para o tratamento da hipotensão precoce em lactentes extremamente prematuros foram encerrados precocemente por causa do baixo recrutamento. Atualmente, a resposta à questão do que fazer sobre pressão arterial baixa em recémnascidos prematuros não está clara.

• Uma das abordagens de tratamento mais desafiadoras na Medicina é a decisão de que a intervenção não está garantida. Este curso de "inatividade percebida" é realmente bastante oposto. A decisão de observar cautelosamente deve ser apenas feita após uma avaliação clínica e bioquímica completa, incorporando outras modalidades quando disponíveis. Quando uma decisão é tomada para intervir, a questão é: que tratamento melhora o resultado neste grupo de bebês? Houve vários ensaios recentes realizados nesta área. Dois terminaram cedo devido a questões de inscrição - nomeadamente o julgamento HIPHOP na Itália e o Ensaio de hipotensão NICHD. O ensaio do NICHD inscreveu 10 indivíduos de uma população elegível de 120 pacientes. Um grande número de fatores contribuíram para esta baixa taxa global de inscrição, incluindo problemas de consentimento e disponibilidade do médico para se inscrever. Obter consentimento informado para um ensaio do uso de inotrópicos enfrenta muitos desafios, particularmente quando o envolvimento pode ocorrer nas primeiras horas de vida, o tempo quando a maioria dos recém-nascidos prematuros tem baixa pressão arterial. Esses desafios precisam ser cuidadosamente considerados em futuros ensaios. De igual importância é a vontade dos médicos de tentar responder estas questões e participar de ensaios clínicos, em vez de continuar a basear suas decisões sobre idéias preconcebidas com poucas evidências de apoio. • • • À medida que o problema persistir, devemos esforçar-nos como uma comunidade para responder a pergunta: o que deveríamos fazer sobre pressão arterial baixa em recém-nascidos prematuros?

Oxigenação cerebral medida por espectroscopia próxima ao infravermelho em cuidados intensivos neonatais: correlação com oxigenação arterial • Hunter CL ET AL. Apresentação: Gabriela Santos, Paulo R. Margotto 2017 Já é do nosso conhecimento que avaliação clínica da hemodinâmica cerebral é importante na Unidade de Terapia Intensiva Neonatal (UTIN), principalmente no que apresentam deficiente autorregulação do fluxo sanguíneo cerebral (FHC) nos pré-termos extremos ( 50% desta capacidade é perdida nestes bebês nos primeiros dias de vida). As alterações no fluxo e oxigenação cerebral são associadas a déficits no desenvolvimento neurológico e que a hipoperfusão cerebral é associada a injúria neuronal, que leva a condições como leucomalácia periventricular. Desde sua introdução em 1977 o uso de NIRS atrai muito interesse como uma ferramenta em potencial para monitorização hemodinâmica no recém-nascido. Em pacientes pediátricos já foi evidenciado que esta tecnologia tem boa correlação com a Pa. O 2, mas nenhum estudo investigou a correlação entre a oxigenação arterial e tecidual cerebral nos recémnascidos (RN) pré-termos (r. Sc. O 2) e o presente estudo fez exatamente isto. Com este objetivo, 22 pré-termo extremos foram estudados, havendo pareamento de 86 leituras de NIRS com a gasometria. Utilizando esta tecnologia, os autores não demonstraram correlação entre Pa. O 2 e r. Sc. O 2 e nem também com a Saturação de Oxigênio e Pa. CO 2. No entanto, foi demonstrada correlação significativa com a hemoglobina, oxihemoglobina e frequência respiratória. Assim, o papel do uso de NIRS na população pré-termo permanece controverso. Os resultados nos RN a termo não podem ser simplesmente extrapolados para os pré-termos, devido ao grau de maturação da mielina nestes pré-termos (prejudica a uniformidade da atenuação da luz no tecido cerebral) e provável deficiente autorregulação do FSC (embora neste estudos os RN tinham em média 6 dias de vida). Torna-se necessário um estudo mais aprofundado para determinar a a aplicabilidade clínica de NIRS no bebê pré-termo

Ferramentas Diagnósticas para Distúrbios Hemodinâmicos no Neonato (23 o Congresso Brasileiro de Perinatologia, Gramado, RS, 14 -17/9/2016) Autor(es): Karina Nascimento Costa (DF) 2016 • Palestra proferida pela Dra. Karina do Nascimento Costa (Un. B) no 23 o Congresso de Perinatologia (Gramado, RS) que mostra a todos nós, com extrema maestria, a complexidade das novas ferramentas na análise dos distúrbios hemodinâmicos do neonato, que incluem: o Índice das Características da Frequencia Cardíaca (as desacelerações transitórias do neonato com sepse refletem a ativação da via anti-inflamatória colinérgica, reduzindo a produção de citocinas inflamatórias pelos leucócitos e aumentando a sobrevida); o ecocárdio funcional; espectroscopia no Infravermelho Próximo NIRS; estudo da microcirculação (Sidestream Dark Field Imaging [PCA com repercussão causa mudanças na microcirculação); Espectroscopia de Luz Visível (avaliação contínua da saturação de oxigênio capilar); fluxometria laser Doppler (pode calcula a resistência a vascular).

Pressão arterial precoce, terapia anti-hipotensora e resultados com 18 -22 meses de idade corrigida nos pré-termos extremos Autor(es): Batton B, Li L, Newman NS, et al. Apresentação: Felipe R. Bezerra, Leonardo Kenzo, Brenner Florêncio Alves , Paulo R. Margotto • 2016 Nos últimos 25 anos vários estudos sugeriram que os prematuros extremos hipotensos no período pós-natal imediato apresentam maior risco de eventos adversos e assim, os neonatologistas passaram a administrar terapia anti-hipotensora. No entanto, até o momento não foi observada nenhuma melhora nos resultados (pelo contrário, aumento a preocupação devido ao maior risco de eventos adversos nos prematuros que recebem terapia anti-hipotensora). O presente estudo de Batton et al mostrou piores resultados (óbito/neurodesenvolvimento) na idade corrigida de 18 -22 meses nos RN entre 23 -26 semanas que receberam qualquer terapia anti-hipotensora após controle de fatores conhecidos que afetam a sobrevivência e o neurodesenvolvimento (OR de 1, 836 com IC a 95% de 1, 092 -3, 086)! Nos links trouxemos semelhantes achados de outros autores. Altas doses de dopamina em pré-termos extremos tem sido associadas à morte e/ou hemorragia intraventricular. 80% dos neonatologistas já aceitam o conceito de hipotensão permissiva, devendo ser tratado o bebê e não somente a hipotensão arterial (avalia a perfusão e a diurese para valorizar o tratamento!). A pressão ideal nestes bebês é desconhecida, havendo sugestão (Rita Silveira, 2016) de considerar hipotensão se PA ≤idade gestacional nas primeiras 48 horas e depois, ≤ 30 mm. Hg associados a achados clínicos de baixo débito cardíaco. O ensaio proposto por Dempsey EM et al multicêntrico internacional randomizado e controlado com grupo placebo, envolvendo 830 recém-nascidos entre 23 semanas e <28 semanas completas nas primeiras 72 horas de vida, trará respostas mais robustas quando devemos tratar a hipotensão e qual a melhor estratégia a ser usada

Quando Tratar a Hipotensão no Recém Nascido de Muito Baixo Peso (22 Congresso Brasileiro de Perinatologia, 19 a 22 de novembro de 2014, Brasília) Autor(es): Karina Nascimento Costa 2014

Tratamento da hipotensão presumida nos recém-nascidos de muito baixo peso: efeitos na oxigenação cerebral regional Autor(es): Garner RS, Burchfield D. Apresentação: Laís Póvoa, Morgana Pelegrini, Saulo Floriano, Paulo R. Margotto 2013 – O tratamento baseado só na pressão arterial <30 mm. Hg pode não melhorar a oxigenação cerebral, apesar do aumento da pressão arterial, provavelmente porque estes pacientes estejam na zona de autorregulação do fluxo sanguíneo cerebral. – Corrigir PA sem analisar o comprometimento da oxigenação tecidual pode gerar complicações 28, 29. – No futuro deverá haver melhora na monitoração não invasiva para auxiliar as decisões clínicas no tratamento da hipotensão

Hipotensão, terapia anti-hipotensiva e neurodesenvolvimento em recém-nascidos pré-termos extremos Autor(es): Batton B et al. Apresentação: Jussara Soares Pereira, Káritas Rios Lima, Regina Honorato, Paulo R. Margotto 2009 • Ao contrário da hipótese inicial, RN com baixa pressão arterial (PA) nas primeiras 72 h, independente de tratamento, têm mais dano no neurodesenvolvimento que RN com PA normal • Os resultados não sugerem que a terapia anti-hipotensiva melhore o desfecho. Há uma tendência de pior desfecho em RN com baixa PA tratados, quando comparados com RN com baixa PA não tratados, apesar desses 2 grupos diferirem em vários aspectos perinatais • Dempsey et al consideraram que normotensos (PA nunca menor que a idade gestacional) e RN com hipotensão permissiva (PA menor que a idade gestacional, mas com boa perfusão e não foram tratados) tiveram neurodesenvolvimento similares • Especulações: Os RN com baixa PA tratada podem ter evoluído mal porque eles estavam inicialmente mais doentes

• Alternativamente, a pior evolução pode ter ocorrido porque a terapia anti-hipotensiva foi inefetiva ou danosa • Uma recente revisão (Dempsey e Barrington) destaca que a terapia anti-hipotensiva pode ser tóxica (a dopamina suprime o funcionamento da pituitária e a excesso de expansão volumétrica e hidrocortisona foram associadas com um aumento da mortalidade) • O deficiente desenvolvimento pode estar relacionado com a deficiente perfusão cerebral; o baixo fluxo na veia cava superior pode ser um indicador de má perfusão cerebral; no entanto, o a correção deste baixo fluxo com dopamina e dobutamina não melhorou o neurodesenvolvimento (Osborn D et al) • Fanaroff et al relataram mais surdez nos RN prematuros extremos tratados para a hipotensão nas primeiras 72 horas, em comparação com os não tratados

Expansão de volume excessiva e morte neonatal nos recémnascidos prematuros de 27 -28 semanas de gestação Autor(es): Ewer AK et al. Apresentação: Freed Anunciação, Estevão Borges, Rodrigo de Deus, Paulo R. margotto 2008 • Os dados apresentados demonstram a expansão de volume excessiva como causa de morte de recém-nascidos em 27 -28 semanas de gestação que foram consideradas "não inevitáveis". • Embora os números são relativamente pequenos, os dados sugerem que esta quantidade de volume era inadequado. • A menos que haja provas claras de hipovolemia, médicos devem ter precaução ao prescrever expansão de volume. • Existe uma necessidade urgente de se realizar orientações sobre o manejo de expansão de volume em prematuros durante os primeiros dias de vida.

Hipotensão permissiva Autor(es): Keith Barrington (Canadá). Realizado por Paulo R. Margotto • • 2008 É uma prática muito comum na UTI Neonatal. Tratar bebês muitos prematuros com uma pressão arterial média (PAM) abaixo da idade gestacional em semanas, independente dos sinais clínicos. Assim, muitos bebês com 26 semanas com PAM abaixo de 26 mm. Hg acaba recebendo vários bolus de flúido e dopamina e como a PAM continua baixa, acaba recebendo dobutamina e corticosteróides. Então, que número vamos usar para manter a PA? Menos que a idade gestacional? No Canadá é a forma mais comum de se diagnosticar a hipotensão arterial: pressão arterial média menor que a idade gestacional (87, 5% dos neonatologistas usam este critério). Da onde que esta informação vem? Vou-lhes dizer que esta informação vem de lugar nenhum. Não há dados que dão suporte a este critério. Vou ser muito direto. Há uma Associação Britânica de Perinatologia que fez um encontro há 15 anos atrás e apresentaram critérios auditados para todas as UTI, decidindo a partir do nada que uma pressão abaixo da idade gestacional deveria ser tratada. Não havia dados para embasamento. Não sabiam como fazer para o tratamento destes bebês e então inventaram este critério (Joint Working Party of British Association of Perinatal Medicine and the Research Unit of the Royal College of Physicians. Development of audit measures and guidelines for good practice in the management of neonatal respiratory distress syndrome. Arch Dis Child 1992; 67: 1221– 1227). O grande problema de se utilizar este critério para o tratamento da hipotensão: a PA não é a mesma no dia 1 -2 e 3 (sabemos que a PA aumenta espontaneamente nos RN prematuros depois dos primeiros 3 dias de vida; assim, no dia 7, uma PA menor que a idade gestacional seria uma coisa completamente diferente em relação com 6 horas de vida). Os clínicos do Canadá informaram que combinam sinais clínicos (perfusão) com a PA menor que a idade gestacional para valoriza a hipotensão arterial.

Hipotensão Permissiva: Ponto de vista Autor(es): Paulo R. Margotto • • • 2008 O artigo Hipotensão Permissiva que se encontra na página (www. paulomargotto. com. br) foi uma reprodução da Conferência do Dr. Barrington (Canadá), ocorrida no Rio de Janeiro por ocasião do 6º Simpósio Internacional de Neonatologia 1. Este autor também publicou em 2008 um artigo sobre o tema e com a minha colega, Dra. Márcia Pimentel, traduzimos e também colocamos na página. Sobre estes dois artigos, digo que não fiquei confuso, pois eles mostraram que existe um certo abuso nas UTI Neonatais do uso de inotrópicos (há UTIS em que 98% dos RN são hipotensos!). Agora mesmo, aqui na UTI Neonatal do Hospital Planalto (Unimed-Brasília), tenho a informação que um meu prematuro (29 semanas) estável está com pressão arterial média de 26 mm. Hg. Vou introduzir inotrópico? Lógico que não. A pressão arterial não é um bom parâmetro para se avaliar a hemodinâmica do bebê e na verdade, é o único que a maioria das UTIs Neonatais do país dispõe. Em outro estudo conduzido por Barrington no Canadá em que ele aplicou um questionário, a grande maioria dos neonatologistas canadenses considera a hipotensão arterial quando a pressão arterial encontra-se abaixo da idade gestacional (que segundo ele é um critério sem muito sentido) e mais importante ainda, os neonatologistas canadenses agregam outras informações, como a perfusão e a diurese para valorizar o tratamento. Ou seja, não se deve tratar somente a hipotensão arterial e sim o bebê. Outro grande problema nas UTI Neonatais, é o excesso de expansão volêmica. É lógico que a expansão volêmica tem a sua importância nos momentos certos. Estudo de Ewer AK et al evidenciou a maior mortalidade nos RN expandidos. Lembrar que os RN prematuros demoram 6 -8 horas para urinar 1. Portanto, na minha visão, quando um tema é polêmico, com várias controversas, é fundamental que conheçamos as controversas para que possamos agir o mais certo possível frente a uma situação difícil e não "sair atirando para tudo quanto é lado". Devemos sempre lembrar que o nosso prematurinho na UTI Neonatal encontra-se em um período de intenso desenvolvimento cerebral e devemos fazer de tudo para que este desenvolvimento seja preservado, mesmo dentro das condições adversas das nossas UTIs Neonatais

Apesar da ausência de evidências sólidas no manuseio do RN pré-termo com hipotensão arterial e enquanto aguardamos estudos especificamente desenhados com o objetivo de avaliar melhor, a curto e a longo prazo, o prognóstico clínico, é importante que se tenha na UTI Neonatal um norte (“a ausência da evidência não é a evidência da ausência”)

Na Unidade de Neonatologia do HRAS/SES/DF, elaboramos um Protocolo de Intervenção frente aos RN que apresentam hipotensão arterial de difícil controle, principalmente naqueles casos de choque séptico. Como foi citado no presente artigo, não se basear somente no valor da PA, mas combiná-la com sinais clínicos de má perfusão. Assim é importante que o RN seja continuamente monitorado. O aumento da dose ou a introdução de nova droga deve ser sempre seguido após criteriosa avaliação Apesar de não haver consenso na definição de hipotensão arterial, consideramos hipotensão quando a pressão arterial média está abaixo de 30 mm. Hg (ou abaixo da idade gestacional, pelo menos 3 primeiros dias de vida).

Suporte cardiovascular no recém-nascido pré-termo extremo Autor(es): Martin Kluckow (Austrália). Realizado por Paulo R. Margotto • Estudo randomizado realizado por nós na Austrália, envolvendo 42 RN em 2 Centros 2002 Neonatais (estudo publicado no J Pediatr 2002; 140: 183 -91), comparou dobutamina versus dopamina em RN pré-termo com baixo fluxo sanguíneo sistêmico; 42 RN com baixo fluxo sanguíneo na veia cava superior ( menor que 41 ml/Kg/min) nas primeiras 12 horas foram randomizados para receber 10 ml/Kg de solução salina, seguido por 10 mcg/kg/min de dobutamina ou dopamina. Havendo persistência do baixo fluxo sanguíneo ou recorrência, o inotrópico foi aumentado para 20 mcg/Kg/min. O uso de volume produziu significante aumento do fluxo sanguíneo na veia cava superior (VCS) em 43%. Na mais alta dose de dobutamina, produziu-se maior fluxo na VCS do que a dopamina (p menor que 0, 02). A dopamina resultou no aumento significativamente maior da pressão arterial média. Com 24 hs de uso do inotrópico, os RN com dobutamina apresentaram aumento significativamente maior do débito cardíaco direito (295 versus 167 ml/Kg/min-p<0, 001). Não houve diferenças significativas na mortalidade ou morbidade. • Este estudo demonstra que a melhora da pressão arterial não necessariamente melhora o fluxo sanguíneo. Esta observação é importante. Pelo fato da dopamina ser superior a dobutamina no efeito pressórico, a dopamina tem sido a droga de escolha. É importante que se coloque o aumento da resistência vascular sistêmica é associado com menor fluxo na VCS, sugerindo que o aumento da PAM seja secundário ao aumento da resistência vascular durante o primeiro dia, possa ser contraprodutivo durante o primeiro dia de vida. Pelo fato da dopamina aumentar e a dobutamina diminuir a resistência vascular sistêmica, especulamos que o RN prematuro com baixo fluxo sistêmico, com ductus arteriosus fechado durante o primeiro dia de vida, a dobutamina resultaria em maior melhora no fluxo sanguíneo sistêmico do que a dopamina.

Portanto. . . • São descritas ferramentas para avaliação do estado hemodinâmico de prematuros e entre estas, a mais disponível entre nós, a Pressão arterial média (PAM), tempo de enchimento capilar (TEC: >5 -7 s), diurese (>1, 5 m. L/h após 24 horas de vida), lactato (>5 mmol/l) e ecocardiografia (saber que O Baixo Fluxo Sanguíneo Sistêmico ocorre frequentemente sem hipotensão), havendo também discussão sobre o uso de NIRS (provê informação complementar à ecocardiografia na avaliação da PCA e guia de tratamento). Quanto à interpretação da hipotensão arterial sintomática que requer tratamento: devemos analisar outros fatores clínicos e biológicos em conjunto para instituição do tratamento de suporte hemodinâmico e não nos limitar simplesmente a um número inferior a idade gestacional!A terapia antihipotensiva pode ser tóxica (a dopamina suprime o funcionamento da pituitária e a excesso de expansão volumétrica e hidrocortisona foram associadas com um aumento da mortalidade!). A melhora da pressão arterial não necessariamente melhora o fluxo sanguíneo! Alvo de tratamento para um fisiopatologia compreensão dos componentes centrais (função miocárdica, pré-carga e pós-carga), componentes vasculares (pressão arterial, perfusão e oxigenação) e componentes orgânicos (oxigenação, produção de urina e lactato) podem melhorar os resultados. Paulo R. Margotto

OBRIGADO! Ddos Marcus, Marcos, Dr. Paulo R. Margotto, Mariana, Gustavo Simão, Felipe e Gustavo Sardinha
 Significado de genocida
Significado de genocida Muito se pedirá àquele que muito recebeu
Muito se pedirá àquele que muito recebeu Quando avaliar
Quando avaliar Avaliar para promover: as setas do caminho
Avaliar para promover: as setas do caminho Fuerzas impulsoras
Fuerzas impulsoras No decirte
No decirte O estado como garante da ordem liberal
O estado como garante da ordem liberal Um homem rico estava muito mal
Um homem rico estava muito mal Uma voz ressoa eis meu filho muito amado
Uma voz ressoa eis meu filho muito amado Um surfista que se expunha muito ao sol
Um surfista que se expunha muito ao sol Terreno muito íngreme
Terreno muito íngreme Classes e sub classes de palavras
Classes e sub classes de palavras Ventilador fica oscilando a velocidade
Ventilador fica oscilando a velocidade Eles dizem que sou muito jovem para entender
Eles dizem que sou muito jovem para entender Muito
Muito Nas orações camila tem muito amor à mãe
Nas orações camila tem muito amor à mãe Era uma vez um homem muito rico
Era uma vez um homem muito rico No período penso logo existo oração em destaque é
No período penso logo existo oração em destaque é Havia um menino muito
Havia um menino muito Perdemos muito tempo
Perdemos muito tempo Adverbio
Adverbio Havia um menino muito
Havia um menino muito E assim depois de muito esperar
E assim depois de muito esperar Mensagem para refletir
Mensagem para refletir Oração subordinada
Oração subordinada Orações substantivas
Orações substantivas Sais
Sais Diferença entre adjunto adnominal e predicativo
Diferença entre adjunto adnominal e predicativo Enem 1999 depois de longas investigações
Enem 1999 depois de longas investigações Sei que muito vou me alegrar
Sei que muito vou me alegrar Cómo te llamas tu nombre
Cómo te llamas tu nombre Un verdadero misionero
Un verdadero misionero Si no vives como piensas acabarás pensando como vives
Si no vives como piensas acabarás pensando como vives Vivir como hijos de dios
Vivir como hijos de dios A dios nadie le ha visto
A dios nadie le ha visto Como ser como cristo
Como ser como cristo Estado moderno características
Estado moderno características Estado de conciencia alterado
Estado de conciencia alterado Que es un estado liberal
Que es un estado liberal Reacciones acopladas
Reacciones acopladas Que son los cambios de estado progresivos y regresivos
Que son los cambios de estado progresivos y regresivos Oxisales nomenclatura
Oxisales nomenclatura Estado de la tecnica
Estado de la tecnica Formas de estado de brasil
Formas de estado de brasil Sicep nia
Sicep nia Dirección de control escolar puebla
Dirección de control escolar puebla Hipoprosexia
Hipoprosexia Estado unitário
Estado unitário Que es analisis
Que es analisis Concepto de estado segun weber
Concepto de estado segun weber Resultado integral
Resultado integral Te he estado pensando
Te he estado pensando El rol de estado
El rol de estado Responsabilidade civil do estado artigo 37
Responsabilidade civil do estado artigo 37 Conclusión del estado zulia
Conclusión del estado zulia Conclusión del estado zulia
Conclusión del estado zulia Registro general de adquisiciones del estado rgae
Registro general de adquisiciones del estado rgae Rectoria economica del estado
Rectoria economica del estado Estado de oxidación h
Estado de oxidación h Microsoft word y sus partes
Microsoft word y sus partes Ecuacion de estado de van der waals
Ecuacion de estado de van der waals Vertical
Vertical Cambios de estado progresivo
Cambios de estado progresivo Conclusión de los poderes del estado
Conclusión de los poderes del estado Ley de los tres estados
Ley de los tres estados Por favor hubiera
Por favor hubiera