Qu estudia la Fisicoqumica La aplicacin de los









- Slides: 17

¿Qué estudia la Fisicoquímica? La aplicación de los principios fundamentales de la Física para explicar las propiedades y comportamientos de los sistemas químicos. Dra. Olga S. Herrera

¿Cuál es su objetivo? Comprender los procesos químicos con el fin de poder predecirlos y controlarlos. Dra. Olga S. Herrera

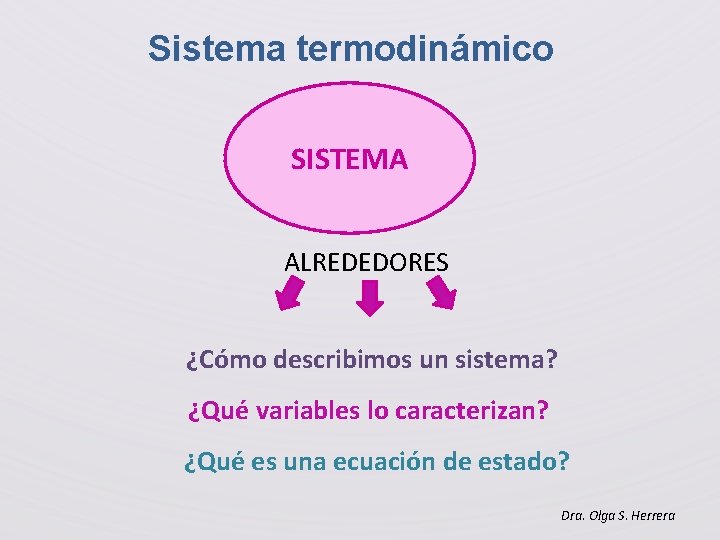
Sistema termodinámico SISTEMA ALREDEDORES ¿Cómo describimos un sistema? ¿Qué variables lo caracterizan? ¿Qué es una ecuación de estado? Dra. Olga S. Herrera

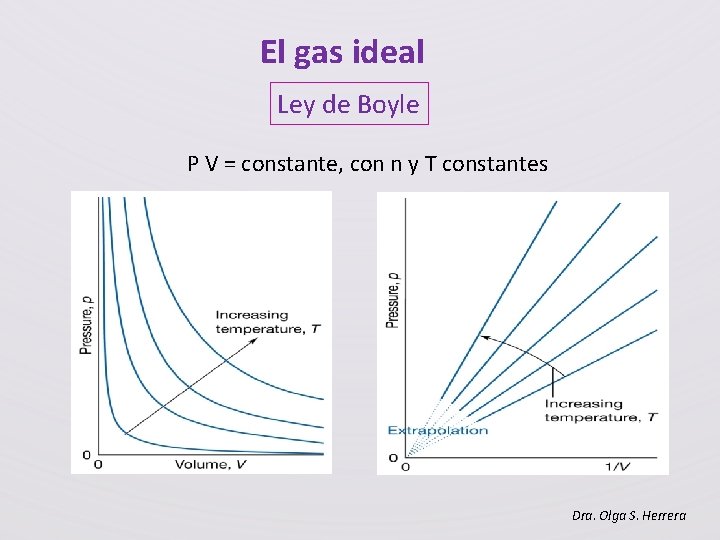
El gas ideal Ley de Boyle P V = constante, con n y T constantes Dra. Olga S. Herrera

Ley de Charles V = constante x T P = constante x T con n y P constantes con n y V constantes Las leyes de Boyle y Charles son ejemplos de leyes límite, en este caso cuando P 0. Dra. Olga S. Herrera

Principio de Avogadro V = constante x n con P y T constante Ecuación del gas ideal PV=n. RT ¿Bajo qué condiciones es válida la ecuación de estado de un gas ideal? Ley de efusión de Graham Dra. Olga S. Herrera

Mezclas de gases Condiciones Ley de Dalton Gases ideales No debe existir reacción Determinación de peso molecular Ley de Amagat ( /P) P Dra. Olga S. Herrera

El modelo cinético de los gases. El gas tiene moléculas de masa m en movimiento al azar. El tamaño de las moléculas es despreciable (sus diámetros son mucho menores que el promedio de la distancia recorrida entre colisiones). Las moléculas interactúan sólo en forma breve e infrecuente, en colisiones elásticas. Dra. Olga S. Herrera

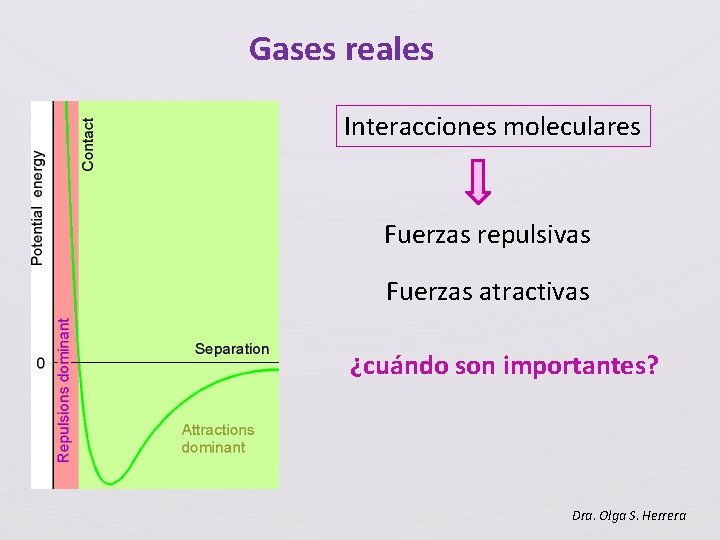
Gases reales Interacciones moleculares Fuerzas repulsivas Fuerzas atractivas ¿cuándo son importantes? Dra. Olga S. Herrera

Ecuación de estado de Van der Waals Ecuación de estado de Redlich-Kwong Dra. Olga S. Herrera

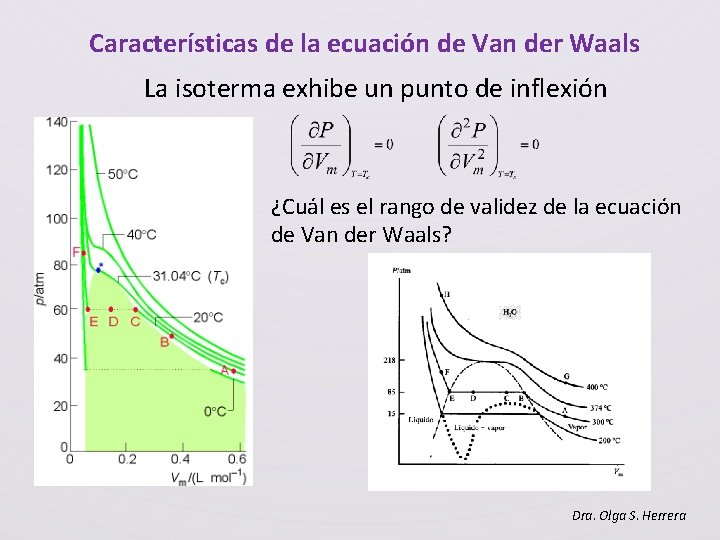
Características de la ecuación de Van der Waals La isoterma exhibe un punto de inflexión ¿Cuál es el rango de validez de la ecuación de Van der Waals? Dra. Olga S. Herrera

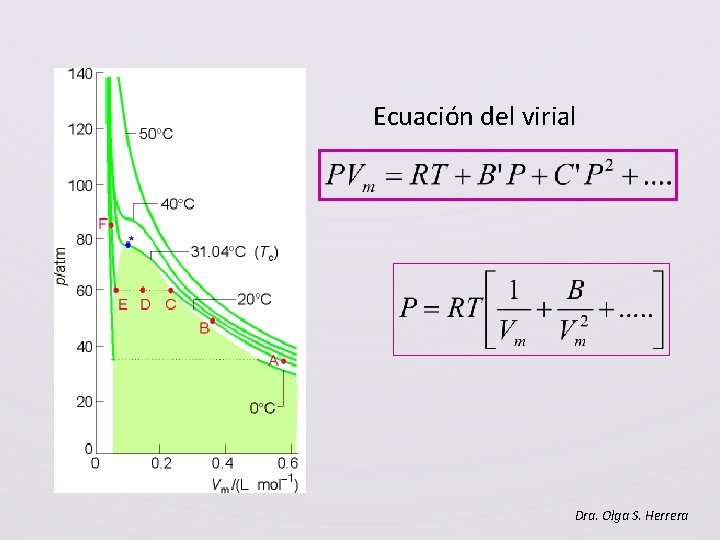
Ecuación del virial Dra. Olga S. Herrera

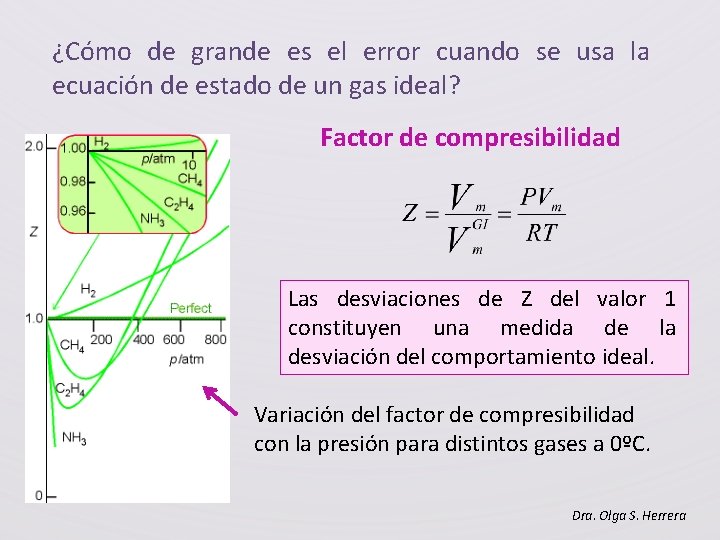
¿Cómo de grande es el error cuando se usa la ecuación de estado de un gas ideal? Factor de compresibilidad Las desviaciones de Z del valor 1 constituyen una medida de la desviación del comportamiento ideal. Variación del factor de compresibilidad con la presión para distintos gases a 0ºC. Dra. Olga S. Herrera

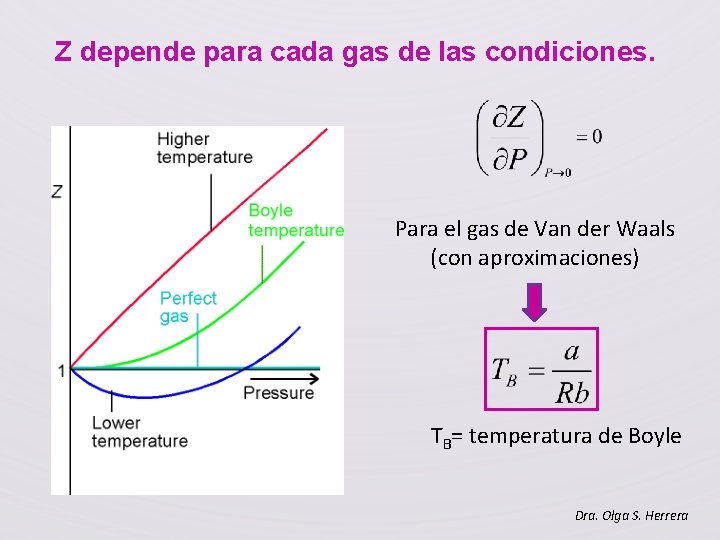
Z depende para cada gas de las condiciones. Para el gas de Van der Waals (con aproximaciones) TB= temperatura de Boyle Dra. Olga S. Herrera

Principio de los estados correspondientes. Diferencias entre gases Volumen molecular Profundidad del potencial atractivo. ¿con qué parámetros críticos podrían estar relacionadas estas características? Ley de los estados correspondientes Si dos gases tienen los mismos valores de PR, VR y TR están en estados correspondientes. ¿cuál es la suposición implícita de esta ley? Dra. Olga S. Herrera

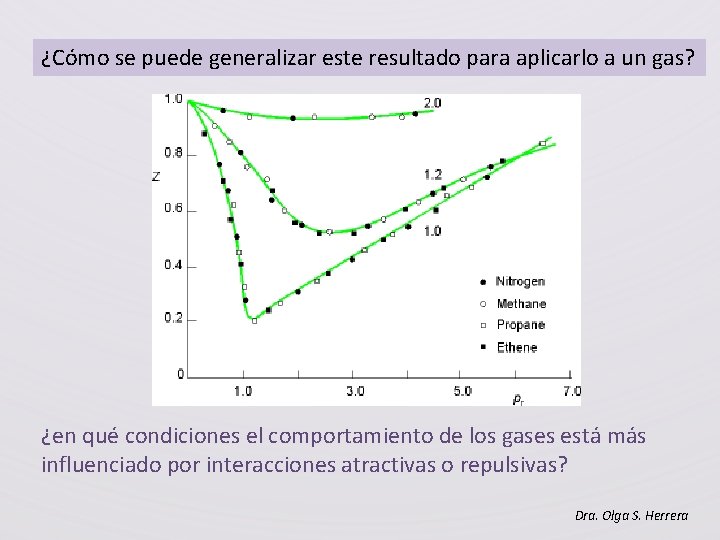
¿Cómo se puede generalizar este resultado para aplicarlo a un gas? ¿en qué condiciones el comportamiento de los gases está más influenciado por interacciones atractivas o repulsivas? Dra. Olga S. Herrera

Bibliografía -QUÍMICA FÍSICA, P. Atkins, J. de Paula. Editorial Médica Panamericana (2008) -PHYSICAL CHEMISTRY, Atkins , De Paula. Oxford University Press. Ninth Edition. (2010) - FISICOQUÍMICA, Keith J. Laidler, John H. Meiser. CECSA. (2005) -QUÍMICA FÍSICA, Thomas Engel, Philip Reid. Pearson Educación S. A. (2006) -FISICOQUİMICA PARA LAS CIENCIAS QUİMICAS Y BIOLÓGICAS. Raymond Chang. Mc. Graw Hill Interamericana. (2008) -FISICOQUIMICA, Gilbert Castellan. Segunda Edición. Addison. Wesley Iberoamericana S. A. (1. 990) Dra. Olga S. Herrera
 Aplicacin
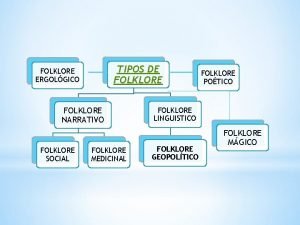
Aplicacin Los tipos de folklore
Los tipos de folklore Tejidos animales
Tejidos animales Es la ciencia que estudia los suelos
Es la ciencia que estudia los suelos Ciencia que estudia los documentos
Ciencia que estudia los documentos Cinco magnitudes escalares
Cinco magnitudes escalares Distribucion complementaria
Distribucion complementaria Que estudia la microeconomía
Que estudia la microeconomía Estudia u
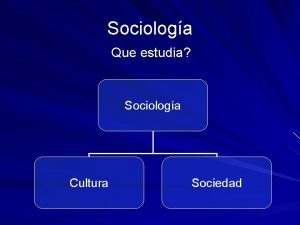
Estudia u Que estudia la sociologia
Que estudia la sociologia C qumica
C qumica Demoecologia
Demoecologia Epinisio
Epinisio Que estudia la química
Que estudia la química Ciencia formal
Ciencia formal Que son ciencias sociales
Que son ciencias sociales La psicología social estudia
La psicología social estudia Induccion y polarizacion
Induccion y polarizacion