CAT DNAANALYSE VIA FLOWCYTOMETRIE APR INGE THOELEN U



























- Slides: 40

CAT DNA-ANALYSE VIA FLOWCYTOMETRIE APR. INGE THOELEN U. Z. LEUVEN, 3 MEI 2005

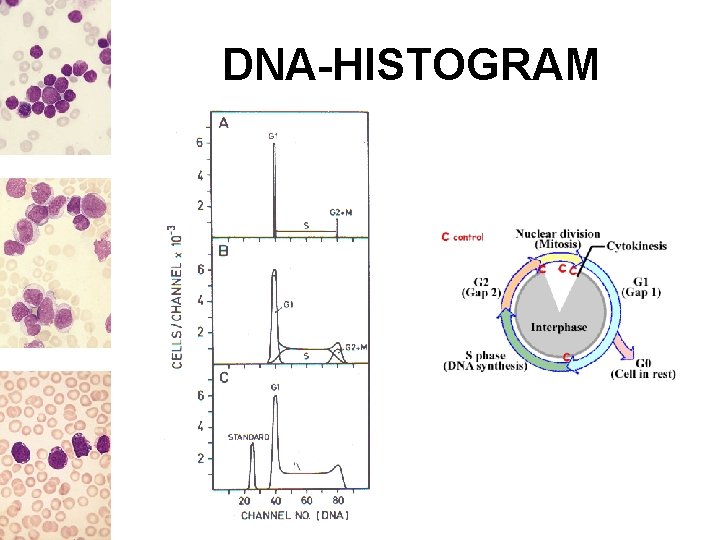
WAT? • Analyse DNA-inhoud • DNA-aneuploïdie: – Diploïd: 46 chromosomen – Hyperdiploïd: > 46 chromosomen – Hypodiploïd: < 46 chromosomen • Maligne cellen: numerische en structurele chromosomale aberranties • DNA-analyse: enkel numerische aberranties! • ≠ fasen celcyclus: G 1, S, G 2 → %S-fase fractie (tumor-proliferatie)

HOE? • Staal: beenmerg, bloed, weefselbiopten • Isoleren en kleuren celkernen m. b. v. Cycle. TEST PLUS DNA reagens kit (BD): – – Lyseren RBC (RCLB, zelfbereid) Oplossing A: detergent, trypsine Oplossing B: trypsine inhibitor, RNase Oplossing C: propidium jodide (intercalator) • Vervolgens flowcytometrische analyse (FACSCalibur, BD) • Auto-analyse resulterende DNA-histogram met Mod. Fit LT® software

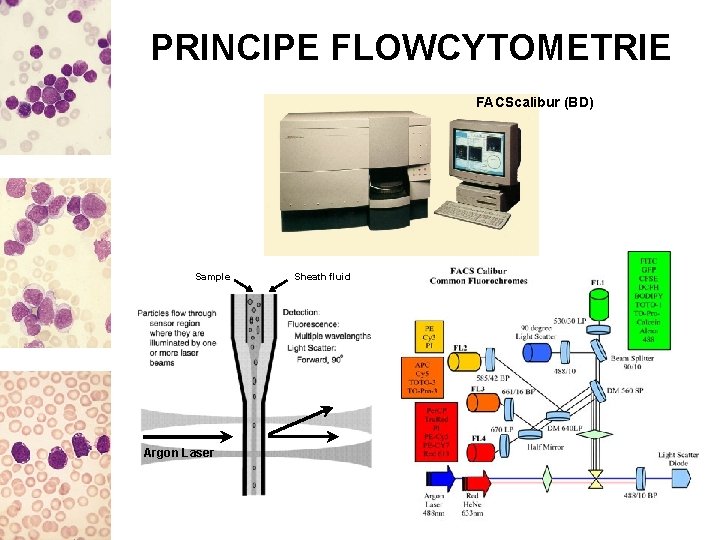
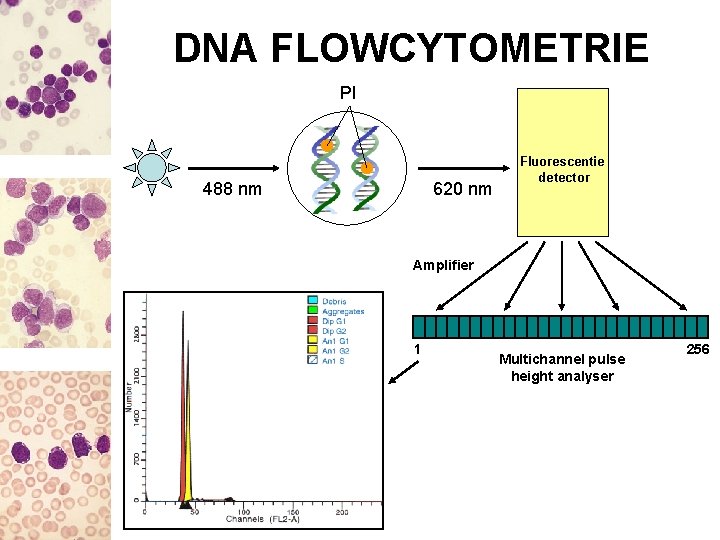
PRINCIPE FLOWCYTOMETRIE FACScalibur (BD) Sample Argon Laser Sheath fluid

DNA FLOWCYTOMETRIE PI 488 nm 620 nm Fluorescentie detector Amplifier 1 Multichannel pulse height analyser 256

DNA-HISTOGRAM

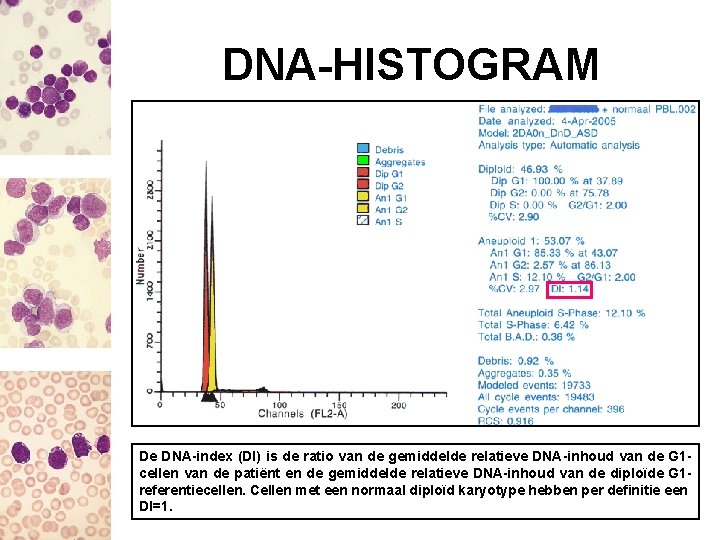
DNA-HISTOGRAM De DNA-index (DI) is de ratio van de gemiddelde relatieve DNA-inhoud van de G 1 cellen van de patiënt en de gemiddelde relatieve DNA-inhoud van de diploïde G 1 referentiecellen. Cellen met een normaal diploïd karyotype hebben per definitie een DI=1.

ANALYTISCHE PERFORMANTIE • • # events > 10. 000 CV diploïde piek ≤ 3% % B. A. D. (debris/aggregaten) < 20% (Reduced Chi-Square (RCS): goodness of fit) – 1, 0 tot 3, 0: goed – 3, 0 tot 5, 0: matig – > 5, 0: slecht Prout’s Neck DNA Cytometry Consensus Conference guidelines, USA 1992 (Shankey et al. , 1993)

WAAROM? • Ploïdie-status blasten is prognostische indicator in acute lymfoblastische leukemie (ALL) • DNA-index opgenomen in risico-classificatie criteria pediatrische ALL (< 18 jaar) • Behandeling verschillend naargelang risicogroep • Kinderen met zeer laag risico op recidief: minder intensieve en minder toxische therapieschema’s; zeer hoog risico-ALL: aangepaste en aggresievere therapie

ACUTE LYMFOBLASTISCHE LEUKEMIE • Systemische, neoplastische proliferatie van lymfoblasten • +/- 70% van de gevallen: patiënten < 17 jaar • ALL meest voorkomende vorm van kanker bij kinderen: +/- kwart van de kankerdiagnoses • Acute leukemie bij kinderen: ALL/AML → 5: 1 • Genezingskans pediatrische patiënten: 80% • Ongekende etiologie – Bestraling – Genetische factoren: Down syndroom

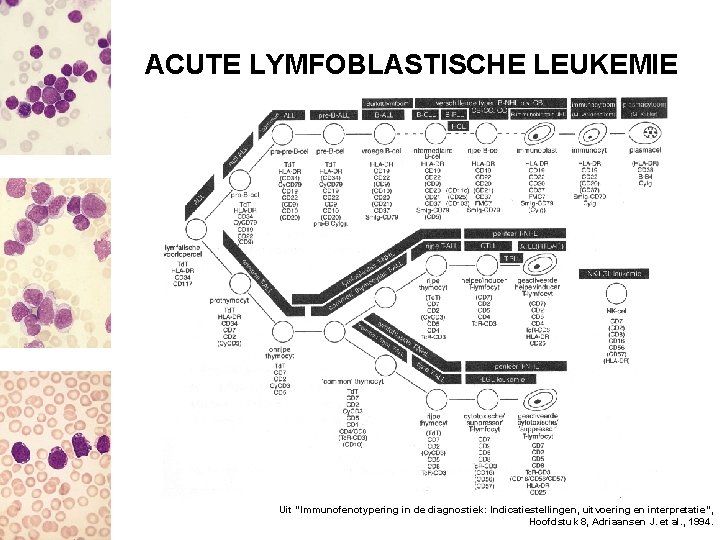
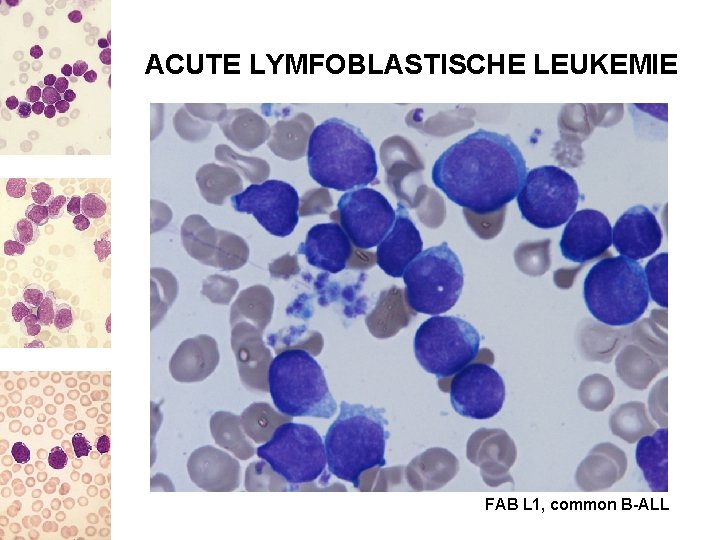
ACUTE LYMFOBLASTISCHE LEUKEMIE • Klinisch: bloed cytopenieën (bleek, vermoeid, bloedingen, koorts, infecties), extramedullaire leukemische infiltraten (CNS, lymfadenopathie, hepatosplenomegalie) • Origine blasten: – Precursor B-lymfocyten: 85% – Precursor T-lymfocyten: 15% • Classificatie morfologisch (FAB): L 1, L 2, L 3 (Burkitt) • Classificatie immunofenotypisch (EORTC): – Pro-B ALL, common B, pre-B, mature B – Pro-T ALL, pre-T, cortical T (common-T), mature T

ACUTE LYMFOBLASTISCHE LEUKEMIE Uit “Immunofenotypering in de diagnostiek: Indicatiestellingen, uitvoering en interpretatie”, Hoofdstuk 8, Adriaansen J. et al. , 1994.

ACUTE LYMFOBLASTISCHE LEUKEMIE FAB L 1, common B-ALL

BEHANDELINGSSTRATEGIE • Grondige evaluatie van risico op recidief: voorkomen van over- of onderbehandeling • Meeste pediatrische hemato-oncologische centra: deelname aan klinische studies waardoor behandeling volgens gestandaardiseerde onderzoeksprotocols • Geen uniform risico-classificatiesysteem • Belangrijke risico-classificatie criteria: – – – Initieel WBC-aantal Leeftijd bij diagnose Cytogenetica en ploïdie Immunofenotype Respons op inductietherapie

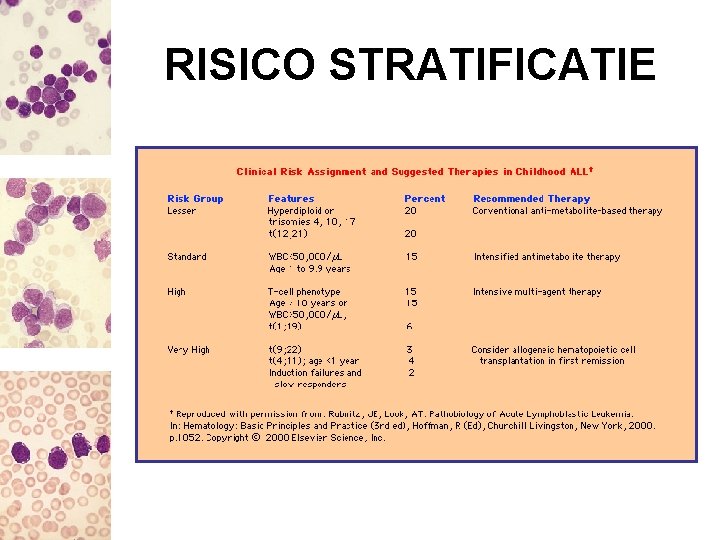
RISICO STRATIFICATIE

EORTC PROTOCOL 58951 “Dexamethasone vs prednisolone during induction and maintenance therapy, prolonged vs conventional duration of L-Asparaginase therapy during consolidation and late intensification, in ALL and NHL of childhood. A Randomised phase III. ” • EORTC: European Organisation for Research and Treatment of Cancer • CLCG (EORTC Children’s Leukemia Cooperative Study Group) trial 58951: België, Frankrijk, Portugal • Vier risicogroepen: – – Very low risk (VLR) Average risk 1 (AR 1) Average risk 2 (AR 2) Very high risk (VHR)

VLR CRITERIA • • ALL of B-cell lineage – WBC less than 10, 000/mm 3 – Must meet 1 of the following conditions: • DNA index greater than 1. 16 and less than 1. 50 and chromosome number 51 -66 or unknown • DNA index not assessed and chromosome number 51 -66 • DNA index greater than 1. 16 and less than 1. 50 and chromosome number is unknown – Good response to prephase therapy – Absence of t(9; 22) or BCR/ABL, t(4; 11)/MLL-AF 4, or 11 q 23/MLL rearrangement – No acute undifferentiated leukemia (AUL) – No CNS or gonadal involvement Precursor B-lymphoblastic NHL stage I or II

AR CRITERIA • • • Must meet 1 of the following criteria: – ALL with good response to prephase therapy who are neither VLR or very high risk (VHR) – VLR ALL with CNS involvement (CSF positive or negative) – Precursor B-lymphoblastic NHL stage III or IV without any VHR feature – Precursor T-lymphoblastic NHL AR patients substratified in: – AR 1: B-cell lineage ALL with WBC less than 100, 000/mm 3 • Surreptitious or hemorrhagic CSF becoming negative at D 4 of prephase therapy • Precursor B-lymphoblastic NHL stage III or IV • Precursor T-lymphoblastic NHL stage I or II – AR 2: B-cell lineage ALL with WBC at least 100, 000/mm 3 • T-cell lineage ALL regardless of the WBC • Overt or non-equivocal CNS involvement at D 0 or any CSF involvement at D 4 • Gonadal involvement • Precursor T-lymphoblastic NHL stage III or IV Newborn Down syndrome patients with AR 2 features are assigned to the AR 1 group

VHR CRITERIA • • • Must meet 1 of the following criteria: – ALL patients meeting 1 of the following conditions: • Poor response to prephase therapy (at least 1, 000/mm 3 blasts in peripheral blood after completion of prephase therapy) • t(9; 22) or BCR/ABL • t(4; 11)/MLL-AF 4 • 11 q 23/MLL rearrangement • Near haploidy (no more than 34 chromosomes or DNA index less than 0. 7) • Hypodiploid (35 -40 chromosomes or DNA index 0. 7 to 0. 8) • AUL • For B lineage ALL: failure to achieve complete response (CR) after completion of protocol IA • For T lineage ALL: failure to achieve CR or good partial response (GPR) after completion of protocol IA • Minimal-residual disease (greater than 1, 000 blasts/100, 000 mononuclear bone marrow cells) at evaluation of IA (day 35) – NHL patients who failed to achieve CR or GPR after completion of protocol IA All VHR patients are eligible for stem cell transplantation except those whose sole VHR criterion is a poor response to prephase therapy and who have none of the following features: – T-cell immunophenotype – Early B ALL (CD 10 negative) – WBC at least 100, 000/mm 3 Newborn Down syndrome patients with VHR features are assigned to AR 1 group

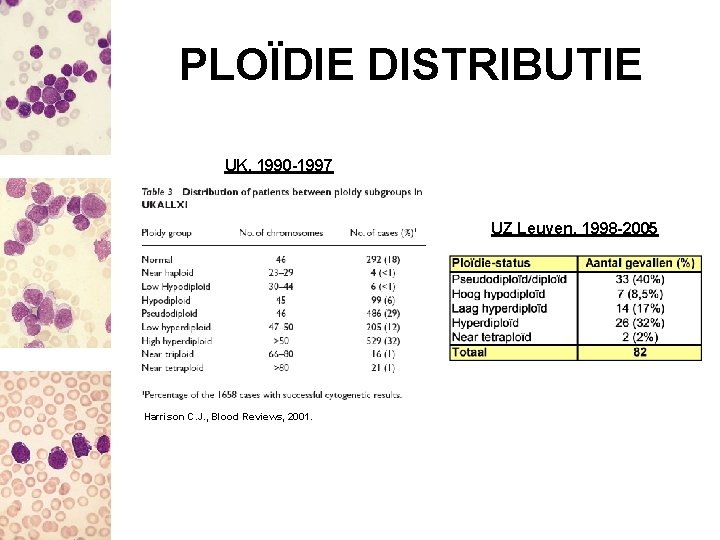
PLOÏDIE DISTRIBUTIE UK, 1990 -1997 UZ Leuven, 1998 -2005 Harrison C. J. , Blood Reviews, 2001.

DNA-analyse onder de loep…. 1. Doen we het goed? 2. Gaan we de analyse behouden?

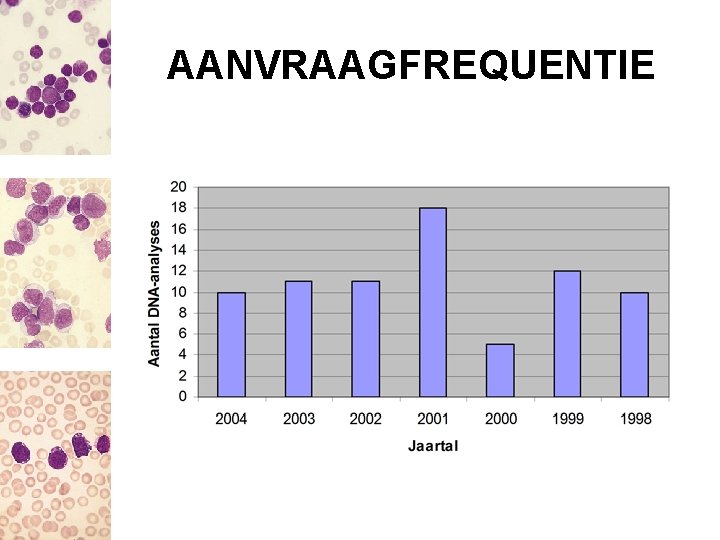
AANVRAAGFREQUENTIE

CYTOGENETICA • Cytogenetica: complementaire versus alternatieve methode • Karyotypering en FISH: numerische én structurele chromosomale abnormaliteiten • ALL: lage mitose-index, lage kwaliteit van de metafasen → karyotypering vaak bemoeilijkt – Doch slechts 1 x geen diagnose via karyotypering op een totaal van 82 stalen (1. 2%) door CME UZ Leuven – FISH tevens uitgevoerd indien geen definitieve conclusie via karyotype • Cytogenetische testen: langere antwoordtijden ( DNA-analyse: < 2 dagen) – Karyotypering: +/- 3 dagen – FISH: tot +/- 1 maand

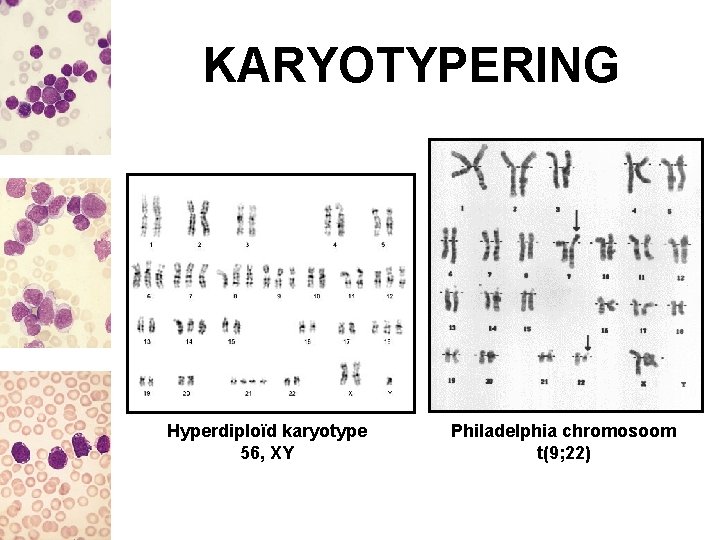
KARYOTYPERING Hyperdiploïd karyotype 56, XY Philadelphia chromosoom t(9; 22)

RETROSPECTIEVE ANALYSE: WAAROM? • Zeer lage uitvoerfrequentie: vervallen reagentia, matige expertise • Geen adequate interne controle (normaal perifeer bloed PBMC) • Geen interne kwaliteitscontrole met kippen erytrocyt nucleï (DNA QC Particles, BD) – Geen kalibratie flowcytometer – Geen controle lineariteit – Geen controle resolutie

RETROSPECTIEVE ANALYSE • Resultaten DNA-analyse vergelijken met de karyotypering • Slechts 82 stalen tussen januari 1998 – maart 2005 • DNA-analyse praktisch altijd op beenmerg uitgevoerd, slechts in 2 gevallen op perifeer bloed • Karyotypering: (vermoedelijk) altijd op beenmerg

RESULTATEN • 68%: goede correlatie tussen DNA FCM en karyotypering • Gebrekkige correlatie in 21 gevallen (26%): altijd slechts 1 -3 chromosomen afwijkend → te lage resolutie FCM – Look et al. (1985), Hiddemann et al. (1987), Perez-Vera et al. (2004) missen eveneens lage hyperdiploïdie/hoge hypodiploïdie met DNA FCM – Deze gebrekkige correlatie echter geen invloed op risico stratificatie (> 50 chromosomen: VLR, ≤ 40 chromosomen: VHR) • 5 (6%) belangrijke discordanties DNA FCM karyotypering

DISCORDANTIES • 3 gevallen met meerdere leukemische lijnen (patiënt 24, 48, 49) – Leukemische lijn met laagste ploïdie arbitrair als primaire lijn – Prognostisch minst gunstige lijn bepaalt het risico – Risico diploïdie lage hyperdiploïdie near tetraploïdie > risico hyperdiploïdie • 1 geval (patiënt 47) met correcte analyse (DI = 1, 14), echter foutief gerapporteerd • 1 geval (patiënt 46) foutief geanalyseerd als diploïd (histogram toont schouder!)

DNA FCM VS CYTOGENETICA • DNA-analyse na uitsluiten onoverkomelijke discordanties: 1 foutieve interpretatie op een totaal van 82 stalen (1, 2%) • Karyotypering: 1 x geen diagnose (1, 2%), FISH toont wel vermoeden van hyperdiploïdie • Deze twee gevallen telkens toch toegewezen aan de very low risk-groep op basis van het cytogenetische respectievelijk het DNA-analyse resultaat

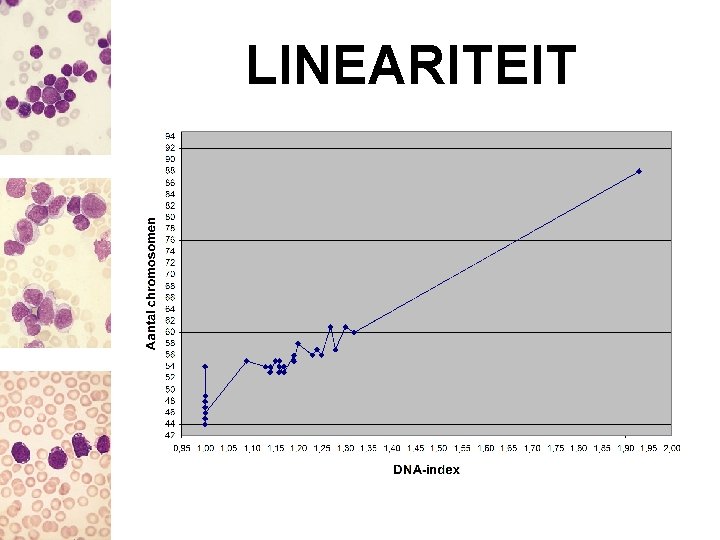
LINEARITEIT

LINEARITEIT Cut-off voor gunstige hyperdiploïdie: DI ≥ 1, 16 of > 50 chromosomen!

LINEARITEIT • Look et al. (Blood, 1985) – DI ≥ 1, 16 geassocieerd met ≥ 53 chromosomen – Uitzonderingen: individuele chromosomen kunnen tot 4, 5 -voud variëren in DNA-inhoud • Cut-off van 1, 16 dient met de grootste voorzichtigheid gehanteerd te worden • Matige lineariteit van DNA FCM in ons laboratorium voornamelijk te wijten aan slechte lineariteit flowcytometer (immers geen controle!)

DIAGNOSTISCHE PERFORMANTIE • DNA-index geen diagnostische maar prognostische waarde • Diagnose van very low risk-patiënten (DI ≥ 1, 16 en > 50 chromosomen) – Vals negatief resultaat: DI < 1, 16 en > 50 chromosomen → sensitiviteit = 17/24 = 71% – Vals positief resultaat: DI ≥ 1, 16 en < 50 chromosomen → specificiteit = 54/54 = 100% • Rekening gehouden met de matige lineariteit van de flowcytometer → vals negatief resultaat in ons labo definiëren als DI ≤ 1 en > 50 chromosomen sensitiviteit = 23/24 = 96% • Sensitiviteit/specificiteit DNA-analyse: moeilijk tot geen exacte cijfers terug te vinden in de literatuur – Enkele onderzoeksgroepen (Hiddemann et al. , Perez-Vera et al. ): sensitiviteit van 100% – Andere onderzoeksgroepen (Smets et al. , Look et al. ): near 100% retrieval van hyperdiploïdie d. m. v. DNA FCM

KOSTEN IMPACT • Bij elke aanvraag analyse steeds op drie verschillende celsuspensies uitgevoerd – Cellen patiënt + normale controle – Cellen normale controle • Totaalkost/test: 32, 28 € • Honoraria RIZIV voor ambulante patiënt en enkelvoudig voorschrift (B 450 -test): 23, 23 € • Nettokost/test: 9, 05 € • Prijs Cycle. TEST PLUS DNA reagens kit (BD; 40 testen): 233 € • Prijs DNA QC Particles kit (BD; 25 controles): 294 €

OVERGEBRUIK/ONDERGEBRUIK DNA-ANALYSE • UZ Leuven: enkel bij nieuwe diagnose pediatrische ALL • Andere mogelijke indicaties: – Multiple myeloma (hyperdiploïdie hier ook betere prognose) – Non-Hodgkin lymfomen (%S-fase fractie) – Vaste weefseltumoren (bijv. borsttumor: %S-fase fractie) • Andere ziekenhuizen: – UZ Gent: ALL, neuroblastoma (reagens kit Beckman Coulter) – AZ VUB: ALL (stalen worden doorgestuurd naar extern labo) – Virga Jesse Hasselt: multiple myeloma, lymfomen, weefseltumoren (reagens kit BD) – UZA: multiple myeloma (zelf-bereide reagentia) • DNA FCM en karyotypering gelijktijdig uitgevoerd om risico op vals negatieven te beperken, sequentiële strategieën echter meer kosten-efficiënt

Gaan we de DNA-analyse behouden of afschaffen in ons laboratorium?

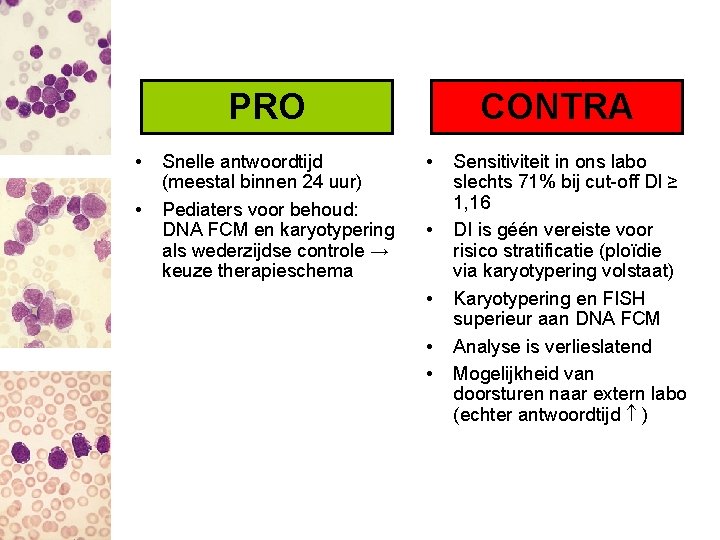
PRO • • Snelle antwoordtijd (meestal binnen 24 uur) Pediaters voor behoud: DNA FCM en karyotypering als wederzijdse controle → keuze therapieschema CONTRA • • • Sensitiviteit in ons labo slechts 71% bij cut-off DI ≥ 1, 16 DI is géén vereiste voor risico stratificatie (ploïdie via karyotypering volstaat) Karyotypering en FISH superieur aan DNA FCM Analyse is verlieslatend Mogelijkheid van doorsturen naar extern labo (echter antwoordtijd )

KWALITEIT VERBETEREN? • Aliquots maken van de reagentia en bewaren op -18°C • Adequate interne controle: PBMC i. p. v. vol bloed • QC-kit of overeenkomst met BD voor (half)jaarlijkse controle en kalibratie zoals voor de overige flowcytometrische testen • Eventueel zelf-bereide reagentia i. p. v. commerciële kit (goedkoper, langere houdbaarheid) • Verhogen uitvoerfrequentie (M. Kahler, lymfomen, weefseltumoren)?

TO DO • Overleg met de pediaters: voor- en nadelen van de DNA-analyse goed tegen elkaar afwegen test al dan niet afschaffen • Indien de test behouden blijft, stappen ondernemen om de kwaliteit te verbeteren (aliquots, PBMC, afspraken BD, …) • Pediaters informeren over de matige lineariteit tussen DI en # chromosomen: voorzichtigheid geboden bij hanteren van de cut-off van 1, 16

THE END…
 Inge thoelen
Inge thoelen Cat 1 cat 2 cat 3 aviation
Cat 1 cat 2 cat 3 aviation Ils cat 1 minima
Ils cat 1 minima Palavras convergentes
Palavras convergentes Via positiva and via negativa
Via positiva and via negativa Lucas 22 27 explicación
Lucas 22 27 explicación Sistema piramidal y extrapiramidal
Sistema piramidal y extrapiramidal Sexta estacion del via crucis
Sexta estacion del via crucis Air purifying respirator (apr)
Air purifying respirator (apr) àpr
àpr Apr vs ear
Apr vs ear Apr vs ear
Apr vs ear Sistem za centralizovano prijavljivanje korisnika apr
Sistem za centralizovano prijavljivanje korisnika apr Ncaa apr database
Ncaa apr database Apr vs ear
Apr vs ear Cours cap apr
Cours cap apr Annual product report
Annual product report What does apr stand for
What does apr stand for Jan fab mar
Jan fab mar I bought me a cat and the cat pleased me
I bought me a cat and the cat pleased me Heidi paju
Heidi paju Han haitjema
Han haitjema Inge hill
Inge hill Inge van boxtel
Inge van boxtel Inge lammers
Inge lammers Inge holsbeeks
Inge holsbeeks Inge lahtmets
Inge lahtmets Inge fomsgaard
Inge fomsgaard Inge van vilsteren
Inge van vilsteren Inge trijssenaar
Inge trijssenaar Inge-bert täljedal
Inge-bert täljedal Ulla lehmann
Ulla lehmann Inge lindsaar
Inge lindsaar Inge meichsner
Inge meichsner Marika eidmann
Marika eidmann Inge van wijk
Inge van wijk Vilsandi rahvuspark
Vilsandi rahvuspark Fitinge
Fitinge Leif inge tjelta
Leif inge tjelta Inge harmsen
Inge harmsen Inge amundsen
Inge amundsen