CALOR Y TEMPERATURA MF43 jmmc TEMPERATURA La temperatura































- Slides: 34

CALOR Y TEMPERATURA MF_4_3 jmmc

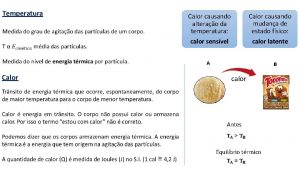
TEMPERATURA La temperatura se relaciona con el valor de la energía cinética media de las moléculas que componen una sustancia. La temperatura se basa en la propiedad que se denomina estado térmico de los cuerpos, la cual podemos cuantificar con el uso instrumento llamado termómetro.

TERMÓMETROS La comparación de las temperaturas de los cuerpos por medio del tacto sólo proporciona una idea cualitativa de dichas cantidades. Para que la temperatura pueda considerarse una cantidad física es necesario que podamos medirla, a fin de que se tenga un concepto cuantitativo de la misma. Termómetros Líquidos: En nuestro estudio consideraremos el termómetro más común, el cual relaciona la temperatura con la altura de una columna de líquido en el interior de un tubo capilar de vidrio. En este termómetro, las variaciones en la temperatura producen dilataciones o contracciones del líquido, haciendo subir o bajar la columna. Así a cada altura de la columna podemos asignarle un número, el cual corresponde a la temperatura que determinó dicha altura.

TERMÓMETRO DE MERCURIO Sus puntos límites, bastante separados (-39 ºC y 357 ºC) determinan un amplio margen de temperaturas medibles; Su dilatación es bastante regular, lo que favorece la precisión del instrumento; Tiene baja capacidad calórica, es decir, con una pequeña cantidad de calor su temperatura se eleva apreciable y rápidamente; Es fácil de obtener químicamente puro; No moja al vidrio, por lo cual no influye la capilaridad del tubo.

TERMÓMETRO MÉDICO O CLÍNICO Es un tipo de termometro 1 líquido que utiliza la dilatación y contracción que provocan las variaciones de temperatura en una columna de mercurio que se emplea como líquido termométrico, haciendo subir o bajar dicha columna. Así, a cada altura se le asigna un número que corresponderá al valor de la temperatura. El termómetro clínico de mercurio solo puede medir temperaturas máximas, ya que posee un no estrechamiento en la base del tubo lo que impide que el mercurio se devuelva, lo que explica por que hay que agitarlo antes de usarlo nuevamente. Los termómetros están graduados gracias a una escala termométrica que permite asociar un valor numérico a cada estado térmico.

OTROS TERMÓMETROS Termómetros de Gas: Se basan la variación de la presión y del volumen de los gases, ofrecen medidas de alta precisión en amplios intervalos de temperatura (-263 ºC a 1000 ºC). Termómetros de Resistencia eléctrica: Ofrecen alta precisión, algunos usan semiconductores (germanio), son los más recomendados para medir temperaturas muy bajas (0, 2 K a 50 K). Termómetros de Radiación (pirómetro óptico): Se basan en la medida de la energía irradiada por un cuerpo, la cual depende de la temperatura. La corriente eléctrica en el filamento se altera hasta que objeto y filamento aparecen igualmente brillantes. Termómetros Bimetálicos: Se basan en el encurvamiento de láminas bimetálicas al ser calentadas. Se usan como termostatos (instrumentos destinados a regular la temperatura de un recinto). Termómetros de cristal líquido: Se usan para medir diversas temperaturas, ya que en cada una de ellas su color se modifica, es decir, están basadas en los cambios de color (tiras para bebe).

ESCALAS TERMOMÉTRICAS Escala Celsius Escala basada en las propiedades del agua. Propuesta en 1. 742 por Anders Celsius. A la temperatura del punto de congelamiento del agua pura a nivel del mar, se le asigna 0°C. A la temperatura del punto de ebullición del agua se le asignan 100°C. No existe temperatura más baja que -273, 15°C, esta se denomina cero absoluto.

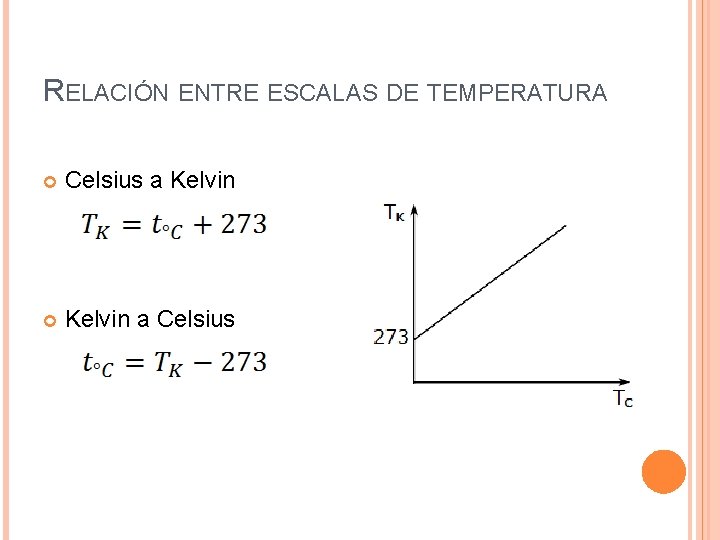
ESCALAS TERMOMÉTRICAS Escala Kelvin Escala basada en el cero absoluto. Propuesta en 1848 por William Thomson, Lord Kelvin. Su unidad de medida es el Kelvin [K] y es la unidad de medida para la temperatura según el S. I. El 0[K] equivale al nivel de menor agitación molecular. El punto de congelamiento del agua en esta escala es 273, 15[K] y el punto de ebullición es 373, 15[K].

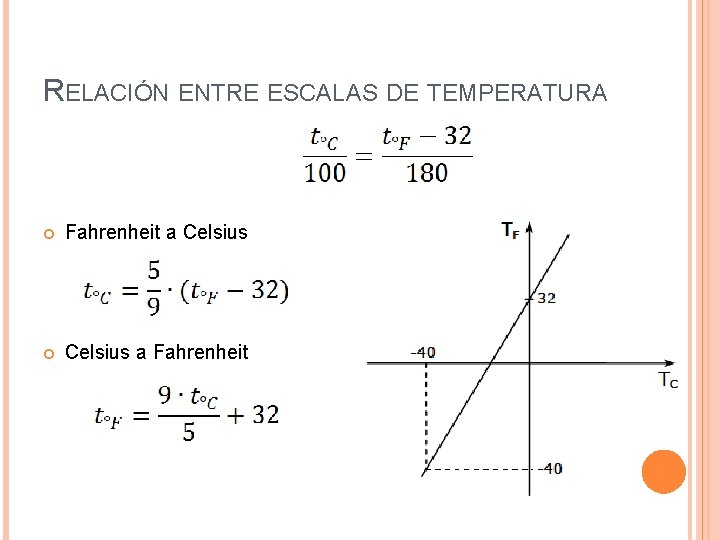
ESCALAS TERMOMÉTRICAS Escala Fahrenheit Propuesta en 1724 por Gabriel D. Fahrenheit. El 0°F corresponde a la temperatura de una mezcla en partes iguales de hielo machacado y cloruro de amonio. El punto de ebullición del agua en esta escala es 212°F y el punto de congelamiento es 32°F.

RELACIÓN ENTRE ESCALAS DE TEMPERATURA Celsius a Kelvin a Celsius

RELACIÓN ENTRE ESCALAS DE TEMPERATURA Fahrenheit a Celsius a Fahrenheit

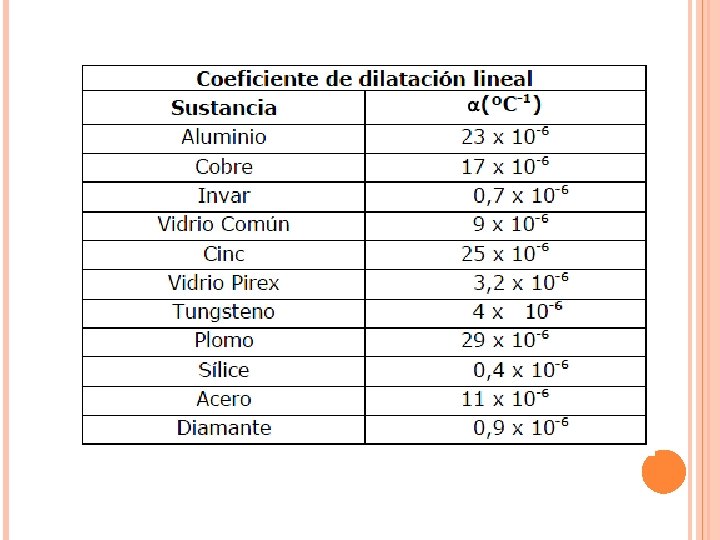
DILATACIÓN TÉRMICA Dilatación Lineal: corresponde a la variación de longitud ∆L de un cuerpo, que esta relacionada con el tipo de material y es proporcional a la longitud inicial L 0 y a la variación de temperatura ∆T que experimente: α corresponde al coeficiente de dilatación lineal.

DILATACIÓN TÉRMICA Dilatación Superficial Dilatación Volumétrica


DILATACIÓN ANÓMALA DEL AGUA El agua es una de las tres excepciones que al pasar desde el estado solido al líquido disminuye su volumen (las otras dos son el hierro y el bismuto), las características de ésta anomalía se presentan a continuación: Al aumentar la temperatura del agua de 0°C hasta 4°C, su volumen disminuye, lo que implica un aumento de su densidad. Esta anomalía del agua explica que en fase solida (hielo) sea menos densa que el agua líquida a menos de 4°C y que, por lo tanto, flote en su líquido. La máxima densidad del agua se tiene cuando esta se encuentra a una temperatura de 4°C y es igual a 1. 000 kg/m 3 Cuando la temperatura del agua sobrepasa los 4 C su comportamiento es común, es decir, comienza a dilatarse con el aumento de la temperatura y viceversa.

DILATACIÓN ANÓMALA DEL AGUA

EQUILIBRIO TÉRMICO Corresponde al equilibrio que alcanzan dos cuerpos con diferentes temperaturas que son puestos en contacto térmico. Algunas características de este son: El cuerpo que se “calienta” absorbe la energía calórica proveniente del cuerpo que se “enfría” (el que cede energía calórica). La cantidad de calor que cede el cuerpo “caliente”, es igual a la cantidad absorbida por el cuerpo más “frío”. Una vez logrado el equilibrio térmico, no hay flujo neto de calor de un cuerpo a otro.

MATERIALES Y CALOR El calor es la transferencia espontánea de energía entre dos cuerpos, originada en una diferencia de temperatura entre ellos, el cual representaremos con la letra Q. La dirección de transferencia de calor es siempre del cuerpo de mayor temperatura al de menor temperatura. Esta transferencia neta de energía finaliza cuando ambos cuerpos alcanzan la misma temperatura (equilibrio térmico).

MATERIALES Y CALOR Es importante recalcar que los cuerpos no contienen calor, el calor es energía en tránsito entre cuerpos con distintas temperaturas y una vez transferida, la esta deja de “calentar”. Los objetos poseen un conjunto de energías internas debido a los movimientos moleculares y a las fuerzas de atracción entre los átomos. Este conjunto de energías que s posee un cuerpo se llama energía interna. Podemos decir por lo tanto que: Energía interna corresponde a la energía que contienen las moléculas que forman una sustancia. A medida que la temperatura de una sustancia aumenta, también aumenta la agitación de sus moléculas y viceversa. Esta agitación molecular hace crecer la velocidad promedio y también la energía potencial.

CALOR La unidad de medida del calor en el S. I. es el Joule [J], la misma unidad con la que se mide la energía. Aunque no pertenece al S. I. , se utiliza a la caloría [cal] como unidad de calor. Su equivalencia con el joule es la siguiente: 1[cal] = 4, 18[J] Cuando un cuerpo absorbe o emite calor, aumenta o disminuye su energía interna. Pero no necesariamente una transferencia de calor se traduce en un aumento de temperatura, ya que la transferencia de calor a un cuerpo puede aumentar cualquier otra energía interna y no obligadamente generar un aumento de la agitación molecular.

CALORÍA Una caloría (cal) es la cantidad de calor necesaria para elevar la temperatura de un gramo de agua en un grado Celsius. Las calorías que vienen indicadas en los alimentos, son en verdad kilocalorías, es decir: 1 Caloría = 1. 000 cal =1 kcal

CAPACIDAD CALÓRICA Es la relación del calor suministrado con respecto al correspondiente incremento de temperatura del cuerpo. También la podemos definir como la cantidad de calor necesario para elevar un grado la temperatura de un cuerpo.

CALOR ESPECÍFICO El calor específico corresponde a la capacidad calórica por unidad de masa de una sustancia, es decir, el calor específico “c” representa la energía necesaria para que una unidad de masa “m” de una sustancia aumente su temperatura en un grado Celsius (o Kelvin) sin cambiar de estado.


CALOR CEDIDO Y ABSORBIDO De la definición de calor específico y capacidad calórica, se puede determinar la energía calórica Q transferida entre una sustancia de masa m y los alrededores para un cambio de temperatura, como: Convenio: +Q absorbido (sistema); -Q cedido (sistema)

CONSERVACIÓN DE LA ENERGÍA Cuando dos cuerpos A y B de distintas temperaturas se ponen dentro de un calorímetro, entran en contacto térmico y al cabo de un tiempo se logra el equilibrio térmico. Considerando que el calor que uno cede lo absorbe el otro, se tiene:

TEMPERATURA DE EQUILIBRIO Si dos sustancias que se encuentran a diferente temperatura se mezclan, la temperatura de equilibrio,

PROPAGACIÓN DEL CALOR Conducción: es la transferencia de calor por contacto directo. Convección: es la transferencia de calor a través de fluidos. Radiación: es la transferencia de calor a través de ondas electromagnéticas.

PROPAGACIÓN DEL CALOR

CAMBIO DE FASE

CAMBIO DE FASE Los cambios de fase en que las sustancias requieren energía para que se produzcan son la vaporización, la fusión y la sublimación. Los procesos que liberan energía son la condensación, la solidificación y la sublimación inversa. El calor aplicado o liberado para realizar el cambio de fase no genera aumentos de temperatura. Durante el cambio de fase la temperatura de la muestra permanece constante, ya que la energía suministrada o liberada se utiliza en la ruptura o unión de enlaces intermoleculares.

CALOR LATENTE Calor latente de fusión Lf de una sustancia, es el calor por unidad de masa necesario para cambiar la sustancia de la fase sólida a la líquida a su temperatura de fusión. Calor de vaporización Lv de una sustancia, es el calor por unidad de masa necesario para cambiar la sustancia de líquido a vapor a su temperatura de ebullición.

CAMBIO DE FASE DEL AGUA

ROCE Y CALOR Cada vez que dos cuerpos se frotan uno contra el otro se produce fricción o roce entre ellos. A medida que el roce aumenta comienza a elevarse paulatinamente la temperatura en ambas superficies en contacto. Lo anterior se debe a que como los cuerpos están compuestos por átomos, y a su vez estos en su superficie contienen electrones, al chocar los electrones de un cuerpo con los electrones del otro cuerpo se producen interacciones de tipo electromagnético. La energía disipada por esta interacción se manifiesta en calor.
 Calor latente y calor sensible
Calor latente y calor sensible Fisica calor
Fisica calor Conceitos de calor e temperatura
Conceitos de calor e temperatura Mapa conceitual calor
Mapa conceitual calor Calor e temperatura
Calor e temperatura Calor especifico del acero
Calor especifico del acero Grafito calor especifico
Grafito calor especifico Flui
Flui Transferencia de calor
Transferencia de calor Q=mct unidades
Q=mct unidades Perdida de calor por evaporacion en el recien nacido
Perdida de calor por evaporacion en el recien nacido Tipos de calor
Tipos de calor 3 conductores de calor
3 conductores de calor Abb calor emag schaltanlagen ag
Abb calor emag schaltanlagen ag Difusão
Difusão Calor especifico da agua
Calor especifico da agua Fluxo de calor
Fluxo de calor Calor molar de sublimacion
Calor molar de sublimacion Aletas transferencia de calor
Aletas transferencia de calor Trocas de calor
Trocas de calor O grafico fornece a quantidade de calor
O grafico fornece a quantidade de calor Ja arribat la tardor es el temps de les castanyes
Ja arribat la tardor es el temps de les castanyes Formas de propagação de calor 7 ano slide
Formas de propagação de calor 7 ano slide Uma maquina termica ciclica recebe 5000 j de calor
Uma maquina termica ciclica recebe 5000 j de calor Conductividad termica acero
Conductividad termica acero Procesos termodinamicos
Procesos termodinamicos Los
Los Heat transfer cengel
Heat transfer cengel Cambio de energia interna en un proceso adiabatico
Cambio de energia interna en un proceso adiabatico Calor latente del aluminio
Calor latente del aluminio Calor é?
Calor é? Endotérmico
Endotérmico Lei de fourier
Lei de fourier Calor
Calor Quantidade de calor
Quantidade de calor