Aula III Ligaes Qumicas Tutora Marcia Pintos Rio




















- Slides: 36

Aula III - Ligações Químicas Tutora: Marcia Pintos Rio Grande, 13 setembro de 2014.

Sumário 1. Introdução (Camada valência, Gases Nobres e octeto) - pg. 3 -6 2. Ligações químicas pg. 7 2. 2. Regra do Octeto pg. 9 2. 2. Símbolos de Lewis pg. 12 3. Ligação Iônica pg. 18 4. Ligação Covalente pg. 25 2

Introdução Camada de Valência Última Camada do átomo = Camada de Valência Camada mais externa, ocupada pelos elétrons de valência. A camada de valência de um átomo terá no máximo 2 ou 8 elétrons. Camada em que ocorre a perda ou ganho de elétrons com a formação dos íons. • É nesta camada que ocorrerá as ligações entre os átomos formando as moléculas. • • 3

Introdução Octeto = camada de valência completa (2 ou 8 elétrons). Gases Nobres : Possuem octeto completo Demais elementos: buscam a configuração de valência dos gases nobres por meio de ligações químicas, isto é, buscam o Octeto. 4

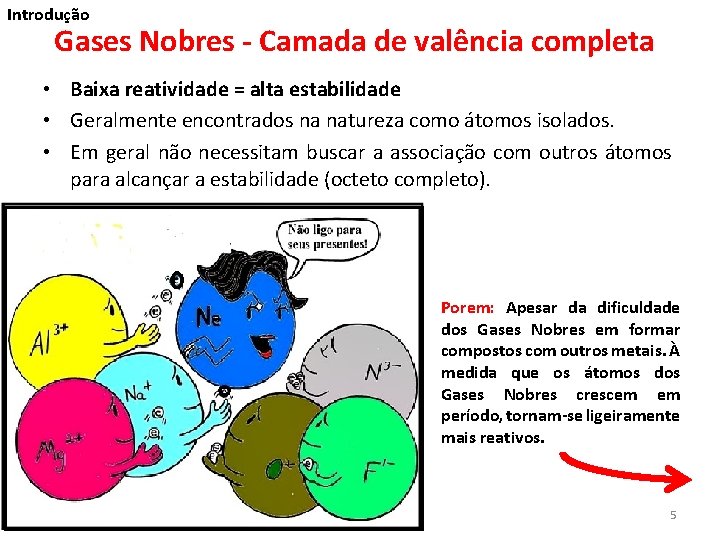
Introdução Gases Nobres - Camada de valência completa • Baixa reatividade = alta estabilidade • Geralmente encontrados na natureza como átomos isolados. • Em geral não necessitam buscar a associação com outros átomos para alcançar a estabilidade (octeto completo). Porem: Apesar da dificuldade dos Gases Nobres em formar compostos com outros metais. À medida que os átomos dos Gases Nobres crescem em período, tornam-se ligeiramente mais reativos. 5

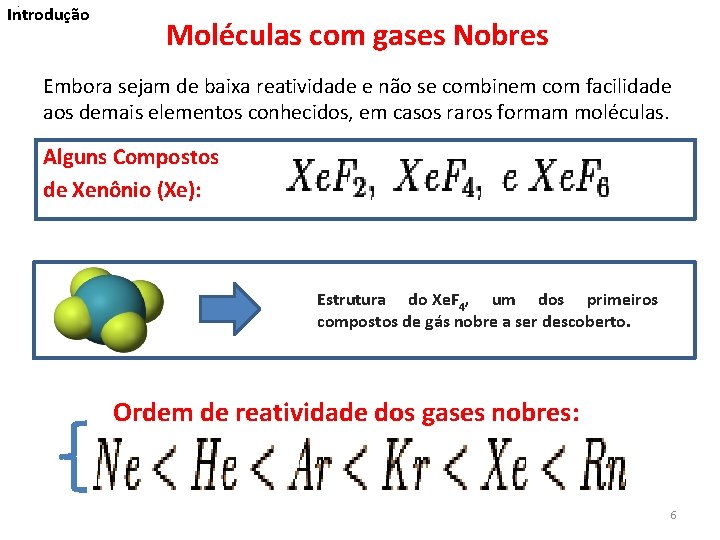
. Introdução Moléculas com gases Nobres Embora sejam de baixa reatividade e não se combinem com facilidade aos demais elementos conhecidos, em casos raros formam moléculas. Alguns Compostos de Xenônio (Xe): Estrutura do Xe. F 4, um dos primeiros compostos de gás nobre a ser descoberto. Ordem de reatividade dos gases nobres: 6

2. Ligações Químicas 7

Ligações Químicas • Ligações que ocorrem entre os átomos para formar as moléculas. • As ligações químicas ocorrem porque os átomos buscam a estabilidade, isto é, buscam alcançar a situação de octeto completo (2 ou 8 elétrons na sua camada de valência). • Desta forma, trata-se da força atrativa que mantém dois ou mais átomos unidos. 8

Octeto Regra Geral na formação das ligações químicas 9

2. 1. A regra do octeto • Refere-se a busca dos átomos por possuir configuração eletrônica na camada de valência semelhante aos gases nobres. • A regra do octeto: os átomos tendem a ganhar, perder ou compartilhar elétrons até que eles estejam rodeados por 2 ou 8 elétrons de valência (4 pares de elétrons). • OBS: existem várias exceções à regra do octeto. 10

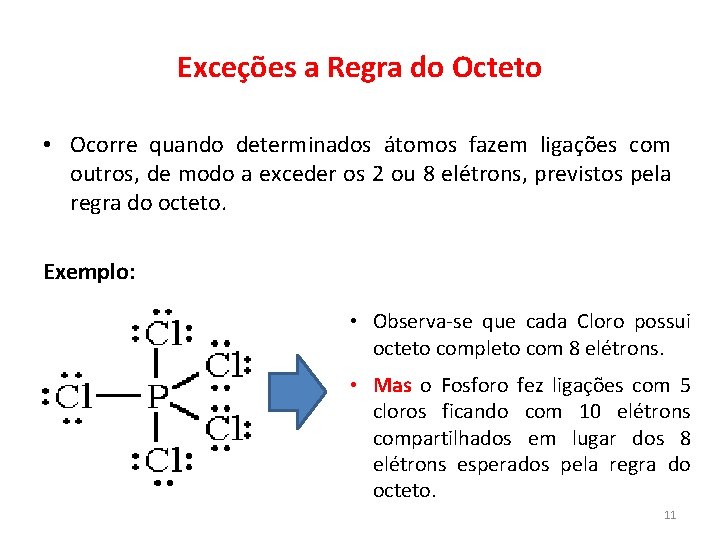
Exceções a Regra do Octeto • Ocorre quando determinados átomos fazem ligações com outros, de modo a exceder os 2 ou 8 elétrons, previstos pela regra do octeto. Exemplo: • Observa-se que cada Cloro possui octeto completo com 8 elétrons. • Mas o Fosforo fez ligações com 5 cloros ficando com 10 elétrons compartilhados em lugar dos 8 elétrons esperados pela regra do octeto. 11

Símbolos de Lewis Uma forma universal de representar os elétrons envolvidos nas ligações químicas. 12

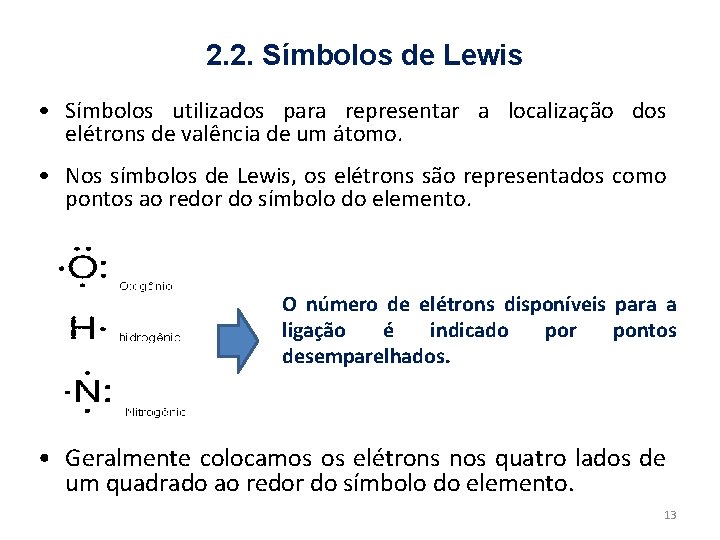
2. 2. Símbolos de Lewis • Símbolos utilizados para representar a localização dos elétrons de valência de um átomo. • Nos símbolos de Lewis, os elétrons são representados como pontos ao redor do símbolo do elemento. O número de elétrons disponíveis para a ligação é indicado por pontos desemparelhados. • Geralmente colocamos os elétrons nos quatro lados de um quadrado ao redor do símbolo do elemento. 13

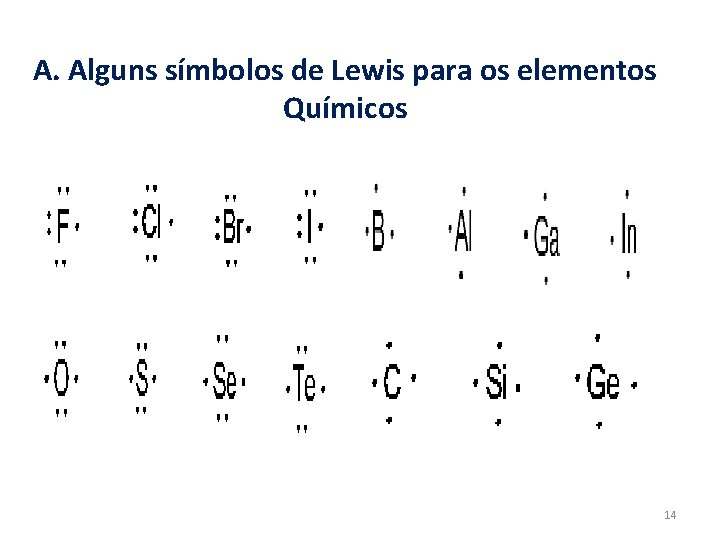
A. Alguns símbolos de Lewis para os elementos Químicos 14

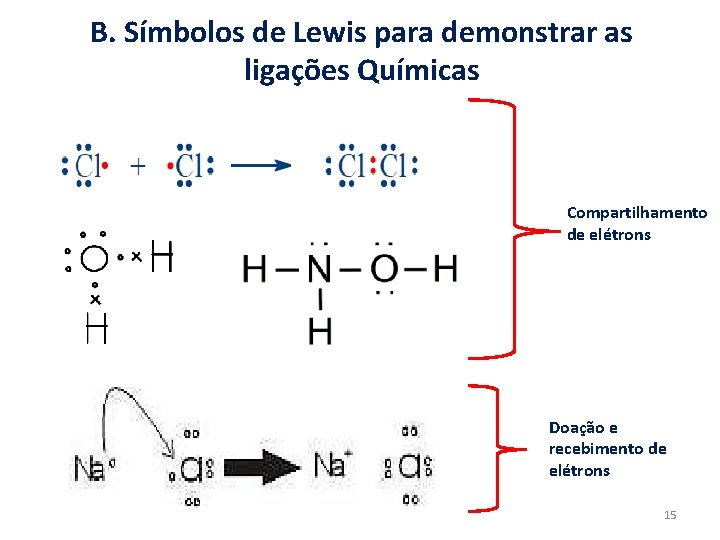
B. Símbolos de Lewis para demonstrar as ligações Químicas Compartilhamento de elétrons Doação e recebimento de elétrons 15

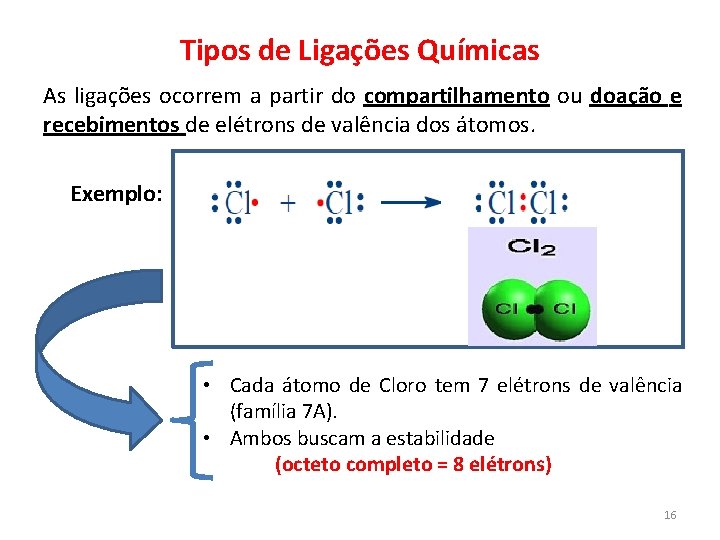
Tipos de Ligações Químicas As ligações ocorrem a partir do compartilhamento ou doação e recebimentos de elétrons de valência dos átomos. Exemplo: • Cada átomo de Cloro tem 7 elétrons de valência (família 7 A). • Ambos buscam a estabilidade (octeto completo = 8 elétrons) 16

Ligações Químicas envolvidas na formação das moléculas A. Ligação Iônica • Doação e recebimento de elétrons. • Resulta da transferência de elétrons de um metal para um não-metal. B. Ligação Covalente • Compartilhamento de elétrons entre dois átomos. • Normalmente encontrada entre elementos não-metálicos. 17

3. Ligação Iônica 18

Ligação Iônica • Ligação que ocorre entre íons opostos (cátions e ânions) por meio de atração eletrostática. • Na ligação Iônica as forças eletrostáticas atraem os íons de cargas opostas (+, -) • Forma os compostos iônicos. 19

Ligação Iônica Características dos compostos iônicos - Arranjo cristalino ordenado - Formam sólidos cristalinos = sólidos iônicos - Pelo arranjo ordenado dos átomos na ligação iônica, necessitam de alta energia para serem quebrados (altas temperaturas para a ebulição e fusão). - Os compostos iônicos são condutores de eletricidade, tanto os dissolvidos em água, como também os puros no estado líquido. - O melhor solvente para os compostos iônicos sólidos é a água. 20

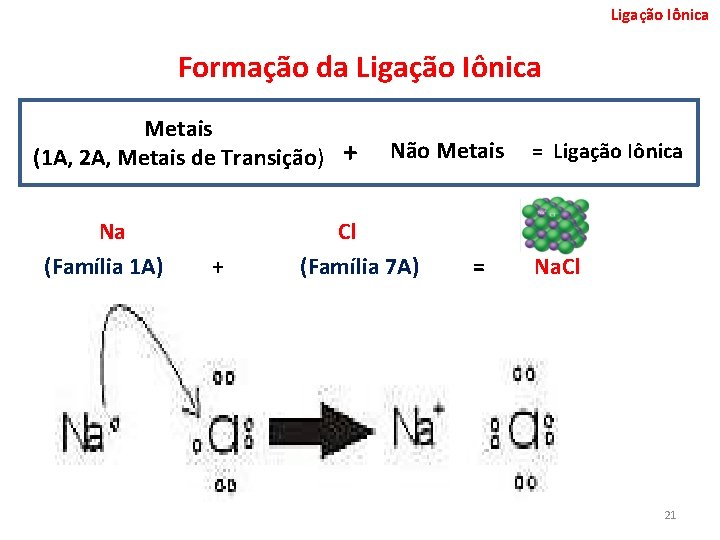
Ligação Iônica Formação da Ligação Iônica Metais (1 A, 2 A, Metais de Transição) Na (Família 1 A) + + Não Metais Cl (Família 7 A) = = Ligação Iônica Na. Cl 21

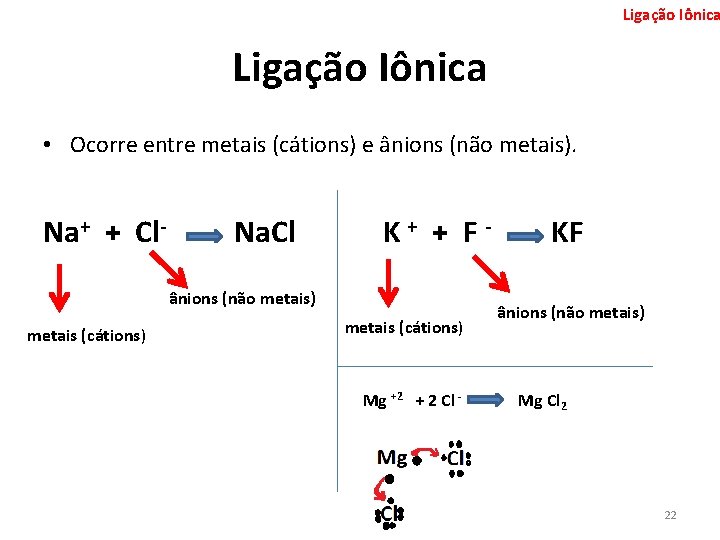
Ligação Iônica • Ocorre entre metais (cátions) e ânions (não metais). Na+ + Cl- Na. Cl K+ + F- ânions (não metais) metais (cátions) Mg +2 + 2 Cl - KF ânions (não metais) Mg Cl 2 22

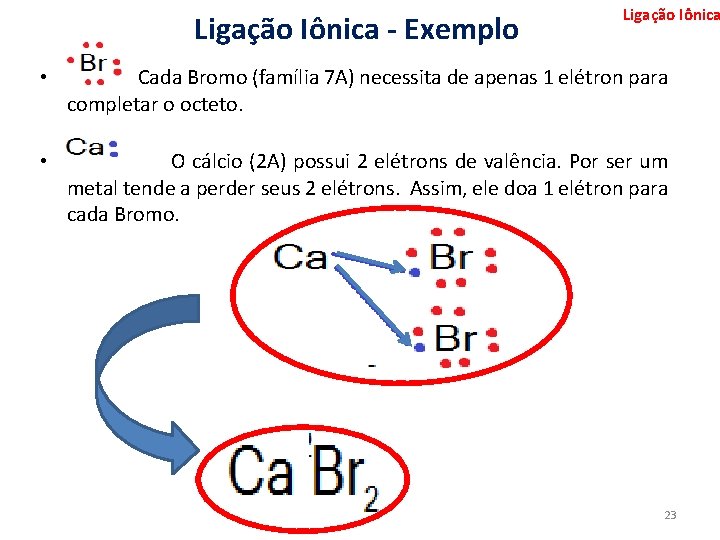
Ligação Iônica - Exemplo Ligação Iônica • Cada Bromo (família 7 A) necessita de apenas 1 elétron para completar o octeto. • O cálcio (2 A) possui 2 elétrons de valência. Por ser um metal tende a perder seus 2 elétrons. Assim, ele doa 1 elétron para cada Bromo. 23

Ligação Iônica Exercício: Mostre as Ligações Químicas entre: • • • Pb. Cl 2 = Cloreto de Chumbo II Ca. O = óxido de cálcio K, Br Li, O Dica: Observe que para todos, a ligação Ca, F será iônica porque ocorre entre um metal Ca, S e um não metal. Al, F Al, S Cloreto de Sódio (Cl, Na) Cloreto de Prata (Cl, Ag) Iodeto de Potássio (I, K) 24

4. Ligação Covalente 25

Ligação Covalente Exemplos: 1. 26

Ligação Covalente • Quando dois átomos similares se ligam, nenhum deles quer perder ou ganhar um elétron para formar um octeto. • Quando átomos similares se ligam, eles compartilham pares de elétrons a fim de que cada um atinja o octeto. • Cada par de elétrons compartilhado constitui uma ligação química. 27

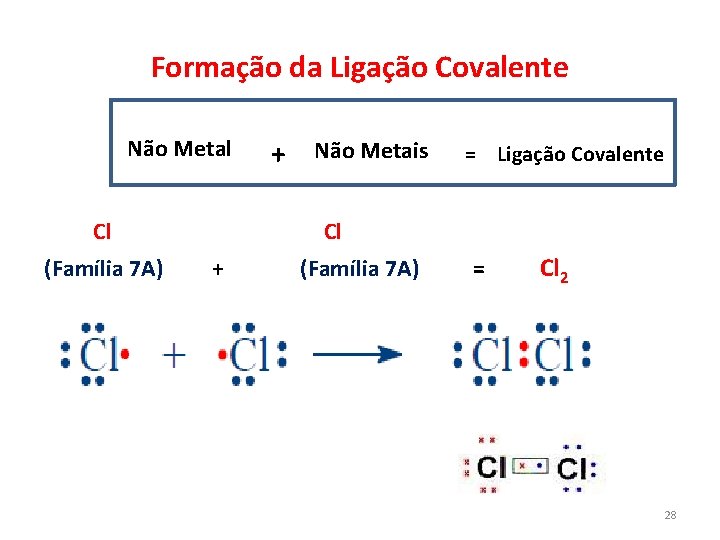
Formação da Ligação Covalente Não Metal Cl (Família 7 A) + Não Metais = Ligação Covalente Cl + (Família 7 A) = Cl 2 28

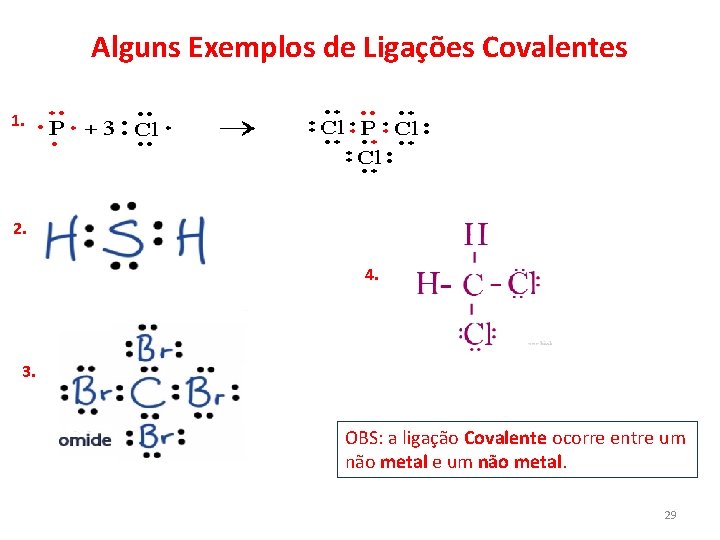
Alguns Exemplos de Ligações Covalentes 1. 2. 4. 3. OBS: a ligação Covalente ocorre entre um não metal. 29

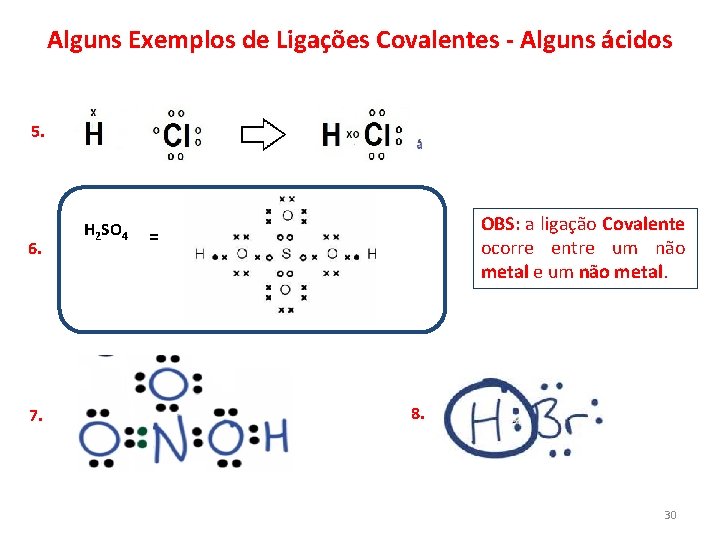
Alguns Exemplos de Ligações Covalentes - Alguns ácidos 5. 6. 7. H 2 SO 4 OBS: a ligação Covalente ocorre entre um não metal. = 8. 30

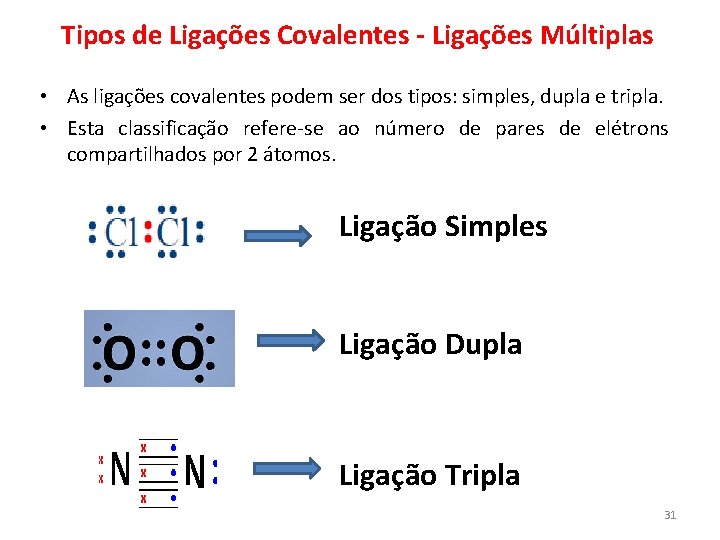
Tipos de Ligações Covalentes - Ligações Múltiplas • As ligações covalentes podem ser dos tipos: simples, dupla e tripla. • Esta classificação refere-se ao número de pares de elétrons compartilhados por 2 átomos. Ligação Simples Ligação Dupla Ligação Tripla 31

Ligação Covalente Presença de Ligações Simples e Múltiplas numa mesma molécula Na formação das moléculas é comum a ocorrência simultânea de ligações simples e múltiplas (duplas e triplas). Exemplos: 32

Ligação Covalente Exercício: Observe as ligações covalentes abaixo e indique qual estrutura de Lewis possui exceção a regra de octeto. 33

Compostos Moleculares - Covalentes • As moléculas formadas a partir das ligações covalentes são chamadas de Compostos Moleculares. • As ligações covalentes são mais fracas que as ligações iônicas. • Por esta razão apresentam menores pontos de ebulição e fusão que os compostos iônicos. 34

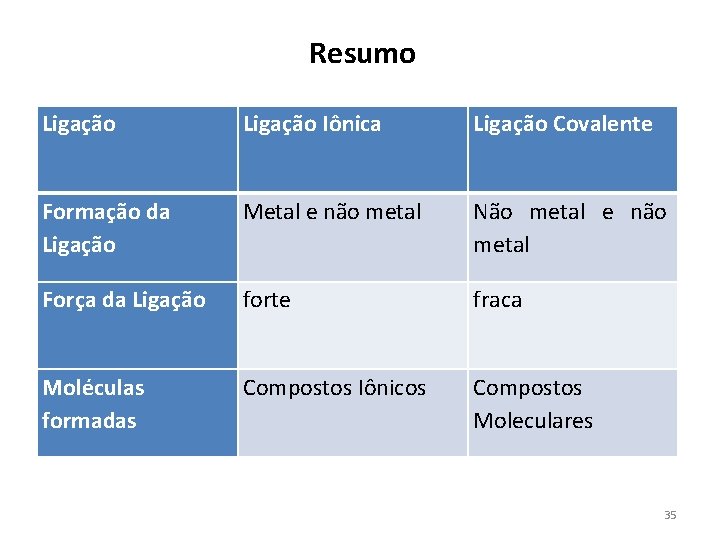
Resumo Ligação Iônica Ligação Covalente Formação da Ligação Metal e não metal Não metal e não metal Força da Ligação forte fraca Moléculas formadas Compostos Iônicos Compostos Moleculares 35

Referências 36
 Qumicas
Qumicas Objetivos de tutoria
Objetivos de tutoria Tutora sombra
Tutora sombra Reentrenamiento de la (b)entilación
Reentrenamiento de la (b)entilación La tutora 2020
La tutora 2020 Rio hondo college access rio
Rio hondo college access rio Rio tigre e eufrates mapa
Rio tigre e eufrates mapa 7 ano iii bimestre aula 1
7 ano iii bimestre aula 1 9 ano iii bimestre aula 1
9 ano iii bimestre aula 1 Hamlet act iii scene ii
Hamlet act iii scene ii Priority donation pintos
Priority donation pintos Pintos project 3
Pintos project 3 Pintos multi-oom
Pintos multi-oom Pintos threads
Pintos threads File_deny_write
File_deny_write Inervation
Inervation Pintos project 4
Pintos project 4 Pintos priority donation solution
Pintos priority donation solution Pintos project 1
Pintos project 1 Pintos argument passing
Pintos argument passing James e. marcia
James e. marcia Define identity foreclosure
Define identity foreclosure Marcia pereira
Marcia pereira Atassia frontale di bruns
Atassia frontale di bruns Marcia talloneggiante
Marcia talloneggiante Erikson and marcia
Erikson and marcia La marcia dei diritti dei bambini canzone e testo
La marcia dei diritti dei bambini canzone e testo Estado de identidad descrito por marcia
Estado de identidad descrito por marcia Márcia
Márcia Marcia rieke
Marcia rieke Marcia's four identity statuses
Marcia's four identity statuses Marcia’s identity status theory
Marcia’s identity status theory Marcia rose ewan bremner
Marcia rose ewan bremner Marcia wiernes
Marcia wiernes Domitilla cubiculum parat 2 translation
Domitilla cubiculum parat 2 translation Cause and effect reading strategy
Cause and effect reading strategy Marcia wolfson ray
Marcia wolfson ray