Ligaes Qumicas Prof Joyce Almeida Reviso dos Conceitos










- Slides: 25

Ligações Químicas Prof. : Joyce Almeida

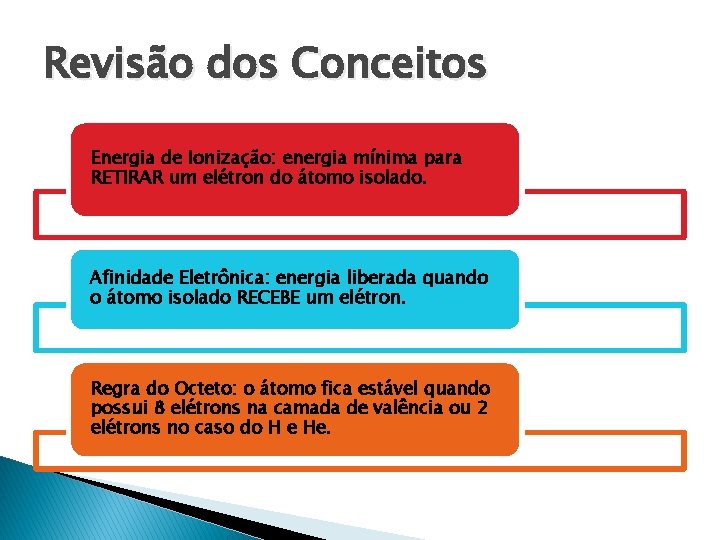
Revisão dos Conceitos Energia de Ionização: energia mínima para RETIRAR um elétron do átomo isolado. Afinidade Eletrônica: energia liberada quando o átomo isolado RECEBE um elétron. Regra do Octeto: o átomo fica estável quando possui 8 elétrons na camada de valência ou 2 elétrons no caso do H e He.

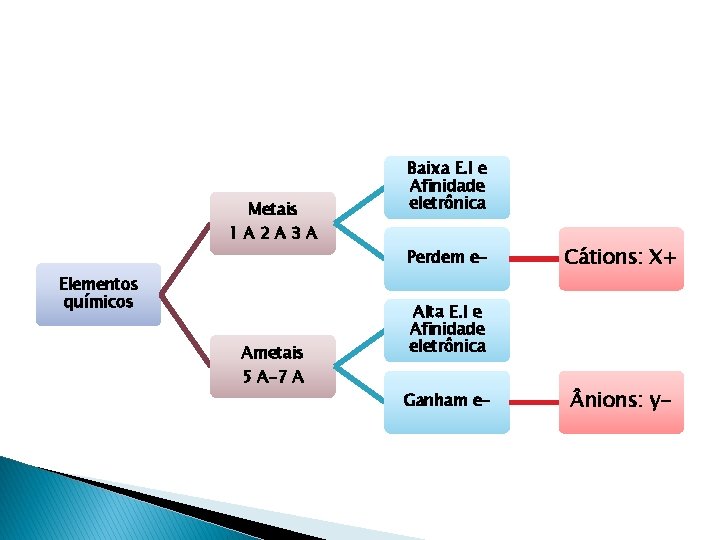
Metais 1 A 2 A 3 A Elementos químicos Ametais 5 A-7 A Baixa E. I e Afinidade eletrônica Perdem e- Cátions: X+ Alta E. I e Afinidade eletrônica Ganham e- nions: y-

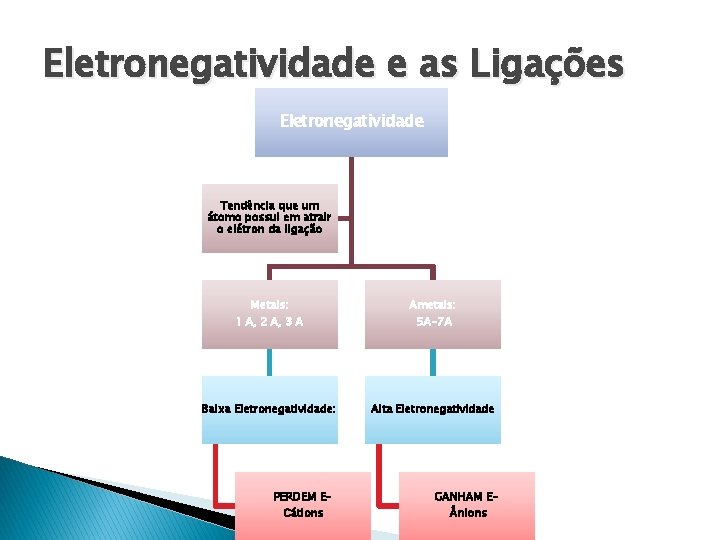
Eletronegatividade e as Ligações Eletronegatividade Tendência que um átomo possui em atrair o elétron da ligação Metais: 1 A, 2 A, 3 A Ametais: 5 A-7 A Baixa Eletronegatividade: Alta Eletronegatividade PERDEM ECátions GANHAM E nions

Íons �O átomo: eletricamente neutro; p+ = e. No entanto, o átomo, ou um grupo de átomos ligados, tem a capacidade de perder ou ganhar elétrons. Quando isso ocorre, dizemos que ele formou um íon. � Íon: é o átomo, ou grupos de átomos, que tem número de prótons diferente do número de elétrons. p+ ≠ e. Cátions e nions

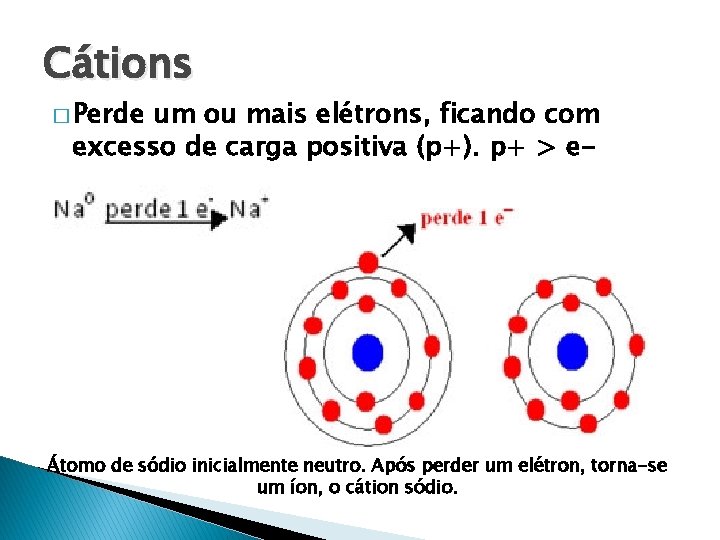
Cátions � Perde um ou mais elétrons, ficando com excesso de carga positiva (p+). p+ > e- Átomo de sódio inicialmente neutro. Após perder um elétron, torna-se um íon, o cátion sódio.

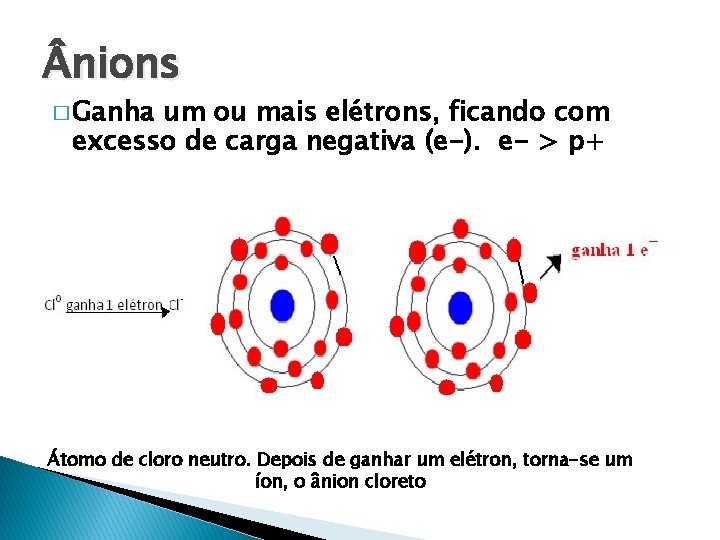
nions � Ganha um ou mais elétrons, ficando com excesso de carga negativa (e-). e- > p+ Átomo de cloro neutro. Depois de ganhar um elétron, torna-se um íon, o ânion cloreto

Exemplos de Cátions e nions

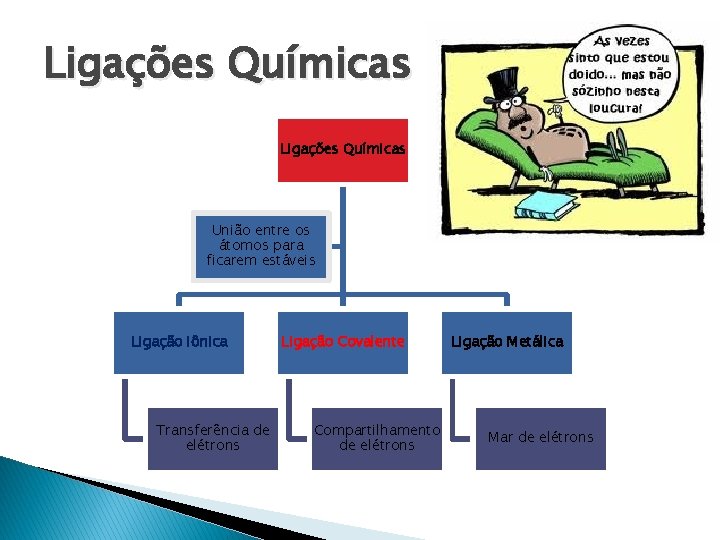
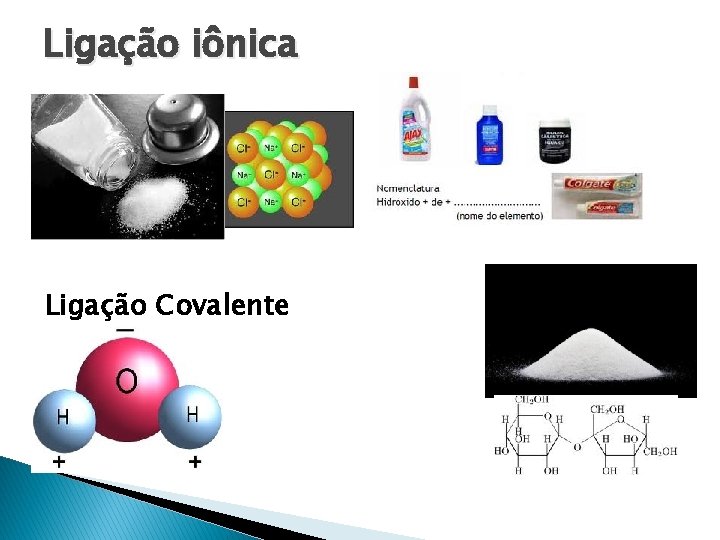
Ligações Químicas União entre os átomos para ficarem estáveis Ligação Iônica Transferência de elétrons Ligação Covalente Compartilhamento de elétrons Ligação Metálica Mar de elétrons

Ligação Iônica Metal + Ametal e Metal + Hidrogênio

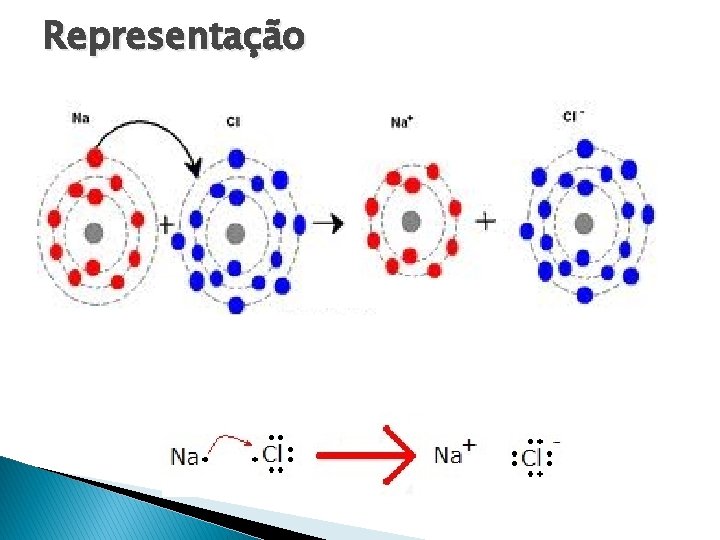
Ligação Iônica: � Transferência de elétrons de um átomo pouco eletronegativo para outro muito eletronegativo. Na (Z = 11) ― 1 s 2 2 p 6 3 s 1 Cl (Z = 17) ― 1 s 2 2 p 6 3 s 2 3 p 5 Recebe 1 e nion Cl 1 e- camada de valência Doa 1 e. Cátion Na+ 7 e- camada de valência

Representação

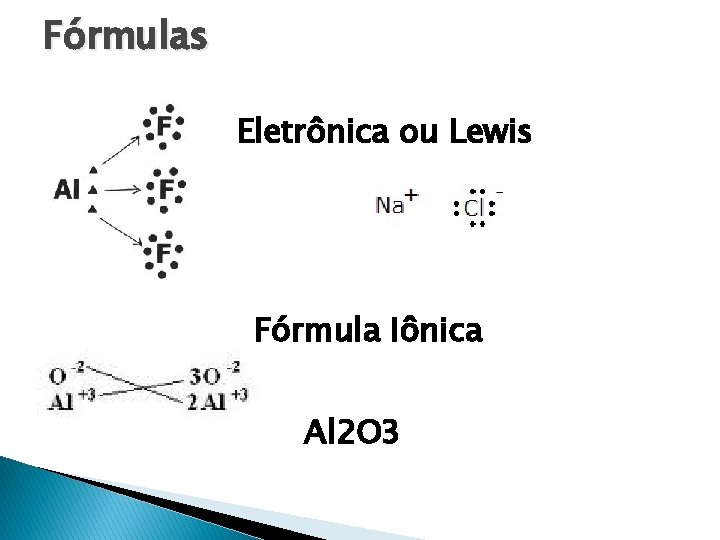
Fórmulas Eletrônica ou Lewis Fórmula Iônica Al 2 O 3

Previsão das Ligações Iônicas

Ligação Covalente Ametal +Ametal ou Ametal+ Hidrogênio

Ligação Covalente: � Os átomos de alta eletronegatividade compartilham pares de elétrons. H (Z=1) ― 1 s 1 Cl (Z = 17) ― 1 s 2 2 p 6 3 s 2 3 p 5 1 e- camada de valência Fica estável com 2 e. Ganha 1 e- 7 e- camada de valência Fica estável com 8 e. Ganha 1 e-

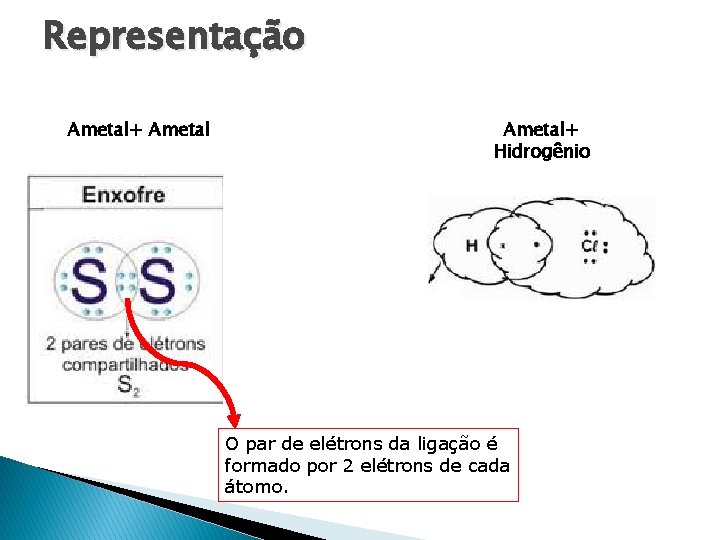
Representação Ametal+ Hidrogênio O par de elétrons da ligação é formado por 2 elétrons de cada átomo.

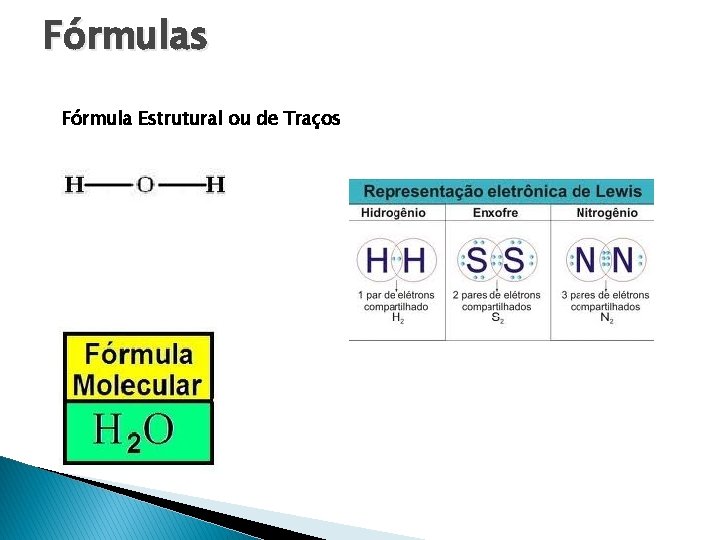
Fórmulas Fórmula Estrutural ou de Traços

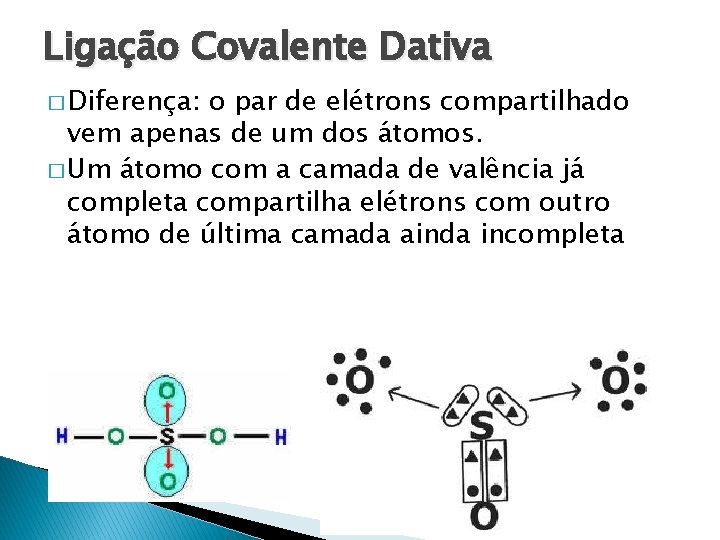
Ligação Covalente Dativa � Diferença: o par de elétrons compartilhado vem apenas de um dos átomos. � Um átomo com a camada de valência já completa compartilha elétrons com outro átomo de última camada ainda incompleta

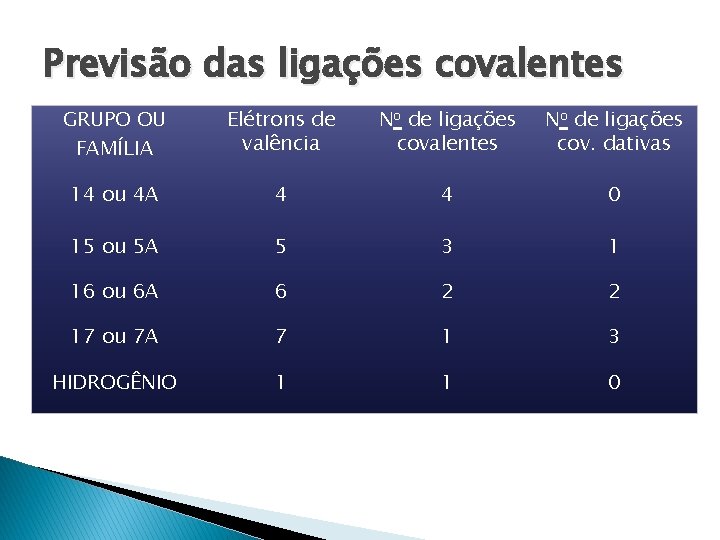
Previsão das ligações covalentes GRUPO OU FAMÍLIA Elétrons de valência No de ligações covalentes No de ligações cov. dativas 14 ou 4 A 4 4 0 15 ou 5 A 5 3 1 16 ou 6 A 6 2 2 17 ou 7 A 7 1 3 HIDROGÊNIO 1 1 0

Ligação Metálica

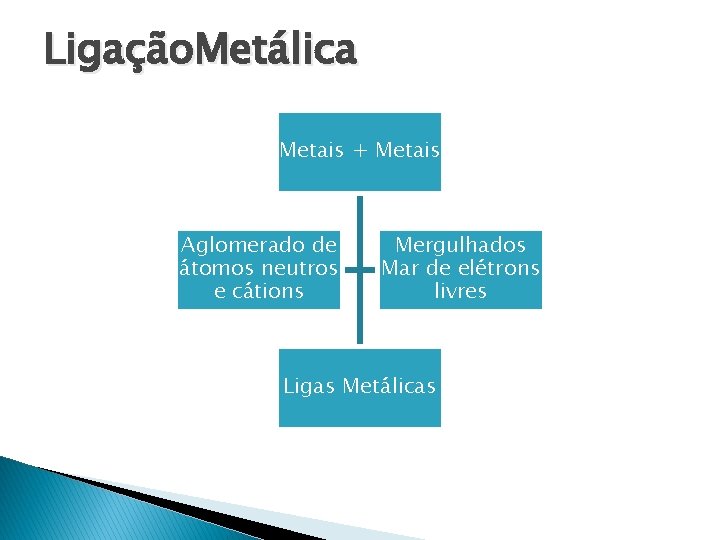
Ligação. Metálica Metais + Metais Aglomerado de átomos neutros e cátions Mergulhados Mar de elétrons livres Ligas Metálicas

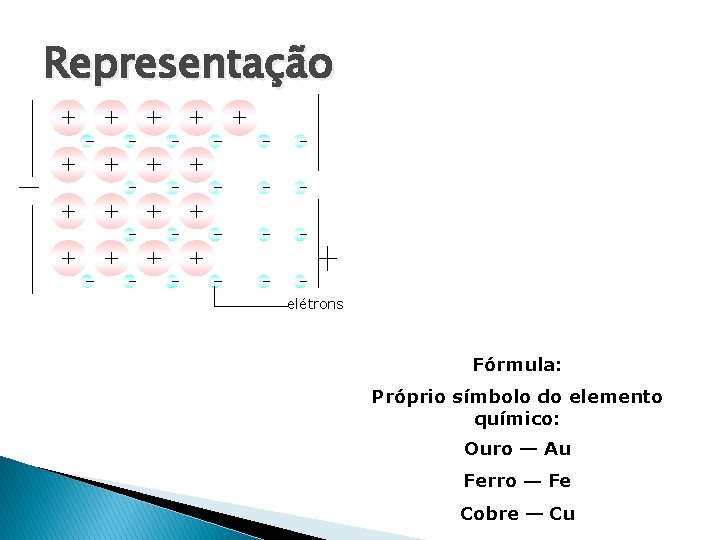
Representação elétrons Fórmula: Próprio símbolo do elemento químico: Ouro ― Au Ferro ― Fe Cobre ― Cu

Cotidiano Aço inoxidável — constituído por Fe, C, Cr e Ni Ligas Metálicas Ouro de Joias — constituído por Au (75 %), Ag e/ou Cobre (25 %) para o ouro 18 K. O ouro 24 K é ouro puro. Amálgama dental — constituída por Hg, Ag e Sn.

Ligação iônica Ligação Covalente
 Qumicas
Qumicas Reviso software
Reviso software Reviso
Reviso Karoline almeida rangel
Karoline almeida rangel Augusto benvenuto
Augusto benvenuto Nossa bandeira guilherme de almeida
Nossa bandeira guilherme de almeida Maria aparecida edificio copan
Maria aparecida edificio copan Faculdade almeida rodrigues
Faculdade almeida rodrigues Pierre d'almeida telles filho
Pierre d'almeida telles filho Denise ramos de almeida
Denise ramos de almeida Alicia de almeida
Alicia de almeida Luis almeida e sousa
Luis almeida e sousa Marco antonio garcia de almeida
Marco antonio garcia de almeida Escola estadual joelina de almeida xavier
Escola estadual joelina de almeida xavier Bíblia almeida revista e atualizada ppt
Bíblia almeida revista e atualizada ppt Thiago almeida barroso
Thiago almeida barroso Luis cupenala
Luis cupenala Almeida-pineda algorithm
Almeida-pineda algorithm Jonas almeida
Jonas almeida Fausto e almeida
Fausto e almeida Principais conceitos de marketing
Principais conceitos de marketing Conceitos solid
Conceitos solid Conceitos básicos de hidrografia
Conceitos básicos de hidrografia Conceitos ecológicos
Conceitos ecológicos Classificação de software
Classificação de software Arquitetura cliente-servidor vantagens e desvantagens
Arquitetura cliente-servidor vantagens e desvantagens