Ligaes Qumicas 9 ano Ligao Qumica A regra







![Ligação Iônica Exercícios : 3. A fórmula eletrônica de Lewis [ K ]+ [ Ligação Iônica Exercícios : 3. A fórmula eletrônica de Lewis [ K ]+ [](https://slidetodoc.com/presentation_image_h2/ced02a52d0893f4666390ce0c2275ce9/image-10.jpg)




- Slides: 17

Ligações Químicas 9° ano

Ligação Química A regra do octeto: Os átomos tendem a ganhar, perder ou compartilhar elétrons até que eles estejam rodeados por 8 elétrons na camada de valência (ou dois elétrons para o caso do hidrogênio e lítio), adquirindo a configuração de um gás nobre.

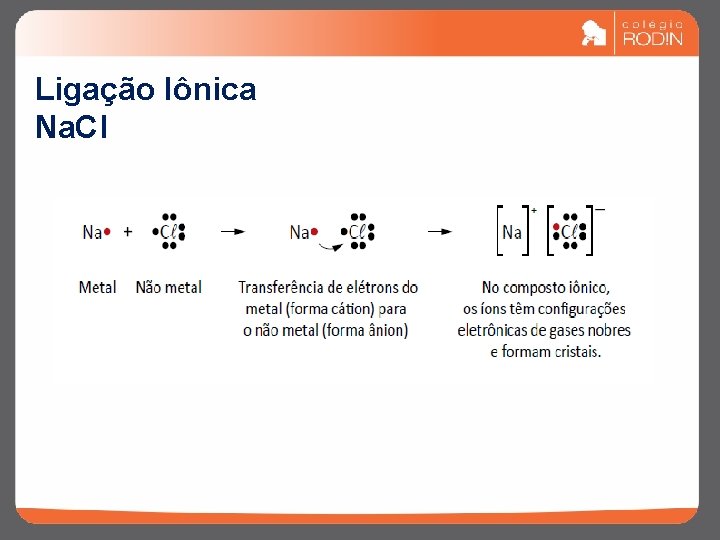
Ligação Iônica v Resulta da transferência de elétrons de um metal para um não- metal. v Os átomos são unidos por forças eletrostáticas v A representação da fórmula molecular do composto iônico se dá por:

Ligação Iônica Na. Cl

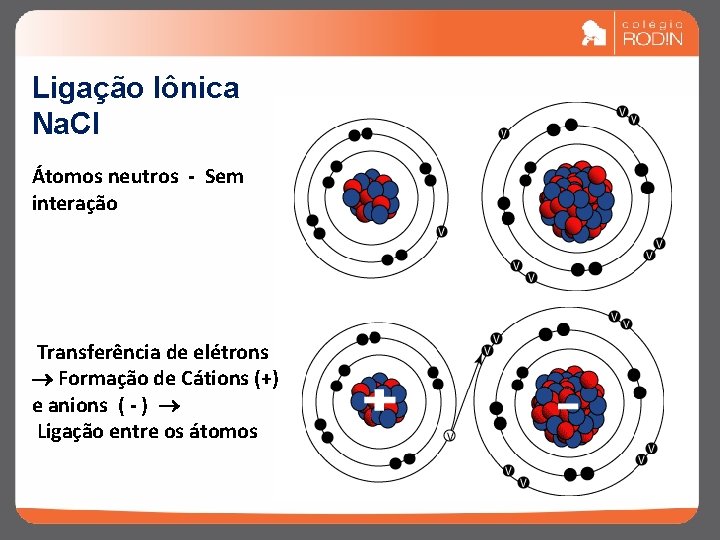
Ligação Iônica Na. Cl Átomos neutros - Sem interação Transferência de elétrons Formação de Cátions (+) e anions ( - ) Ligação entre os átomos

Ligação Iônica Na. Cl Cloro Sódio

Ligação Iônica Outros exemplos:

Ligação Iônica Outros exemplos:

Ligação Iônica Exercícios : 2. Um composto é formado pelo cátion X e pelo ânion Y, com fórmula química representada por X 2 Y 3. A respeito desse composto, assinale a alternativa correta. a. O átomo X possui 2 elétrons na camada de valência. b. O átomo Y possui 6 elétrons na camada de valência. c. O átomo Y possui 2 elétrons na camada de valência. d. O átomo X possui 6 elétrons na camada de valência. e. O composto estabiliza-se por ligação química covalente.
![Ligação Iônica Exercícios 3 A fórmula eletrônica de Lewis K Ligação Iônica Exercícios : 3. A fórmula eletrônica de Lewis [ K ]+ [](https://slidetodoc.com/presentation_image_h2/ced02a52d0893f4666390ce0c2275ce9/image-10.jpg)
Ligação Iônica Exercícios : 3. A fórmula eletrônica de Lewis [ K ]+ [ F ] representa um composto: a. molecular. b. metálico. c. iônico. d. condutor de eletricidade no estado sólido. e. com baixa temperatura de fusão.

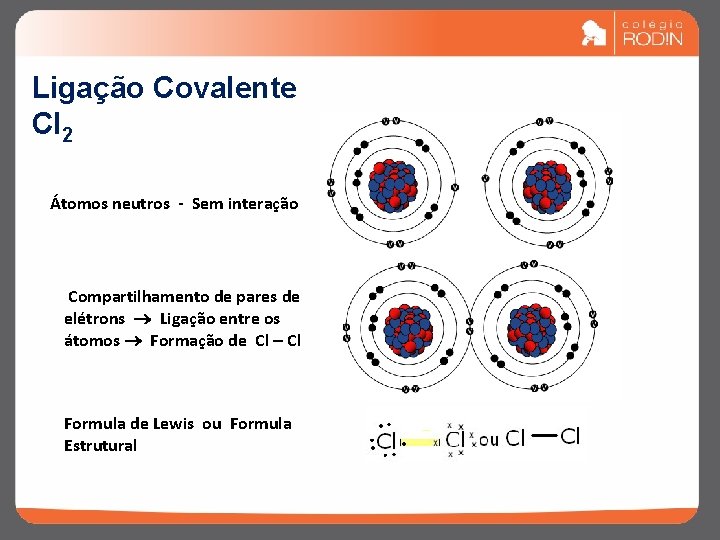
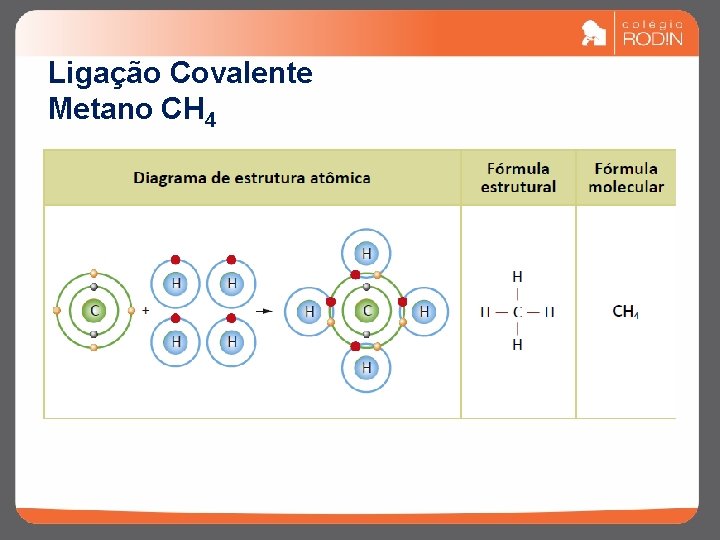
Ligação Covalente v. Resulta do compartilhamento de elétrons entre dois átomos. Ocorre entre os elementos não -metálicos (ametais) ou com o hidrogênio. v. Pode ser representada pelas fórmulas; molecular, estrutural e Lewis

Ligação Covalente Cl 2 Átomos neutros - Sem interação Compartilhamento de pares de elétrons Ligação entre os átomos Formação de Cl Formula de Lewis ou Formula Estrutural

Ligação Covalente Metano CH 4

Ligação Covalente Exercícios 03) A ligação covalente ocorre entre: a. metal e metal. b. metal e ametal. c. ametal e ametal. d. metal e gás nobre. e. ametal e gás nobre.

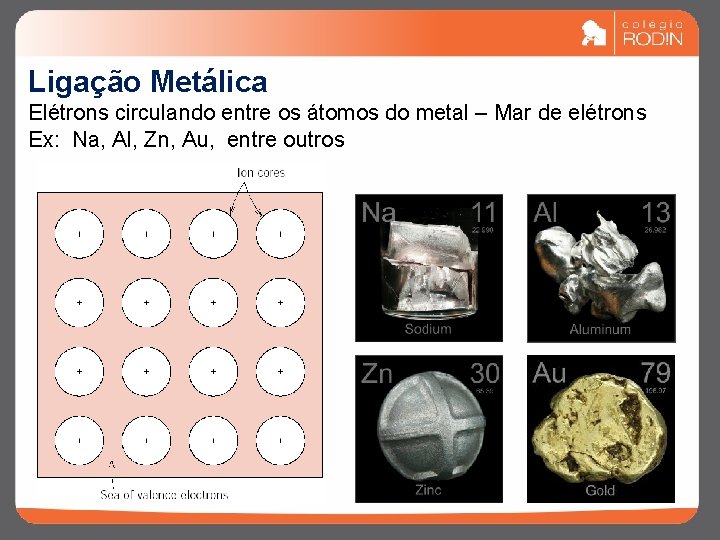
Ligação Metálica Elétrons circulando entre os átomos do metal – Mar de elétrons Ex: Na, Al, Zn, Au, entre outros

Ligação Metálica Exercícios 02) São incontáveis os elementos químicos fundamentais ao funcionamento normal do organismo. Como exemplo, podemos citar o Na (sódio) e o C�(cloro), indispensáveis ao equilíbrio iônico, o F (flúor), componente estrutural de ossos e dentes, e o Mg (magnésio), importante para o metabolismo dos açúcares e para a excitabilidade muscular. Os átomos desses elementos podem ser encontrados de diversas maneiras na natureza, combinados a diferentes átomos do mesmo elemento ou de elementos diferentes. O cloreto de sódio (Na. C�), o flúor (F 2) e o magnésio (Mg) devem apresentar, respectivamente, ligações do tipo: a. metálica, iônica e covalente. b. iônica, iônica e metálica. c. iônica, covalente e metálica. d. covalente, iônica e metálica. e. covalente, metálica e iônica.

 Ligação polar e apolar
Ligação polar e apolar Ligão ou ligam
Ligão ou ligam Qumicas
Qumicas Uri ng talumpati ayon sa paghahanda
Uri ng talumpati ayon sa paghahanda Past continuous regras
Past continuous regras Limites
Limites Papilite retal
Papilite retal Simpson
Simpson Determinante da matriz inversa
Determinante da matriz inversa Regra do tapa fisica
Regra do tapa fisica Regra do octeto
Regra do octeto Regra de octeto
Regra de octeto Regra do poligono
Regra do poligono Matriz de vandermonde
Matriz de vandermonde 9 certos segurança do paciente
9 certos segurança do paciente Regra de associação
Regra de associação Climrio
Climrio Propriedades da matriz
Propriedades da matriz