1 KM 1 1 Vo Vmax S Vmax
![1 KM 1 1 Vo= Vmax [S] + Vmax Y= m x + b 1 KM 1 1 Vo= Vmax [S] + Vmax Y= m x + b](https://slidetodoc.com/presentation_image_h2/64a3b2ddd2c33ca3f841096a9b8a0529/image-1.jpg)
![INHIBICIÓN COMPETITIVA [E]T= [E] +[EI] +[ES] I reduce [E] disponible para S Vo= Vmax INHIBICIÓN COMPETITIVA [E]T= [E] +[EI] +[ES] I reduce [E] disponible para S Vo= Vmax](https://slidetodoc.com/presentation_image_h2/64a3b2ddd2c33ca3f841096a9b8a0529/image-4.jpg)
![INHIBICIÓN COMPETITIVA: Si se alcanza Vmax, pero se requiere más [S] Se requiere más INHIBICIÓN COMPETITIVA: Si se alcanza Vmax, pero se requiere más [S] Se requiere más](https://slidetodoc.com/presentation_image_h2/64a3b2ddd2c33ca3f841096a9b8a0529/image-9.jpg)






- Slides: 24
![1 KM 1 1 Vo Vmax S Vmax Y m x b 1 KM 1 1 Vo= Vmax [S] + Vmax Y= m x + b](https://slidetodoc.com/presentation_image_h2/64a3b2ddd2c33ca3f841096a9b8a0529/image-1.jpg)
1 KM 1 1 Vo= Vmax [S] + Vmax Y= m x + b =m =b

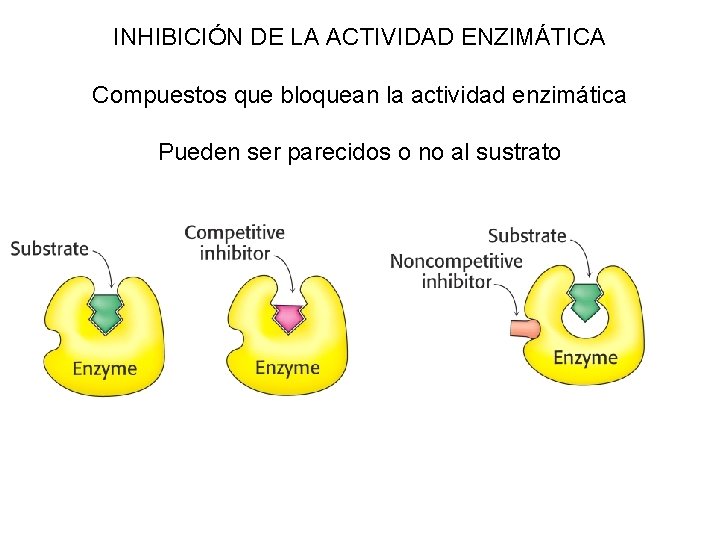
INHIBICIÓN DE LA ACTIVIDAD ENZIMÁTICA Compuestos que bloquean la actividad enzimática Pueden ser parecidos o no al sustrato

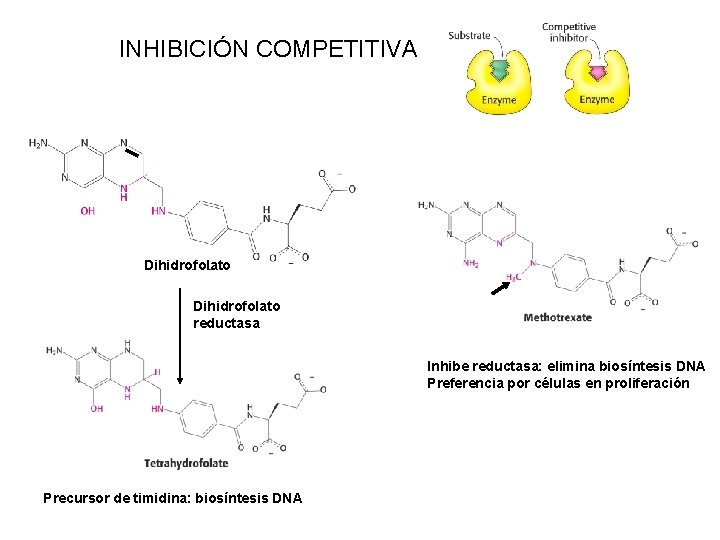
INHIBICIÓN COMPETITIVA Dihidrofolato reductasa Inhibe reductasa: elimina biosíntesis DNA Preferencia por células en proliferación Precursor de timidina: biosíntesis DNA
![INHIBICIÓN COMPETITIVA ET E EI ES I reduce E disponible para S Vo Vmax INHIBICIÓN COMPETITIVA [E]T= [E] +[EI] +[ES] I reduce [E] disponible para S Vo= Vmax](https://slidetodoc.com/presentation_image_h2/64a3b2ddd2c33ca3f841096a9b8a0529/image-4.jpg)
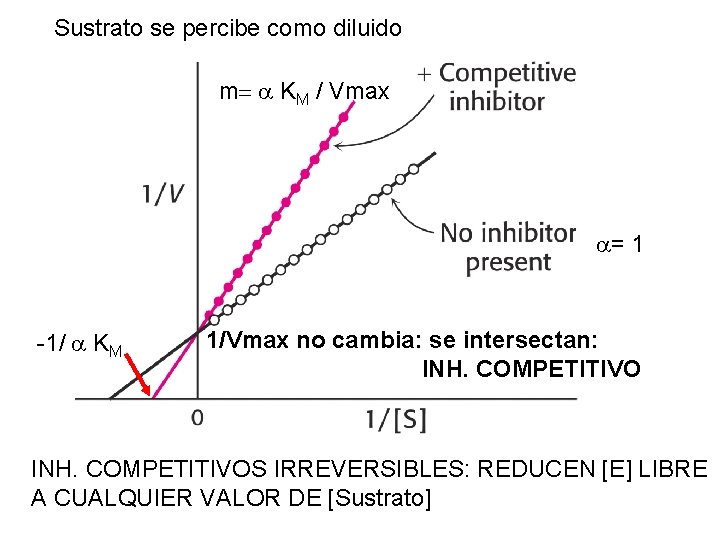
INHIBICIÓN COMPETITIVA [E]T= [E] +[EI] +[ES] I reduce [E] disponible para S Vo= Vmax [S] / a KM + [S] a = ( 1 + [I]/Ki ) m= a KM/Vmax a= 1 Incremento inhibidor 1/Vmax

Sustrato se percibe como diluido m= a KM / Vmax a= 1 -1/ a KM 1/Vmax no cambia: se intersectan: INH. COMPETITIVOS IRREVERSIBLES: REDUCEN [E] LIBRE A CUALQUIER VALOR DE [Sustrato]

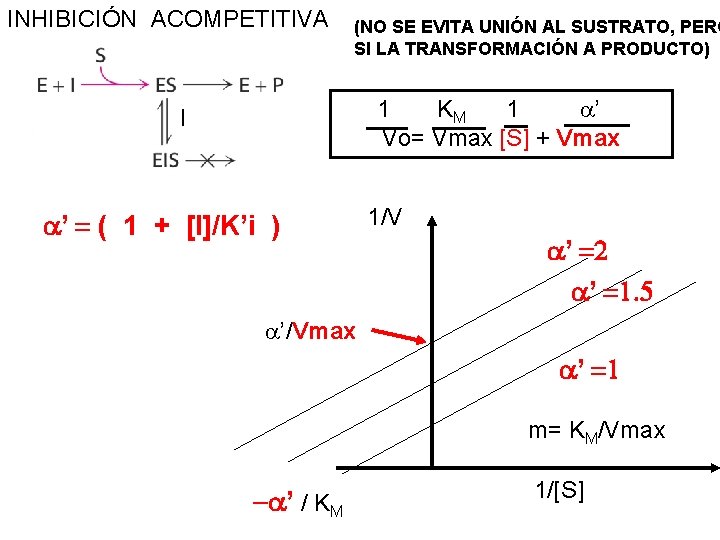
INHIBICIÓN ACOMPETITIVA (NO SE EVITA UNIÓN AL SUSTRATO, PERO SI LA TRANSFORMACIÓN A PRODUCTO) 1 KM 1 a’ Vo= Vmax [S] + Vmax I a’ = ( 1 + [I]/K’i ) 1/V a’ =2 a’ =1. 5 a’/Vmax a’ =1 m= KM/Vmax -a’ / KM 1/[S]

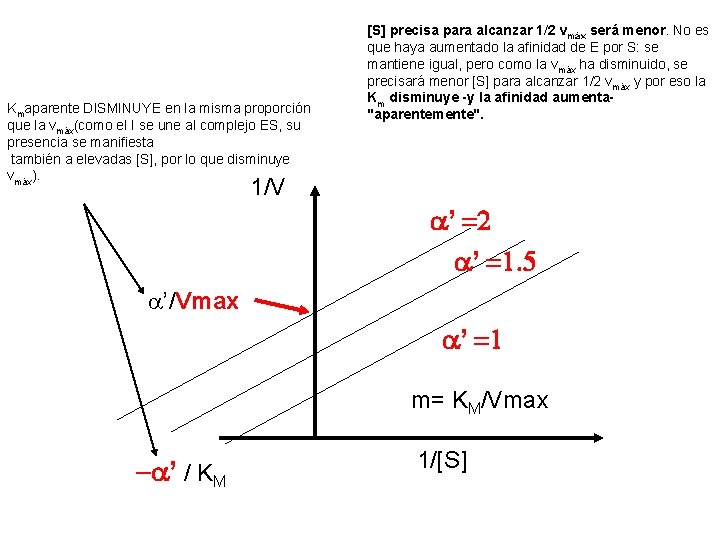
Kmaparente DISMINUYE en la misma proporción que la vmáx(como el I se une al complejo ES, su presencia se manifiesta también a elevadas [S], por lo que disminuye vmáx). [S] precisa para alcanzar 1/2 vmáx será menor. No es que haya aumentado la afinidad de E por S: se mantiene igual, pero como la vmáx ha disminuido, se precisará menor [S] para alcanzar 1/2 vmáx y por eso la Km disminuye -y la afinidad aumenta"aparentemente". 1/V a’ =2 a’ =1. 5 a’/Vmax a’ =1 m= KM/Vmax -a’ / KM 1/[S]

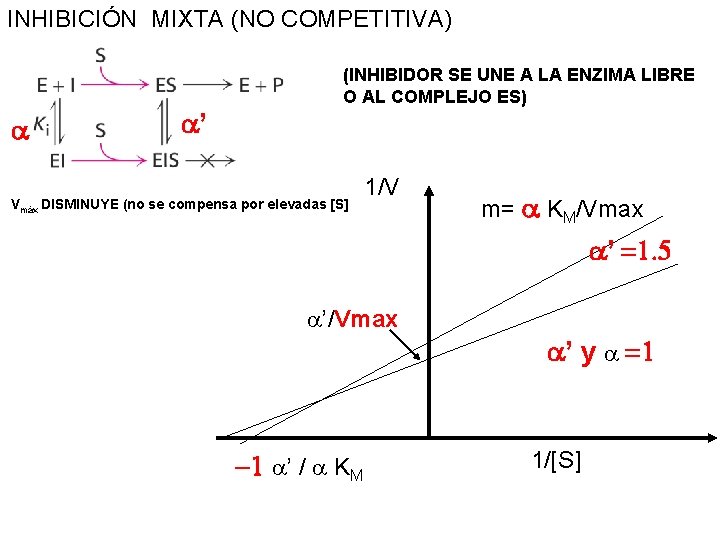
INHIBICIÓN MIXTA (NO COMPETITIVA) a a’ (INHIBIDOR SE UNE A LA ENZIMA LIBRE O AL COMPLEJO ES) Vmáx DISMINUYE (no se compensa por elevadas [S] 1/V m= a KM/Vmax a’ =1. 5 a’/Vmax a’ y a =1 -1 a’ / a KM 1/[S]
![INHIBICIÓN COMPETITIVA Si se alcanza Vmax pero se requiere más S Se requiere más INHIBICIÓN COMPETITIVA: Si se alcanza Vmax, pero se requiere más [S] Se requiere más](https://slidetodoc.com/presentation_image_h2/64a3b2ddd2c33ca3f841096a9b8a0529/image-9.jpg)
INHIBICIÓN COMPETITIVA: Si se alcanza Vmax, pero se requiere más [S] Se requiere más [S] para Vmax/2 KM es mayor (a. KM) INHIBICIÓN ACOMPETITIVA : La Velocidad se reduce para cualquier [S] Vmax y Vmax/2 se reducen KM cambia INHIBICIÓN MIXTA (NO COMPETITIVA): Disminuye Vmax y Vmax/2 KM DISMINUYE APARENTEMENTE

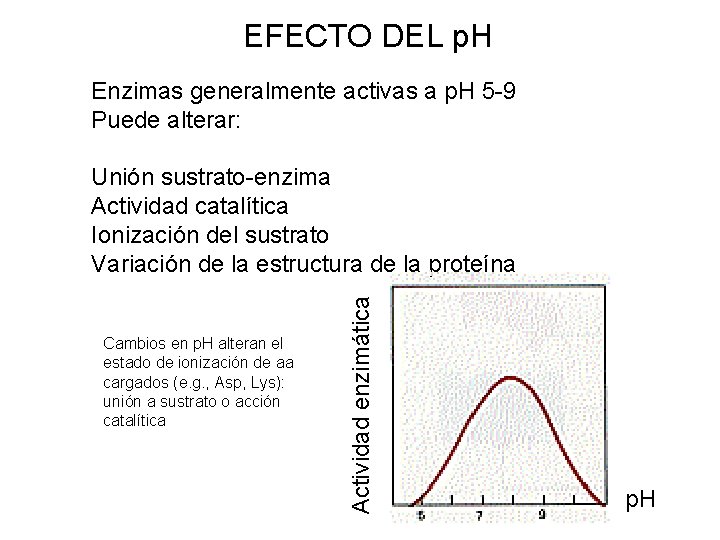
EFECTO DEL p. H Enzimas generalmente activas a p. H 5 -9 Puede alterar: Cambios en p. H alteran el estado de ionización de aa cargados (e. g. , Asp, Lys): unión a sustrato o acción catalítica Actividad enzimática Unión sustrato-enzima Actividad catalítica Ionización del sustrato Variación de la estructura de la proteína p. H

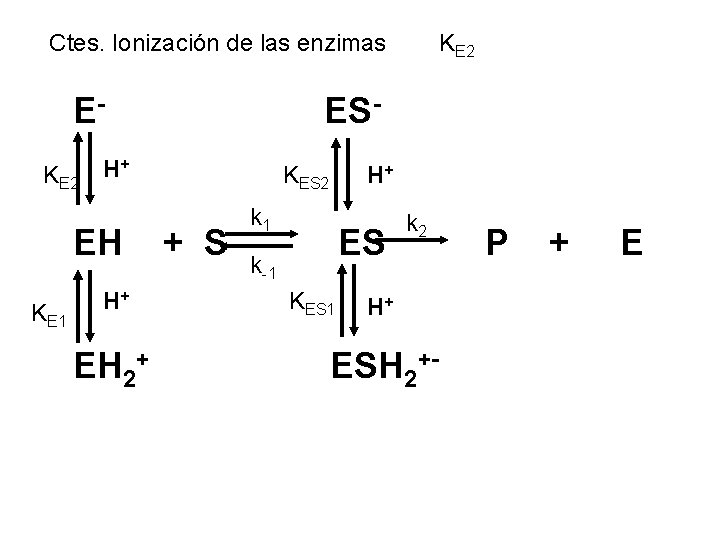
Ctes. Ionización de las enzimas EKE 2 KE 1 ES- H+ EH 2+ KE 2 KES 2 + S H+ k 1 ES k-1 KES 1 k 2 H+ ESH 2+- P + E

p. K’s ´de aminoácidos esenciales para la actividad Aa ionizables en sitios activos como Aspartato Glutamato Histidina Lisina p. K 4 p. K 6 -10 Recordar que: Las interacciones entre grupos cargados cercanos Y/o con regiones de baja polaridad: Cambian p. K´s

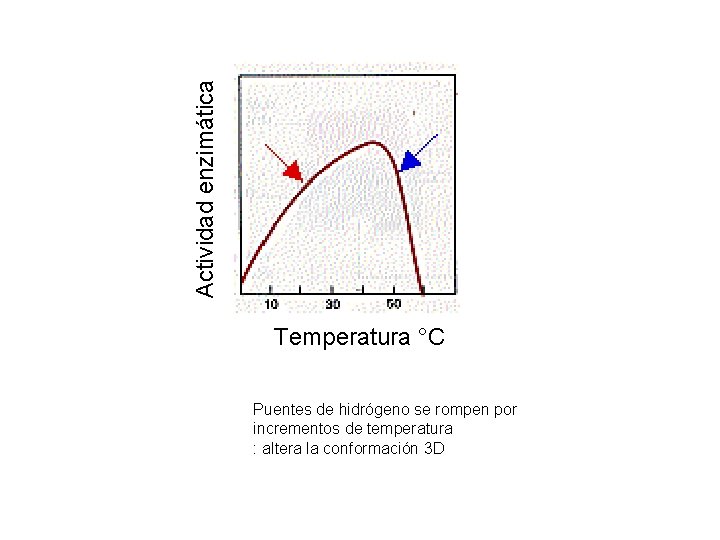
Actividad enzimática Temperatura °C Puentes de hidrógeno se rompen por incrementos de temperatura : altera la conformación 3 D

REGULACIÓN DE LA ACTIVIDAD ENZIMÁTICA Actividad eficiente y bien coordinada: 1) CONTROL DE LA DISPONIBILIDAD DE LA ENZIMA SÍNTESIS Y DEGRADACIÓN DE LA ENZIMA 2) CONTROL DE LA ACTIVIDAD ENZIMÁTICA CAMBIOS ESTRUCTURALES

2) CONTROL DE LA ACTIVIDAD ENZIMÁTICA: CAMBIOS ESTRUCTURALES Anclaje a membranas Precursores inactivos: proteasas: pepsinógeno/ pepsina: hidrólisis de porción inhibitoria por p. H ALOSTERISMO MODIFICACIÓN COVALENTE

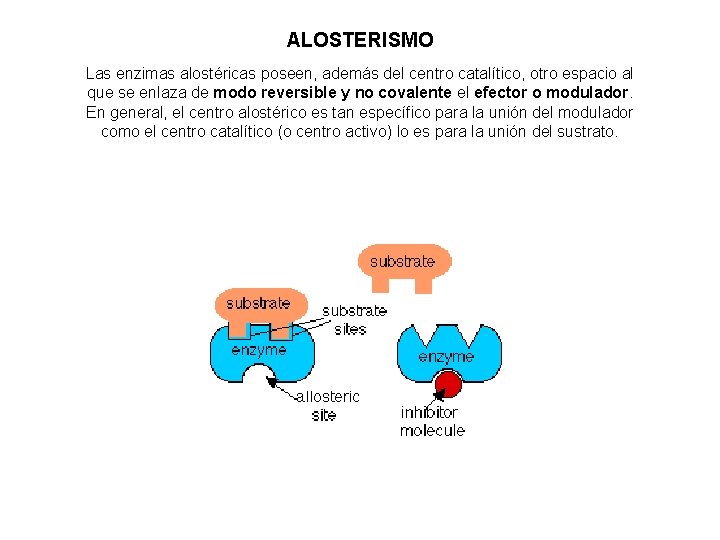
ALOSTERISMO Las enzimas alostéricas poseen, además del centro catalítico, otro espacio al que se enlaza de modo reversible y no covalente el efector o modulador. En general, el centro alostérico es tan específico para la unión del modulador como el centro catalítico (o centro activo) lo es para la unión del sustrato.

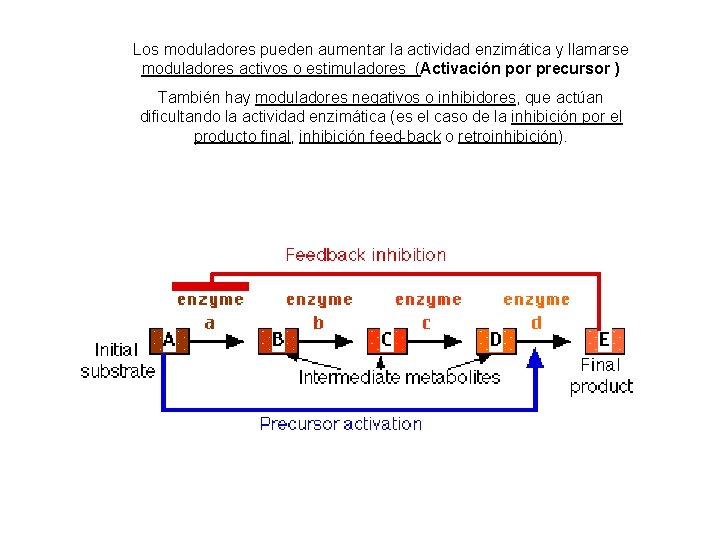
Los moduladores pueden aumentar la actividad enzimática y llamarse moduladores activos o estimuladores (Activación por precursor ) También hay moduladores negativos o inhibidores, que actúan dificultando la actividad enzimática (es el caso de la inhibición por el producto final, inhibición feed-back o retroinhibición).

Cooperatividad Las enzimas alostéricas no muestran generalmente la clásica relación cinética de Michaelis-Menten entre [S], vmáx y Km. Muchas presentan una gráfica sigmoidea en vez de hiperbólica cuando se representa la velocidad en función de la [S]. Esto es un ejemplo de cooperatividad positiva (la unión de una molécula de sustrato a un centro incrementa la unión de las moléculas de sustrato a los demás centros). No todas las enzimas alostéricas exhiben curvas sigmoidales al representar v 0 frente a [S]; además, no todas las enzimas que muestran tales curvas son necesariamente alostéricas. Otras enzimas presentan cooperatividad negativa: la unión de una molécula de sustrato provoca un descenso en la unión de moléculas de sustrato subsiguientes

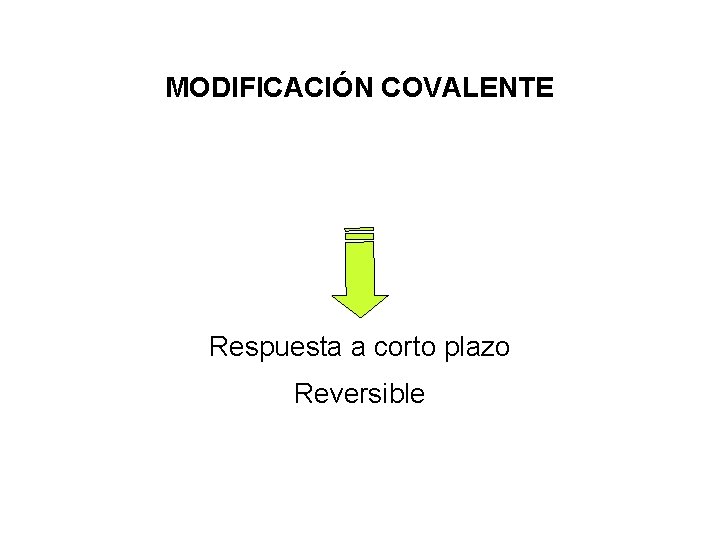
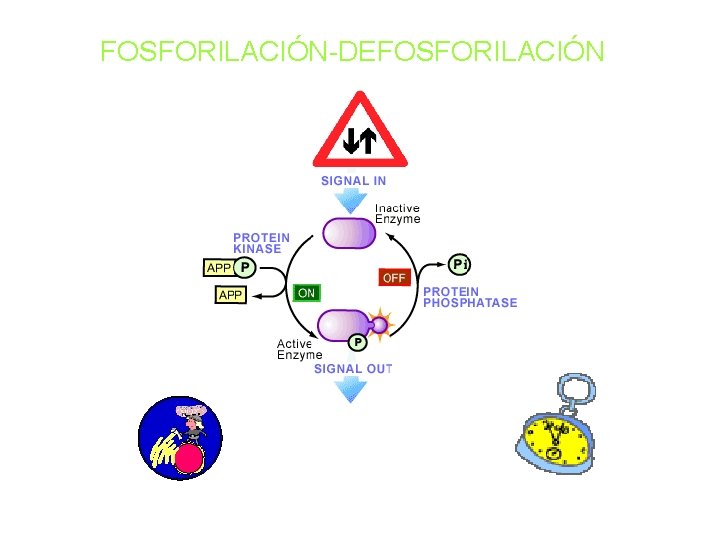
MODIFICACIÓN COVALENTE Respuesta a corto plazo Reversible

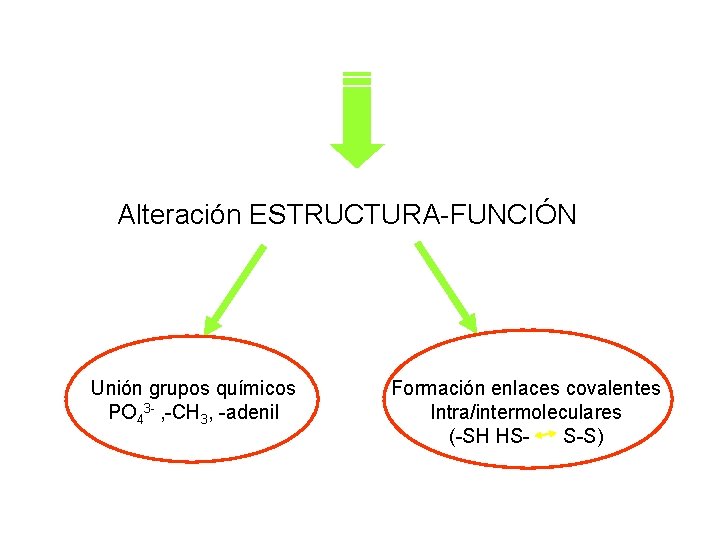
Alteración ESTRUCTURA-FUNCIÓN Unión grupos químicos PO 43 - , -CH 3, -adenil Formación enlaces covalentes Intra/intermoleculares (-SH HSS-S)

FOSFORILACIÓN-DEFOSFORILACIÓN

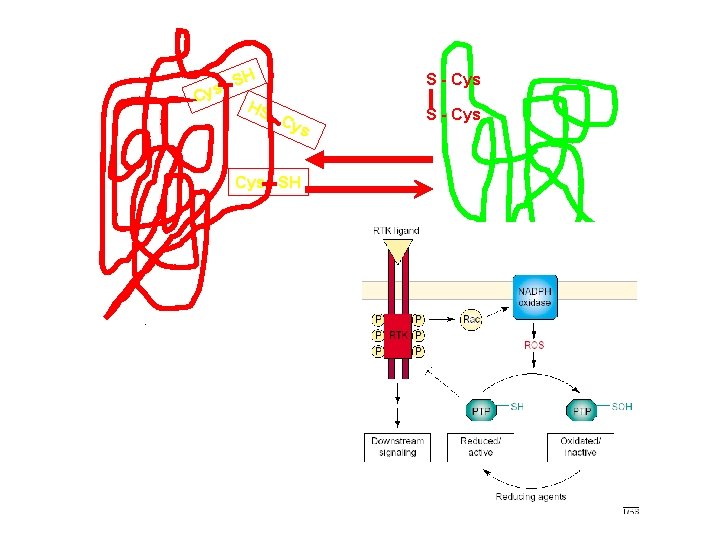
Cys SH HS S - Cys Cys SH . S - Cys

