Parte III 6 Enzimas 1 Definicin Vmax y





![[ET] = [E] + [ES] n la concentración total de enzima depende de la [ET] = [E] + [ES] n la concentración total de enzima depende de la](https://slidetodoc.com/presentation_image_h2/78bae1779e75c17d2b96249a047b1ed1/image-7.jpg)

![Despejando [ES], queda que: n siendo Despejando [ES], queda que: n siendo](https://slidetodoc.com/presentation_image_h2/78bae1779e75c17d2b96249a047b1ed1/image-10.jpg)











- Slides: 29

Parte III. 6. Enzimas 1. Definición Vmax y Km 2. Modelo del estado estacionario 3. Condiciones óptimas de reacción 4. Curvas temporales 5. La práctica Unidades para reportar en la purificación

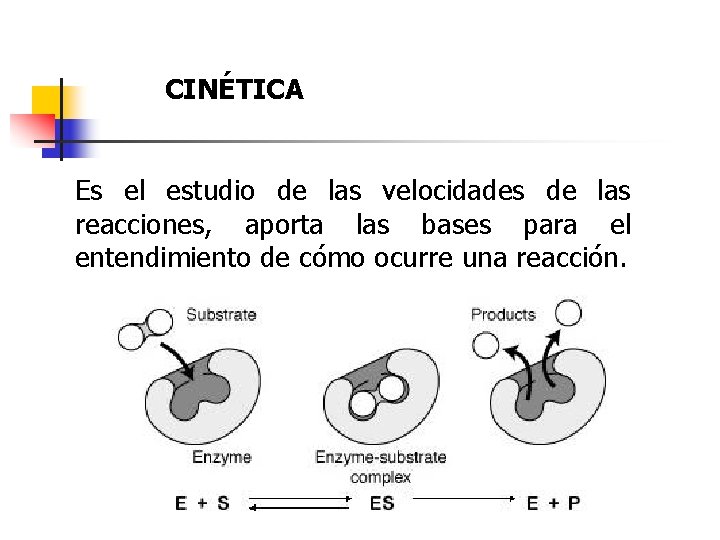
CINÉTICA Es el estudio de las velocidades de las reacciones, aporta las bases para el entendimiento de cómo ocurre una reacción.

Mecanismo de la reacción n La descripción de una reacción en términos de las etapas implicadas y la velocidad de la reacción se denomina mecanismo de la reacción. ¿Cuántas etapas están implicadas? ¿Cuál es la etapa más lenta y que, por tanto, limitaría la velocidad de la reacción total?

La primera clave en cuanto al comportamiento enzimático lo aportaron: V. Henri (1903) y posteriormente L. Michaelis y Maud L. Menten (1913).

n n n Para explicar la relación observada entre la velocidad inicial (v 0) y la concentración inicial de sustrato ([S]0) Michaelis y Menten propusieron que las reacciones catalizadas enzimáticamente ocurren en dos etapas: En la primera etapa se forma el complejo enzimasustrato y En la segunda, el complejo enzima-sustrato da lugar a la formación del producto, liberando el enzima libre

Kcat n n En este esquema, k 1, k 2 y k 3 son las constantes cinéticas individuales de cada proceso y también reciben el nombre de constantes microscópicas de velocidad. Según esto, podemos afirmar que: n n n v 1 = k 1 [E] [S] v 2 = k 2 [ES] v 3 = k 3 [ES]
![ET E ES n la concentración total de enzima depende de la [ET] = [E] + [ES] n la concentración total de enzima depende de la](https://slidetodoc.com/presentation_image_h2/78bae1779e75c17d2b96249a047b1ed1/image-7.jpg)
[ET] = [E] + [ES] n la concentración total de enzima depende de la cantidad de enzima libre (E) y de la enzima unida al sustrato (ES). [ET] es constante a lo largo de la reacción Como [E] = [ET] - [ES] y sabemos que v 1 = k 1 [E] [S] n resulta que: v 1= k 1[S]([ET] - [ES]) n entonces v = k [S] [E ] - k [S] [ES] n

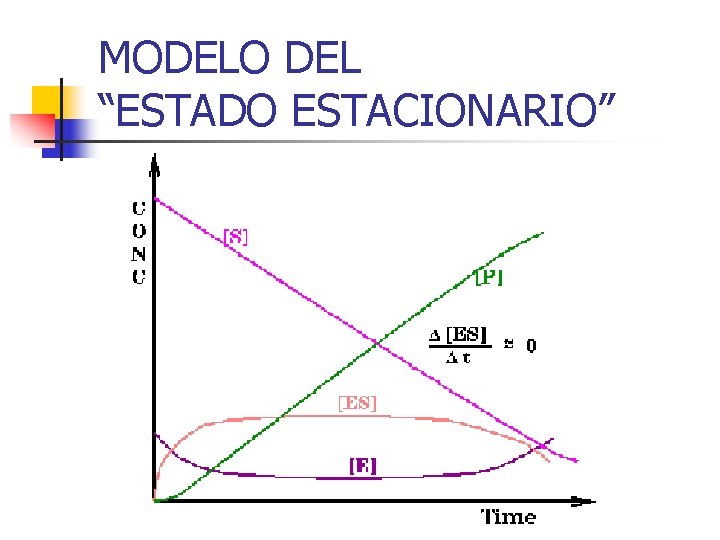
MODELO DEL “ESTADO ESTACIONARIO”

n Por tanto, la velocidad de formación del complejo enzima-sustrato (v 1) es igual a la de su disociación (v 2+ v 3) v 1 = v 2 + v 3 k 1[S] [ET] - k 1 [S] [ES] = k 2 [ES] + k 3 [ES] Todo está en términos de [ES]
![Despejando ES queda que n siendo Despejando [ES], queda que: n siendo](https://slidetodoc.com/presentation_image_h2/78bae1779e75c17d2b96249a047b1ed1/image-10.jpg)
Despejando [ES], queda que: n siendo

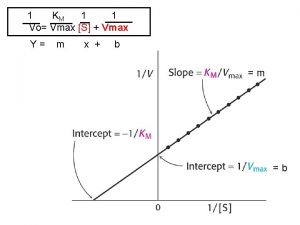
n En el estado estacionario, la velocidad de formación del producto es: n v = v 3 = k 3 [ES] = n Si K 3[ET]= Vmax n Entonces v=Vmax*[s] Km + [s] Ec. de Michaelis

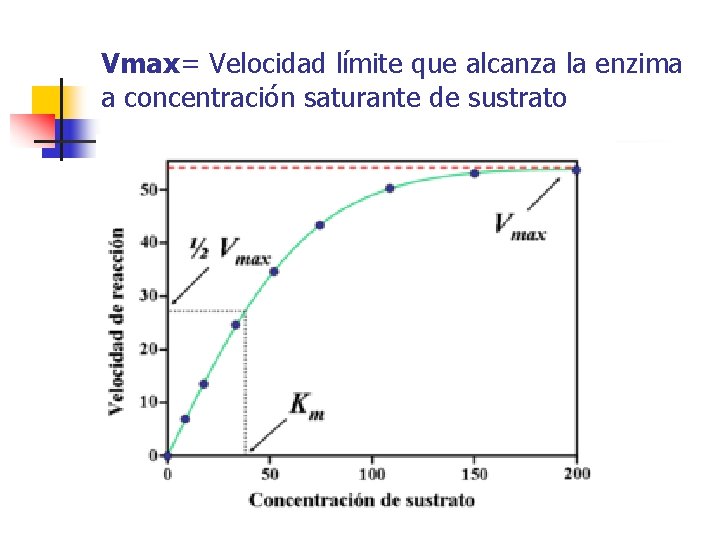
Vmax= Velocidad límite que alcanza la enzima a concentración saturante de sustrato

Definición Km n Es la concentración de sustrato a la cual se alcanza la mitad de la velocidad máxima. En efecto, si KM = [S], la ecuación de Michaelis-Menten se reduce a: v=Vmax*[s] v = Vmax*[s] v= [s] * Vmax v=Vmax Km + [s]+[s] 2 n

Km y afinidad? n El valor de KM da idea de la afinidad del enzima por el sustrato: A menor Km, mayor afinidad del enzima por el sustrato, y a mayor Km, menor afinidad. n n n KM se define como (k 2+k 3/k 1), donde las reacciones 2 y 3 destruyen el complejo ES, mientras que la reacción 1 lo forma. Así, si KM es grande, el complejo ES es inestable pues predomina la tendencia a destruirlo (poca afinidad hacia el sustrato), y si KM es pequeña, el complejo ES es estable, ya que predomina la tendencia a formarlo (gran afinidad hacia el sustrato).

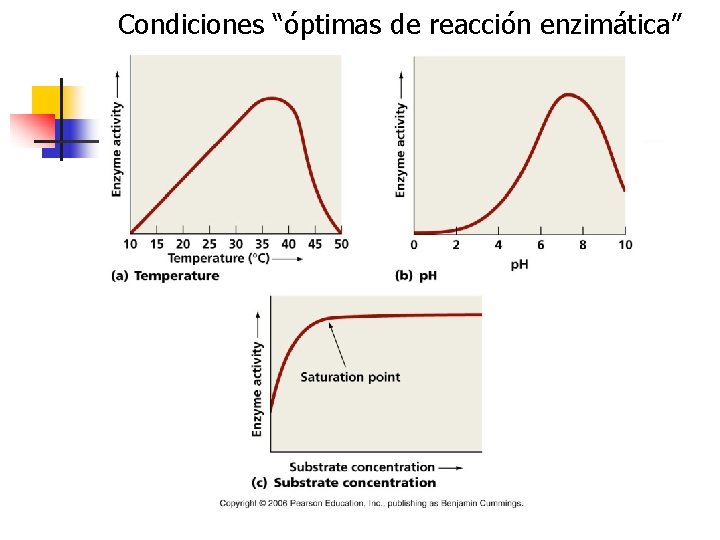
Qué se necesita para medir la velocidad de reacción enzimática? n n Extracto proteico que muchos casos no proviene de una purificación exhaustiva o del aislamiento de la enzima. La medida se realiza siempre en las “condiciones óptimas” de p. H, temperatura, presencia de cofactores, etc, y se utilizan concentraciones saturantes de sustrato.

Vmax n n En condiciones “óptimas” y saturantes de la enzima, la velocidad de reacción observada es la velocidad máxima (Vmax). La velocidad puede determinarse bien midiendo la aparición de los productos o la desaparición de los reactivos.

Condiciones “óptimas de reacción enzimática”

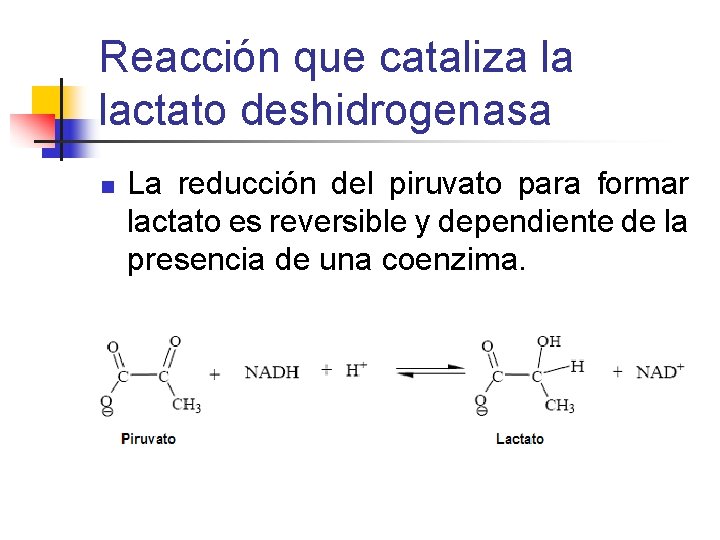
Reacción que cataliza la lactato deshidrogenasa n La reducción del piruvato para formar lactato es reversible y dependiente de la presencia de una coenzima.

Desarrollo experimental n n 1 M Amortiguador de fosfatos p. H 7. 0 10 m. M Piruvato de sodio 4 m. M NADH Diluciones apropiadas de enzima.

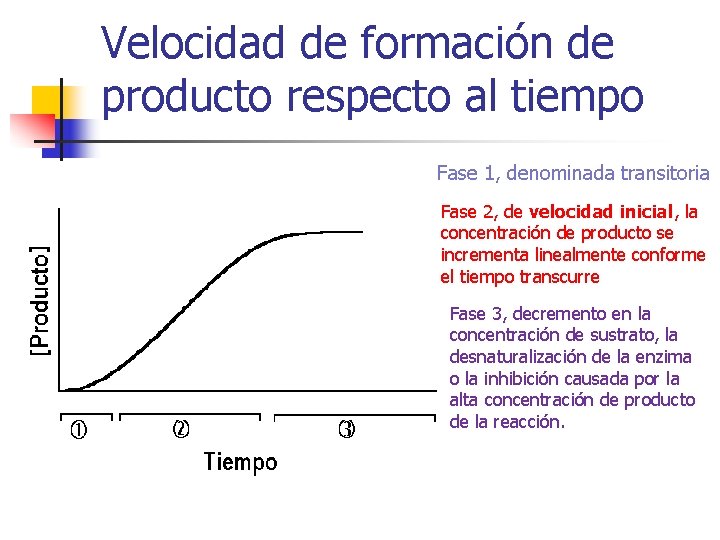
Velocidad de formación de producto respecto al tiempo Fase 1, denominada transitoria Fase 2, de velocidad inicial, la concentración de producto se incrementa linealmente conforme el tiempo transcurre Fase 3, decremento en la concentración de sustrato, la desnaturalización de la enzima o la inhibición causada por la alta concentración de producto de la reacción.

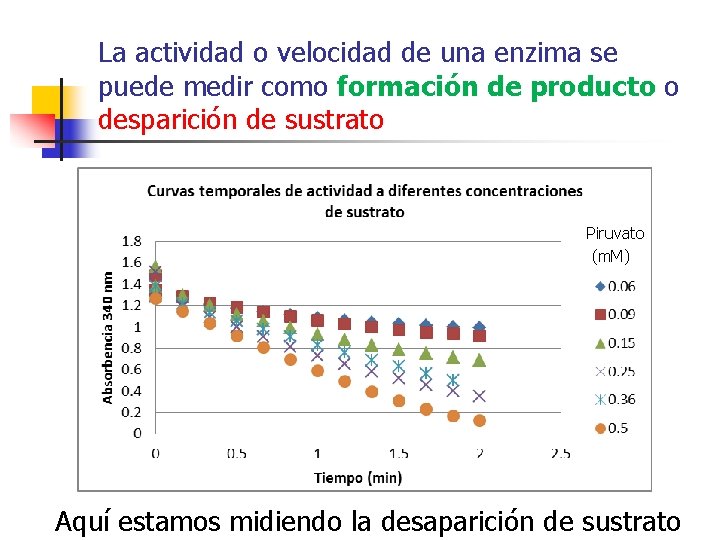
La actividad o velocidad de una enzima se puede medir como formación de producto o desparición de sustrato Piruvato (m. M) Aquí estamos midiendo la desaparición de sustrato

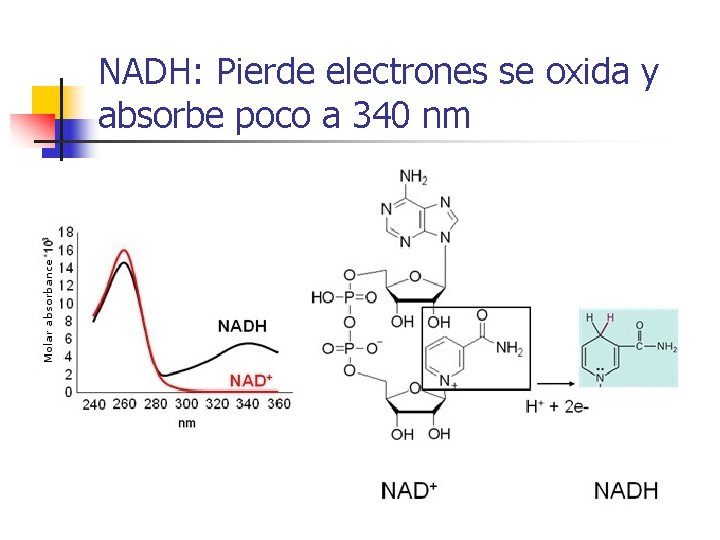
NADH: Pierde electrones se oxida y absorbe poco a 340 nm

La actividad de una enzima tiene unidades de velocidad. m: es la pendiente de la recta ( Abs/ t) en unidades de abs / min : es el coeficiente de extinción molecular para el NADH, 6. 22 x 103 M-1 cm-1. b: es la distancia de la celda, que corresponde a 1 cm Volensayo: es el volumen total del ensayo. F: el factor de dilución Volenzima: el volumen añadido de enzima a la reacción

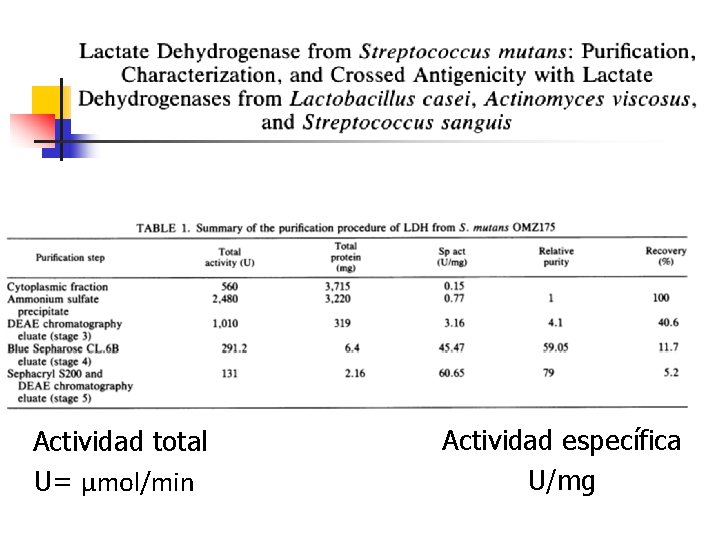
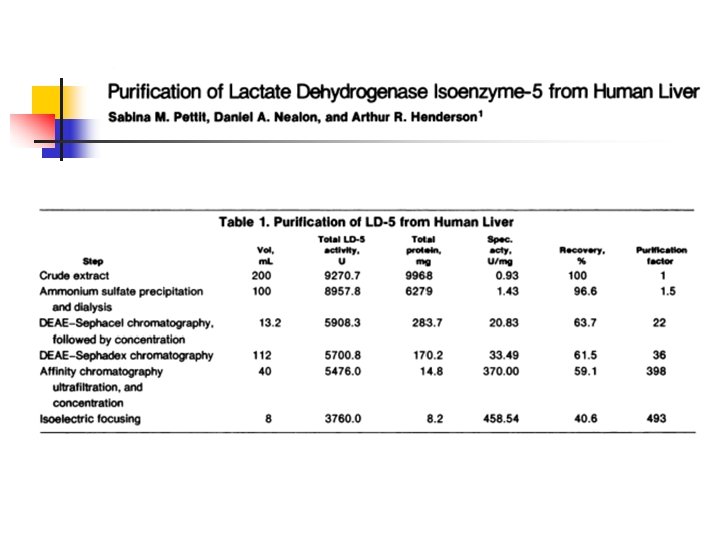
Tabla de purificación de proteínas

Actividad específica n n Las unidades son mmol min-1 mg-1 entonces dividir la actividad total dada en mmol min-1 entre la cantidad de proteína total de la fracción (mg). Otras unidades usadas son las unidades internacionales U que son (µmoles/min)

Grado de pureza también llamado veces de purificación n n El valor se obtiene al dividir la actividad enzimática específica de cualquier fracción entre la actividad específica de la fracción inicial en este caso la F 1. Se espera que conforme se pierdan proteínas contaminantes el grado de pureza se vaya incrementando.

Rendimiento o yield n n la actividad total recuperada en la fracción inicial es el 100%, cuanto es en cada paso de purificación Unidades de porcentaje

Actividad total U= µmol/min Actividad específica U/mg

 Definicin
Definicin Definicin
Definicin Definicin
Definicin Definiciomn
Definiciomn Que son los monemas
Que son los monemas Aprendida
Aprendida Imagenes
Imagenes Suponga que se tiene que medir la longitud de un puente
Suponga que se tiene que medir la longitud de un puente Sexo definicin
Sexo definicin Definicin de cultura
Definicin de cultura Definicin de estado
Definicin de estado El amor quevedo
El amor quevedo Hamlet act iii scene iii
Hamlet act iii scene iii Partes da eucaristia
Partes da eucaristia Este parte aquele parte
Este parte aquele parte Te invitamos a ser parte o hacer parte
Te invitamos a ser parte o hacer parte Como se leen las fracciones del 1 al 20
Como se leen las fracciones del 1 al 20 Km in enzyme kinetics
Km in enzyme kinetics Vmax mmcs
Vmax mmcs Vmax xlimax
Vmax xlimax Emc symmetrix vmax
Emc symmetrix vmax Vmax equation
Vmax equation Holoenzima apoenzima y cofactor
Holoenzima apoenzima y cofactor Inhibidor incompetitivo
Inhibidor incompetitivo Steady state biochemistry
Steady state biochemistry Vmax sin wt
Vmax sin wt Vmax xlimax
Vmax xlimax Vmax= k2et
Vmax= k2et Vmax and km
Vmax and km Abb vmax vacuum circuit breaker
Abb vmax vacuum circuit breaker