Fatores que controlam a atividade enzimtica 3 Concentrao


![A velocidade da reação somente é proporcional à [E] quando a enzima está saturada, A velocidade da reação somente é proporcional à [E] quando a enzima está saturada,](https://slidetodoc.com/presentation_image_h2/559d104e4ff8702f52a4a0f47da5cc47/image-10.jpg)

![û Gráfico de Eadie-Hofstee Vmax v Inclinação = -Km Vmax Km v [S] û Gráfico de Eadie-Hofstee Vmax v Inclinação = -Km Vmax Km v [S]](https://slidetodoc.com/presentation_image_h2/559d104e4ff8702f52a4a0f47da5cc47/image-14.jpg)
![û Gráfico de Hanes-Woolf [S] v Inclinação = 1 Vmax Km Vmax -Km [S] û Gráfico de Hanes-Woolf [S] v Inclinação = 1 Vmax Km Vmax -Km [S]](https://slidetodoc.com/presentation_image_h2/559d104e4ff8702f52a4a0f47da5cc47/image-15.jpg)

- Slides: 18

Fatores que controlam a atividade enzimática: 3. Concentração: • da enzima • do substrato • de co-fatore(s) A [substrato] cai na mesma razão em que a [produto] aumenta em função do tempo. A enzima existe sob duas formas: enzima livre E e complexo enzima-substrato ES. No início da reação, a [E] livre cai e a do complexo [ES] aumenta e atinge um máximo, em que não há mais [E] livre no meio. Nessa situação (indicada no retângulo cinza), diz-se que a enzima está saturada (só existe no complexo ES). A velocidade da reação é a máxima. O gráfico abaixo ilustra como as concentrações de E, S e P variam ao longo do tempo da reação. concentração 2. Tempo da reação tempo

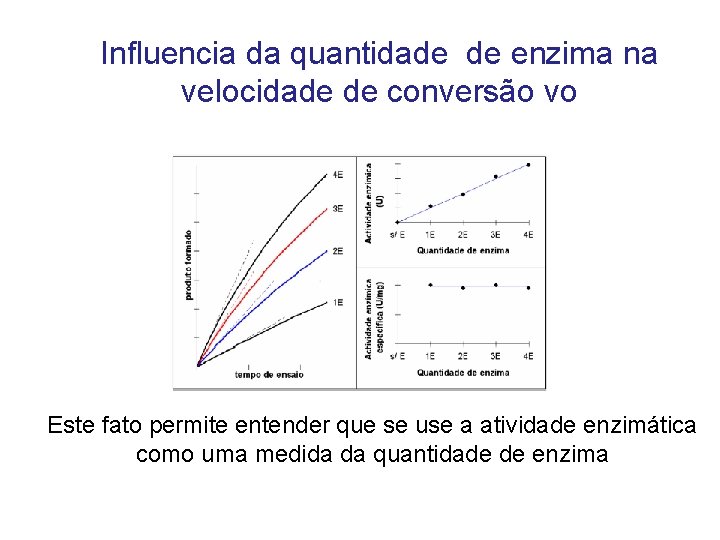
Influencia da quantidade de enzima na velocidade de conversão vo Este fato permite entender que se use a atividade enzimática como uma medida da quantidade de enzima

Modelos empíricos para correlacionar a hidrólise enzimática com o tempo de reação Com os dados de rendimento de hidrolise para cada carga de enzima e tempo pode-se fazer a modelagem -Há uma relaçao logaritmica linear entre o rendimento de hidrolise e o tempo? - Há uma relaçao logaritmica linear entre o rendimento de hidrolise e a carga de enzima? -Há uma relaçao logaritmica linear entre a variação do rendimento de hidrolise (coeficiente angular ) e o tempo?

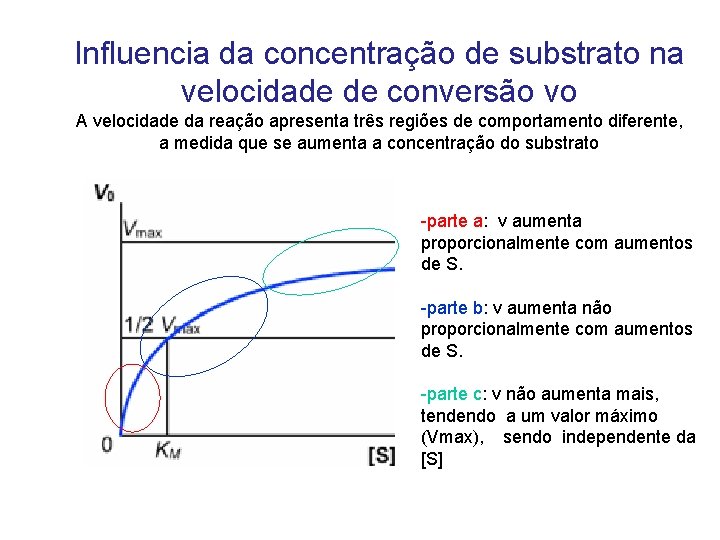
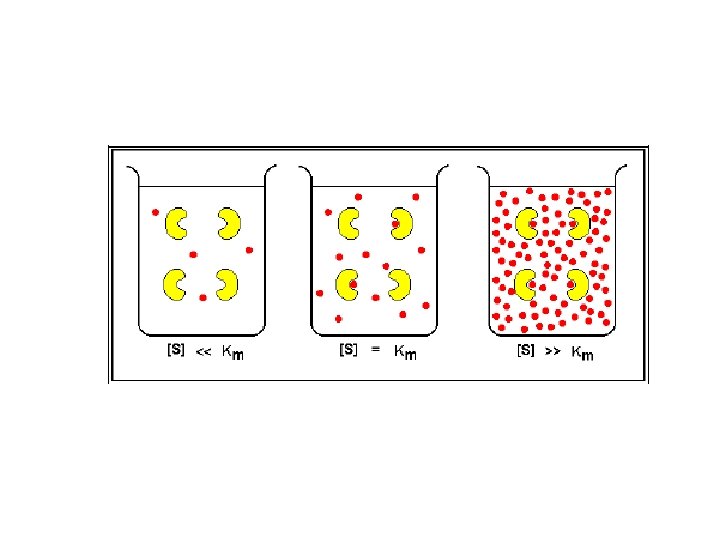
Influencia da concentração de substrato na velocidade de conversão vo A velocidade da reação apresenta três regiões de comportamento diferente, a medida que se aumenta a concentração do substrato -parte a: v aumenta proporcionalmente com aumentos de S. -parte b: v aumenta não proporcionalmente com aumentos de S. -parte c: v não aumenta mais, tendendo a um valor máximo (Vmax), sendo independente da [S]

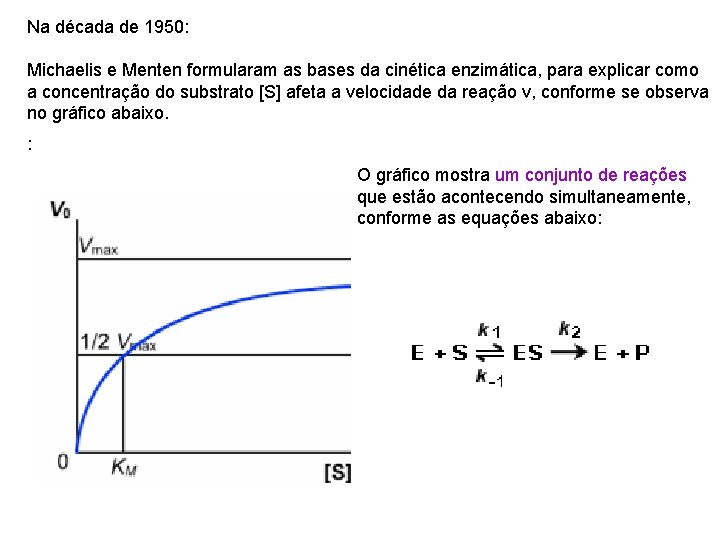
Na década de 1950: Michaelis e Menten formularam as bases da cinética enzimática, para explicar como a concentração do substrato [S] afeta a velocidade da reação v, conforme se observa no gráfico abaixo. : O gráfico mostra um conjunto de reações que estão acontecendo simultaneamente, conforme as equações abaixo:

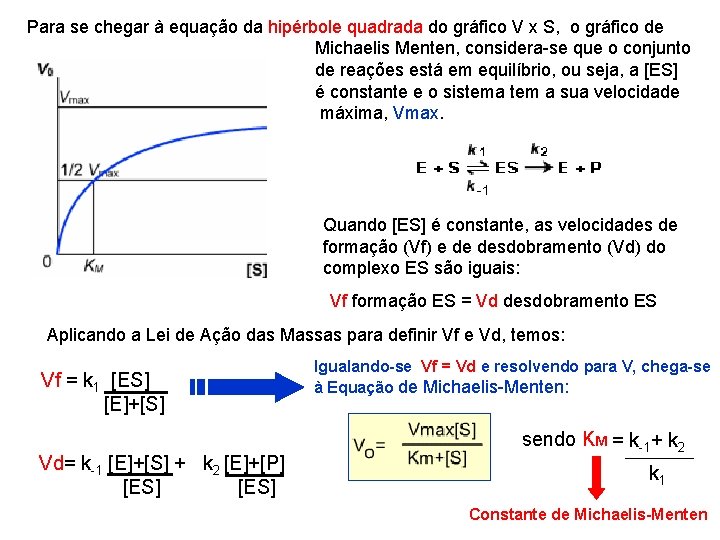
Para se chegar à equação da hipérbole quadrada do gráfico V x S, o gráfico de Michaelis Menten, considera-se que o conjunto de reações está em equilíbrio, ou seja, a [ES] é constante e o sistema tem a sua velocidade máxima, Vmax. Quando [ES] é constante, as velocidades de formação (Vf) e de desdobramento (Vd) do complexo ES são iguais: Vf formação ES = Vd desdobramento ES Aplicando a Lei de Ação das Massas para definir Vf e Vd, temos: Vf = k 1 [ES] [E]+[S] Vd= k-1 [E]+[S] + k 2 [E]+[P] [ES] Igualando-se Vf = Vd e resolvendo para V, chega-se à Equação de Michaelis-Menten: sendo KM = k-1+ k 2 k 1 Constante de Michaelis-Menten


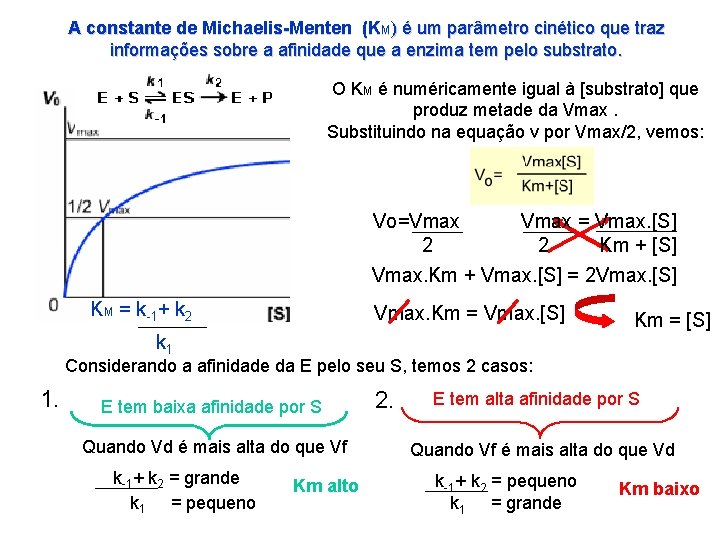
A constante de Michaelis-Menten (KM) é um parâmetro cinético que traz informações sobre a afinidade que a enzima tem pelo substrato. O KM é numéricamente igual à [substrato] que produz metade da Vmax. Substituindo na equação v por Vmax/2, vemos: Vo=Vmax = Vmax. [S] 2 2 Km + [S] Vmax. Km + Vmax. [S] = 2 Vmax. [S] KM = k-1+ k 2 Vmax. Km = Vmax. [S] k 1 Km = [S] Considerando a afinidade da E pelo seu S, temos 2 casos: 1. E tem baixa afinidade por S Quando Vd é mais alta do que Vf k-1+ k 2 = grande k 1 = pequeno Km alto 2. E tem alta afinidade por S Quando Vf é mais alta do que Vd k-1+ k 2 = pequeno k 1 = grande Km baixo

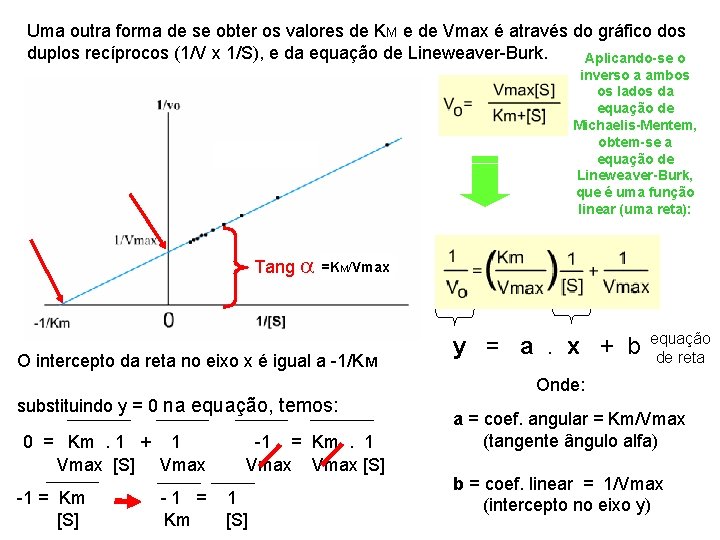
Uma outra forma de se obter os valores de KM e de Vmax é através do gráfico dos duplos recíprocos (1/V x 1/S), e da equação de Lineweaver-Burk. Aplicando-se o inverso a ambos os lados da equação de Michaelis-Mentem, obtem-se a equação de Lineweaver-Burk, que é uma função linear (uma reta): Tang a =KM/Vmax O intercepto da reta no eixo x é igual a -1/KM substituindo y = 0 na equação, temos: 0 = Km. 1 + 1 Vmax [S] Vmax -1 = Km [S] -1 = Km. 1 Vmax [S] 1 [S] y = a. x + b equação de reta Onde: a = coef. angular = Km/Vmax (tangente ângulo alfa) b = coef. linear = 1/Vmax (intercepto no eixo y)
![A velocidade da reação somente é proporcional à E quando a enzima está saturada A velocidade da reação somente é proporcional à [E] quando a enzima está saturada,](https://slidetodoc.com/presentation_image_h2/559d104e4ff8702f52a4a0f47da5cc47/image-10.jpg)
A velocidade da reação somente é proporcional à [E] quando a enzima está saturada, ou seja, reação é de ordem zero (independe) em relação a [S] Eficiência catalítica Kcat/Km - k 2 ou kcat (constante catalítica) mede o “poder catalítico” da enzima v = k 2 Etotal + [P] [ES] k 2 = Vmax (s-1) [Etotal] Parâmetro mais adequado para comparações cinéticas Para calcular kcat considera-se que toda a E existe como ES, e que v=Vmax

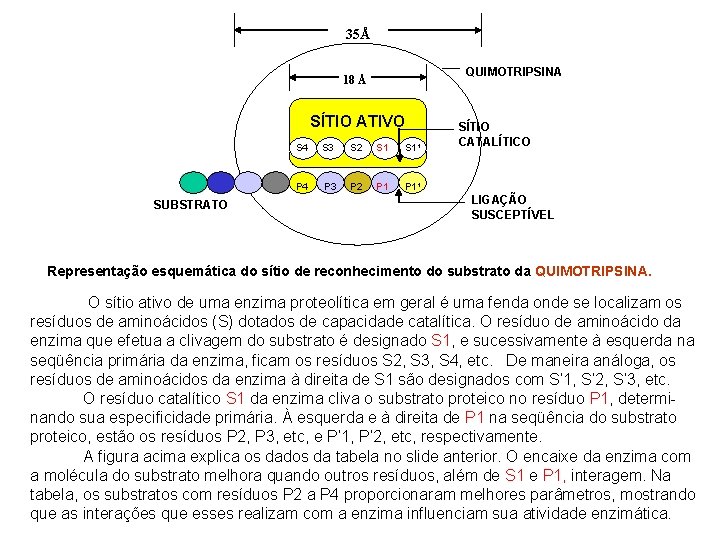
Interações secundárias de proteinases com seus substratos Enzima Tripsina (p. H 7. 5) Substratos Z-Lys-OMe Z-(Ala)2 -Tyr-Lys-OMe kcat (seg-1) KM (m. M) Razão kcat/ KM 101 106 0. 23 0. 08 1 3 Quimotripsina (p. H 7. 9) Z-Tyr-Gly-OMe Z-(Ala)2 -Ala-OMe 0. 6 10 23 2 1 190 Elastase (p. H 8. 0) Z-Ala-OMe Z-(Ala)2 -Ala-OMe 6. 7 73 153 0. 43 1 3900 A tabela ilustra como interpretar Kcat, KM e eficiência catalítica (kcat/KM), comparando a ação de enzimas proteolíticas sobre diferentes substratos sintéticos. O ponto de clivagem dos substratos está indicado pela flecha. Conforme o número de resíduos de aminoácidos aumenta à esquerda do ponto de clivagem, a eficiência catalítica (kcat/KM) das enzimas melhora (considerando-se como 1 o valor obtido com o substrato mais curto). No caso da tripsina, o Km diminue 3 X, sem alterar o kcat, ou seja a formação do complexo ES com o substrato maior é facilitado, mas não foi afetada a sua transformação em produto. No caso da elastase, o Km diminue ~300 X e o kcat aumenta ~10 x, ou seja todas as etapas da reação são facilitadas com o substrato mais longo. Como resultado, a eficiência catalítica aumentou 3. 900 vezes.

35Å QUIMOTRIPSINA 18 Å SÍTIO ATIVO SUBSTRATO S 4 S 3 S 2 S 1¹ P 4 P 3 P 2 P 1¹ SÍTIO CATALÍTICO LIGAÇÃO SUSCEPTÍVEL Representação esquemática do sítio de reconhecimento do substrato da QUIMOTRIPSINA. O sítio ativo de uma enzima proteolítica em geral é uma fenda onde se localizam os resíduos de aminoácidos (S) dotados de capacidade catalítica. O resíduo de aminoácido da enzima que efetua a clivagem do substrato é designado S 1, e sucessivamente à esquerda na seqüência primária da enzima, ficam os resíduos S 2, S 3, S 4, etc. De maneira análoga, os resíduos de aminoácidos da enzima à direita de S 1 são designados com S’ 1, S’ 2, S’ 3, etc. O resíduo catalítico S 1 da enzima cliva o substrato proteico no resíduo P 1, determinando sua especificidade primária. À esquerda e à direita de P 1 na seqüência do substrato proteico, estão os resíduos P 2, P 3, etc, e P’ 1, P’ 2, etc, respectivamente. A figura acima explica os dados da tabela no slide anterior. O encaixe da enzima com a molécula do substrato melhora quando outros resíduos, além de S 1 e P 1, interagem. Na tabela, os substratos com resíduos P 2 a P 4 proporcionaram melhores parâmetros, mostrando que as interações que esses realizam com a enzima influenciam sua atividade enzimática.

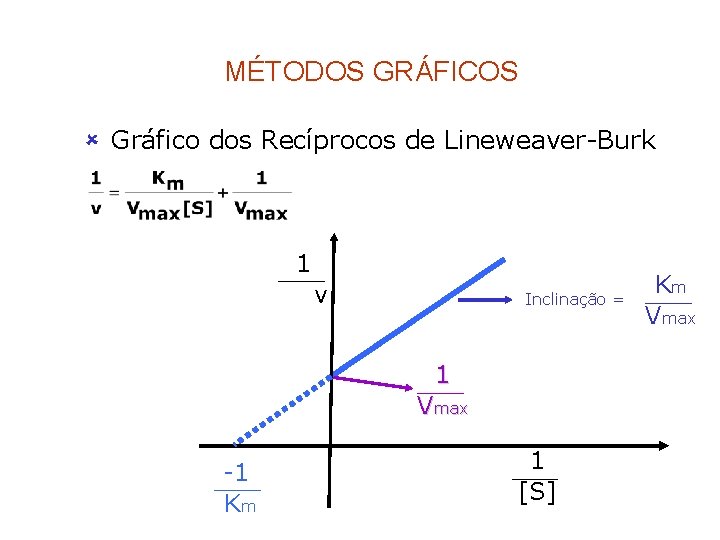
MÉTODOS GRÁFICOS û Gráfico dos Recíprocos de Lineweaver-Burk 1 v Inclinação = 1 Vmax -1 Km 1 [S] Km Vmax
![û Gráfico de EadieHofstee Vmax v Inclinação Km Vmax Km v S û Gráfico de Eadie-Hofstee Vmax v Inclinação = -Km Vmax Km v [S]](https://slidetodoc.com/presentation_image_h2/559d104e4ff8702f52a4a0f47da5cc47/image-14.jpg)
û Gráfico de Eadie-Hofstee Vmax v Inclinação = -Km Vmax Km v [S]
![û Gráfico de HanesWoolf S v Inclinação 1 Vmax Km Vmax Km S û Gráfico de Hanes-Woolf [S] v Inclinação = 1 Vmax Km Vmax -Km [S]](https://slidetodoc.com/presentation_image_h2/559d104e4ff8702f52a4a0f47da5cc47/image-15.jpg)
û Gráfico de Hanes-Woolf [S] v Inclinação = 1 Vmax Km Vmax -Km [S]

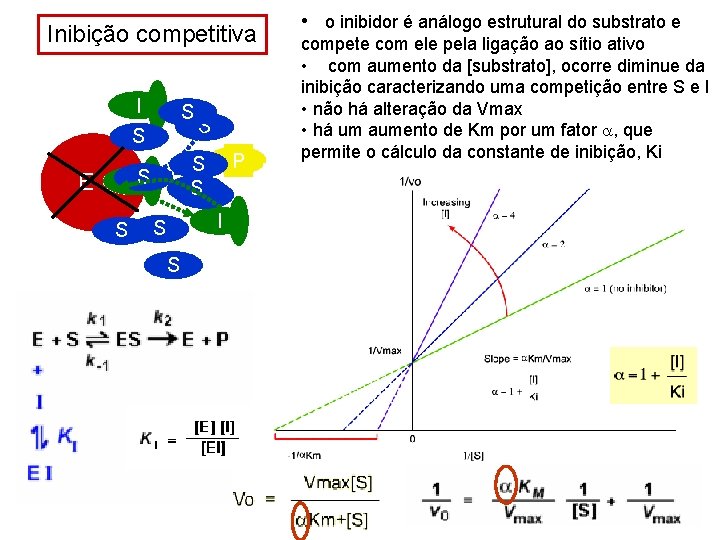
Inibição competitiva I S S S P S SS IS E S I S S • o inibidor é análogo estrutural do substrato e compete com ele pela ligação ao sítio ativo • com aumento da [substrato], ocorre diminue da inibição caracterizando uma competição entre S e I • não há alteração da Vmax • há um aumento de Km por um fator a, que permite o cálculo da constante de inibição, Ki

I S Inibição não competitiva ou mista S • inibidor não é análogo estutural do E S P I I I S I E E I S S S I I S S substrato - não se liga ao sítio ativo • inibidor se liga à E e ao ES • aumento da [substrato] não diminue a inibição - não há competição • Km aumenta e Vmax diminuí

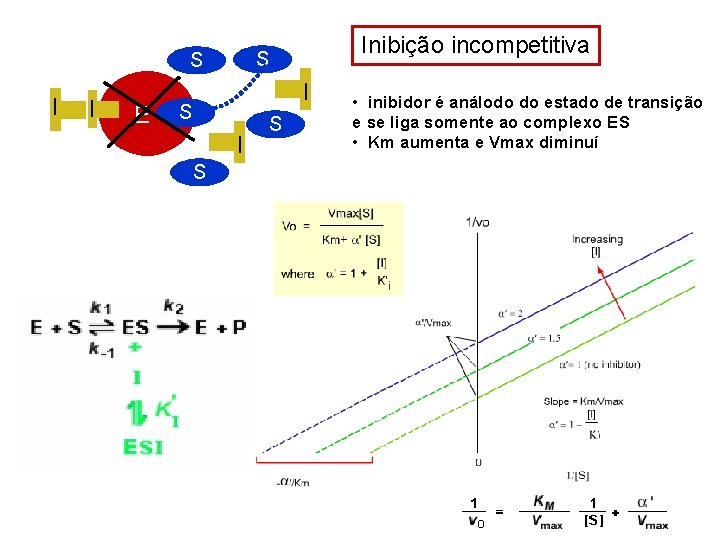
E S I I Inibição incompetitiva S S • inibidor é análodo do estado de transição e se liga somente ao complexo ES • Km aumenta e Vmax diminuí
 Processo empreendedor
Processo empreendedor Fatores do movimento
Fatores do movimento Filme
Filme Fatores ambientais da empresa
Fatores ambientais da empresa Decomposição de um número natural em fatores primos.
Decomposição de um número natural em fatores primos. Fatores sistêmicos
Fatores sistêmicos Viés de aferição exemplo
Viés de aferição exemplo Fatores determinantes da textualidade
Fatores determinantes da textualidade Dotação de fatores
Dotação de fatores Fatores de crescimento
Fatores de crescimento Fatores motivacionais
Fatores motivacionais Rudolf von laban
Rudolf von laban Elementos de coesao
Elementos de coesao Fatores responsáveis pela suburbanização
Fatores responsáveis pela suburbanização Fatoração ao cubo
Fatoração ao cubo Plano de aula ensino religioso vida e morte
Plano de aula ensino religioso vida e morte Mapa da
Mapa da Actividade laboratorial osmose relatório
Actividade laboratorial osmose relatório Atividades sobre lutas 3 ano
Atividades sobre lutas 3 ano