UNIVERSITE DE PICARDIE JULES VERNE Facult de Pharmacie



- Slides: 18

UNIVERSITE DE PICARDIE JULES VERNE Faculté de Pharmacie Chimie Organique, Prof. P. Sonnet-EA 3901 -DMAG-INERIS Mono et dicétopipérazine dans les produits naturels Filippo De Simone 04/07/2005

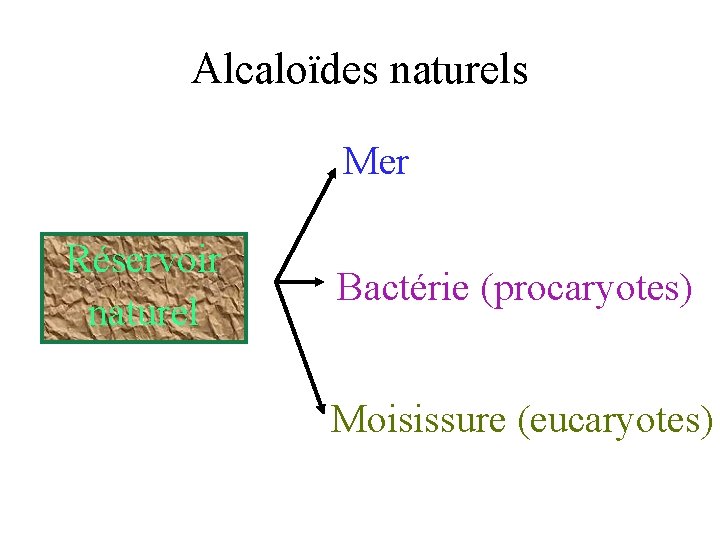
Alcaloïdes naturels Mer Réservoir naturel Bactérie (procaryotes) Moisissure (eucaryotes)

Origine marine Extraction et reconnaissance des différents alcaloïdes présents dans les éponges appartenant au ordre des Axinellidae Eponges ordre des Axinellidae Synthèse de molécules défensives Alcaloïdes à structure pyrroloimidazolique

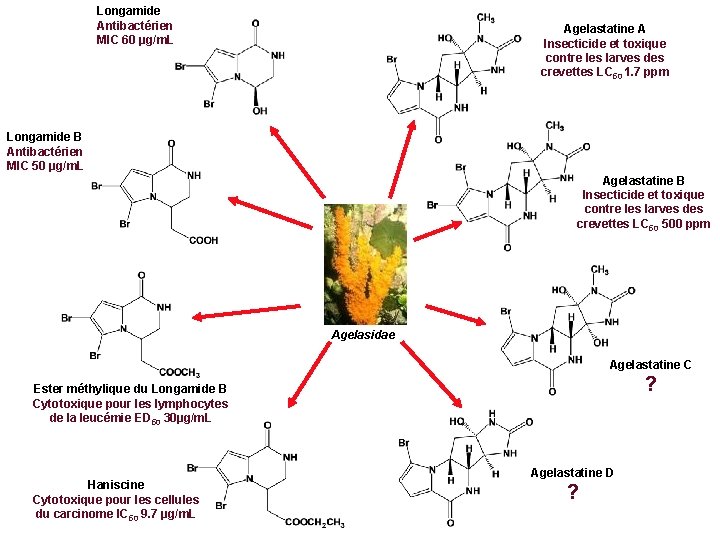
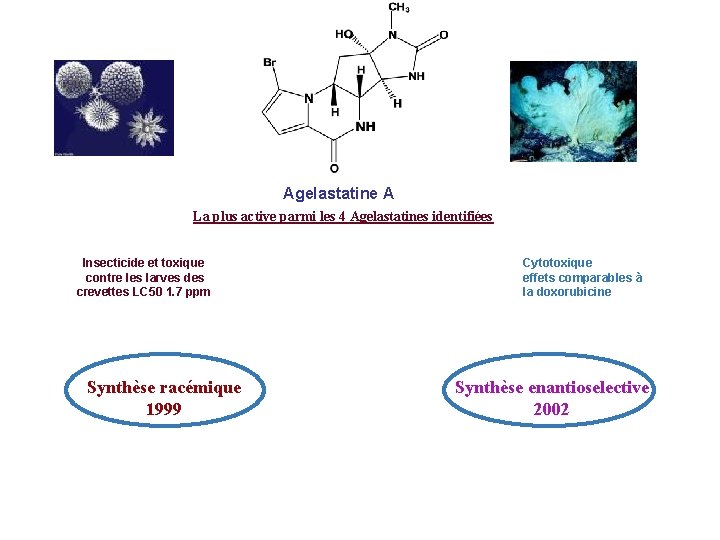
Longamide Antibactérien MIC 60 µg/m. L Agelastatine A Insecticide et toxique contre les larves des crevettes LC 50 1. 7 ppm Longamide B Antibactérien MIC 50 µg/m. L Agelastatine B Insecticide et toxique contre les larves des crevettes LC 50 500 ppm Agelasidae Agelastatine C ? Ester méthylique du Longamide B Cytotoxique pour les lymphocytes de la leucémie ED 50 30µg/m. L Haniscine Cytotoxique pour les cellules du carcinome IC 50 9. 7 µg/m. L Agelastatine D ?

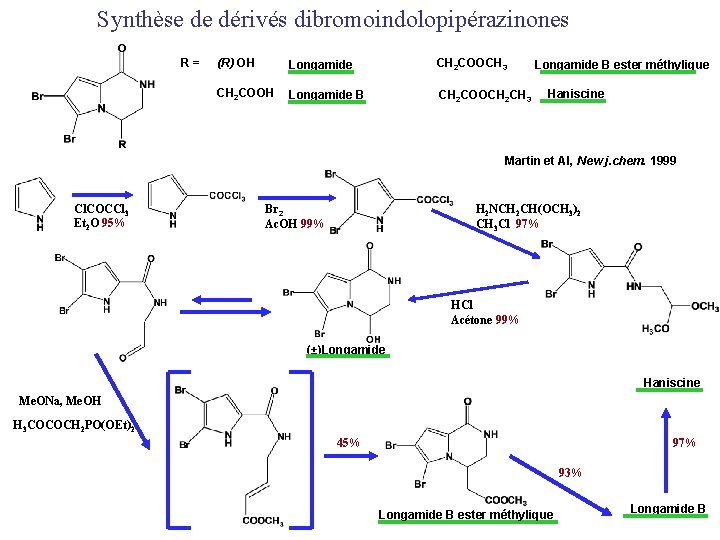
Synthèse de dérivés dibromoindolopipérazinones R= (R) OH Longamide CH 2 COOCH 3 CH 2 COOH Longamide B CH 2 COOCH 2 CH 3 Longamide B ester méthylique Haniscine Martin et Al, New j. chem. 1999 Cl. COCCl 3 Et 2 O 95% Br 2 Ac. OH 99% H 2 NCH 2 CH(OCH 3)2 CH 3 Cl 97% HCl Acétone 99% (±)Longamide Haniscine Me. ONa, Me. OH H 3 COCOCH 2 PO(OEt)2 45% 97% 93% Longamide B ester méthylique Longamide B

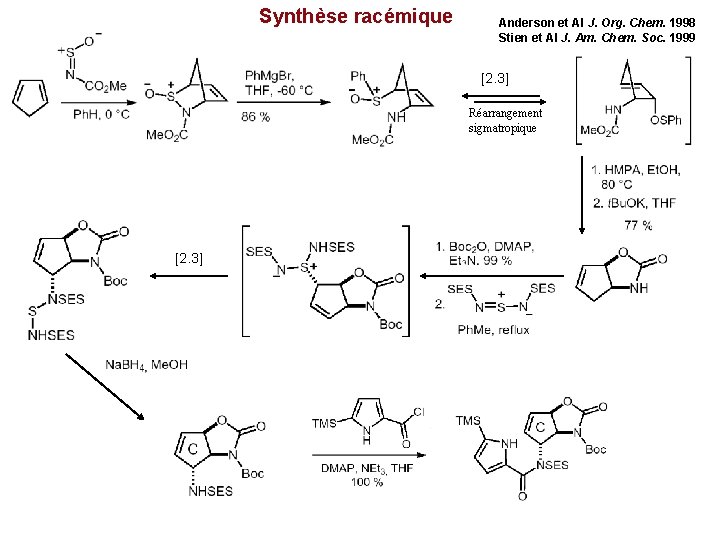
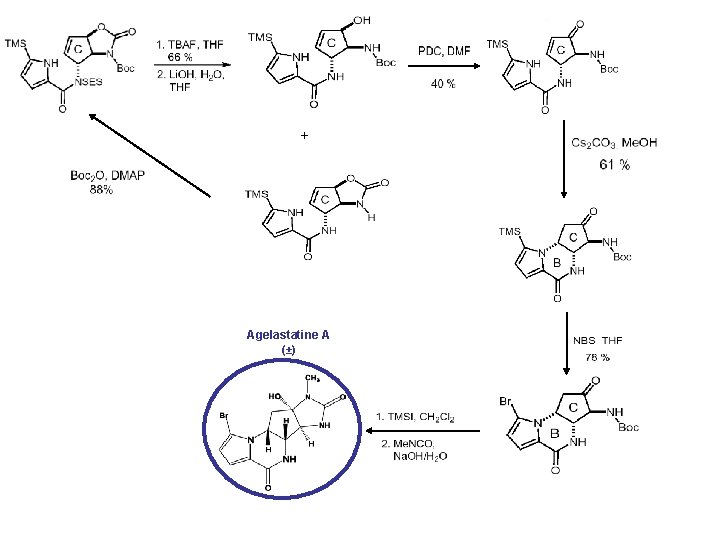
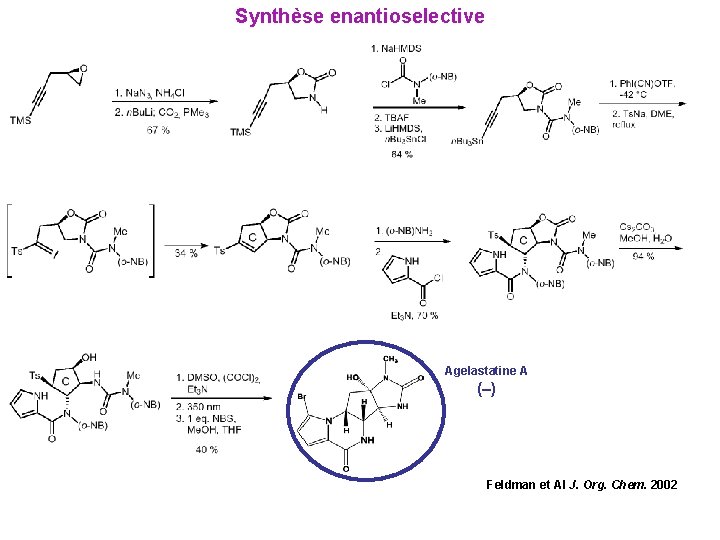
Agelastatine A La plus active parmi les 4 Agelastatines identifiées Insecticide et toxique contre les larves des crevettes LC 50 1. 7 ppm Synthèse racémique 1999 Cytotoxique effets comparables à la doxorubicine Synthèse enantioselective 2002

Synthèse racémique Anderson et Al J. Org. Chem. 1998 Stien et Al J. Am. Chem. Soc. 1999 [2. 3] Réarrangement sigmatropique [2. 3]

+ Agelastatine A (±)

Synthèse enantioselective Agelastatine A (–) Feldman et Al J. Org. Chem. 2002

Les éponges représentent une grande source de molécules organiques très actives Etude de la synthèse à partir des résultats in vitro coûts expérimentaux réduits Point de départ pour nouvelles structures de médicaments Découverte de nouvelles classes de médicaments

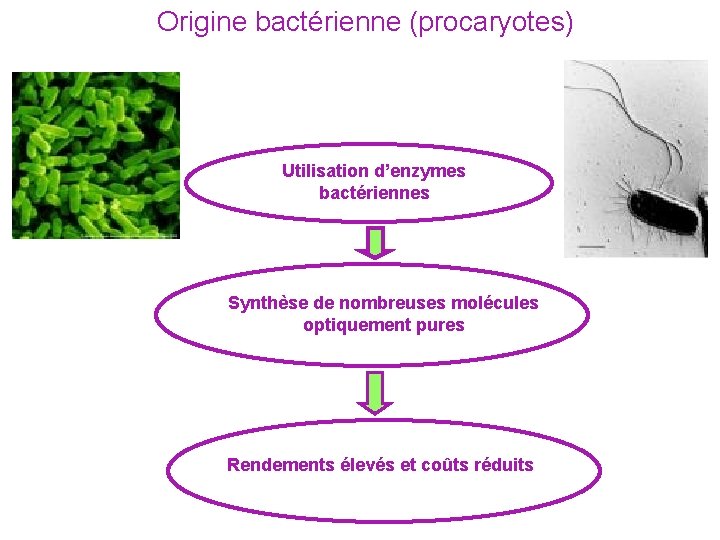
Origine bactérienne (procaryotes) Utilisation d’enzymes bactériennes Synthèse de nombreuses molécules optiquement pures Rendements élevés et coûts réduits

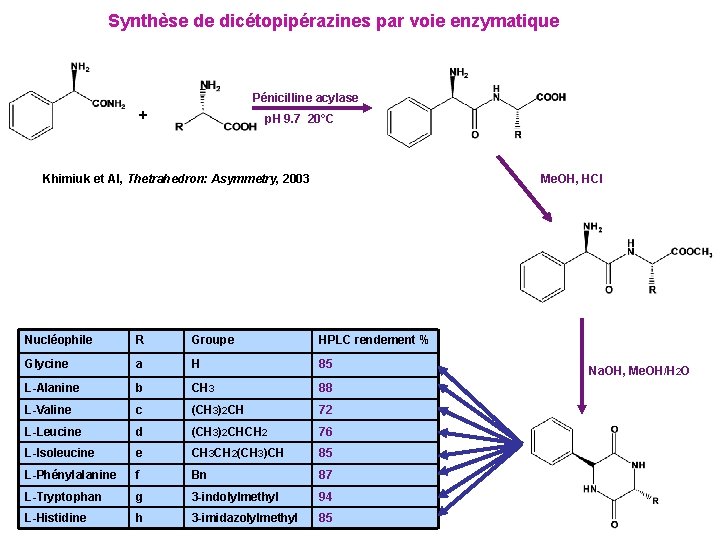
Synthèse de dicétopipérazines par voie enzymatique Pénicilline acylase + p. H 9. 7 20°C Khimiuk et Al, Thetrahedron: Asymmetry, 2003 Me. OH, HCl Nucléophile R Groupe HPLC rendement % Glycine a H 85 L-Alanine b CH 3 88 L-Valine c (CH 3)2 CH 72 L-Leucine d (CH 3)2 CHCH 2 76 L-Isoleucine e CH 3 CH 2(CH 3)CH 85 L-Phénylalanine f Bn 87 L-Tryptophan g 3 -indolylmethyl 94 L-Histidine h 3 -imidazolylmethyl 85 Na. OH, Me. OH/H 2 O

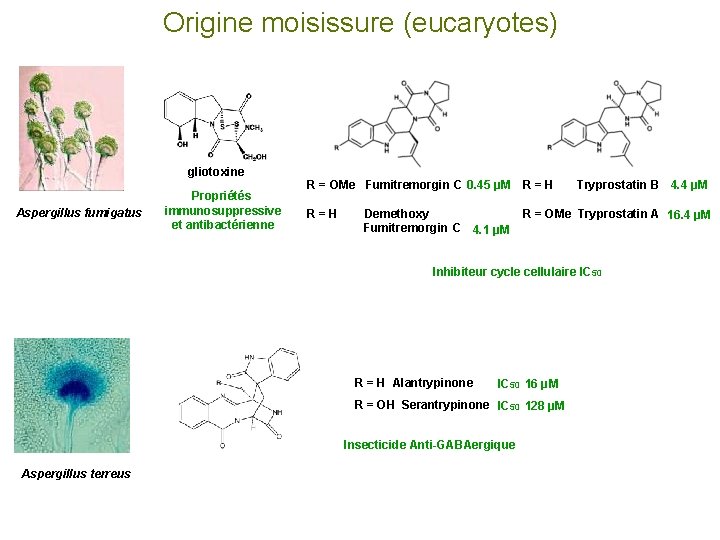
Origine moisissure (eucaryotes) gliotoxine Aspergillus fumigatus Propriétés immunosuppressive et antibactérienne R = OMe Fumitremorgin C 0. 45 μM R = H R=H Demethoxy Fumitremorgin C 4. 1 μM Tryprostatin B 4. 4 μM R = OMe Tryprostatin A 16. 4 μM Inhibiteur cycle cellulaire IC 50 R = H Alantrypinone IC 50 16 μM R = OH Serantrypinone IC 50 128 μM Insecticide Anti-GABAergique Aspergillus terreus

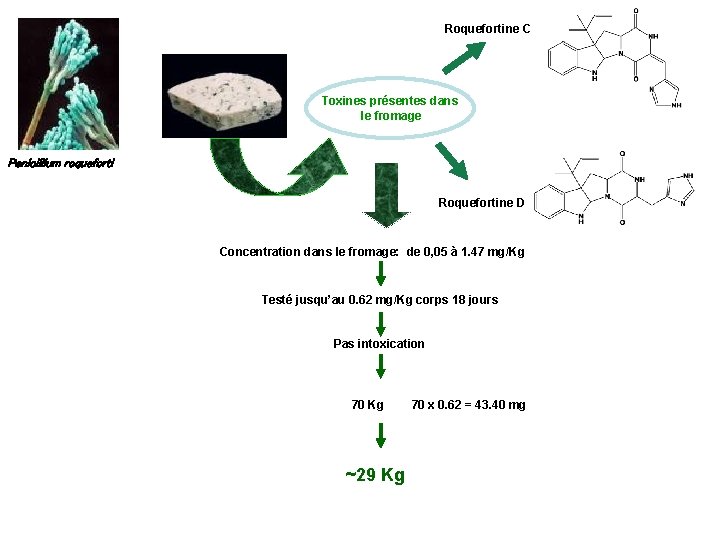
Roquefortine C Toxines présentes dans le fromage Penicillium roqueforti Roquefortine D Concentration dans le fromage: de 0, 05 à 1. 47 mg/Kg Testé jusqu’au 0. 62 mg/Kg corps 18 jours Pas intoxication 70 Kg ~29 Kg 70 x 0. 62 = 43. 40 mg

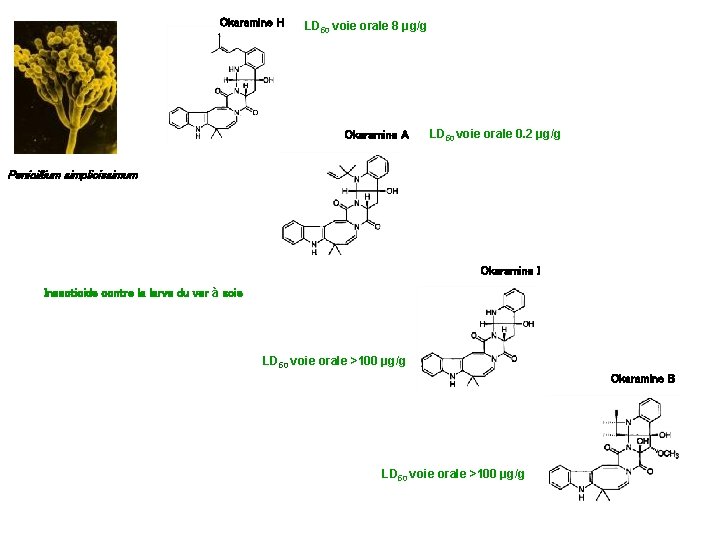
Okaramine H LD 50 voie orale 8 μg/g Okaramine A LD 50 voie orale 0. 2 μg/g Penicillium simplicissimum Okaramine I Insecticide contre la larve du ver à soie LD 50 voie orale >100 μg/g Okaramine B LD 50 voie orale >100 μg/g

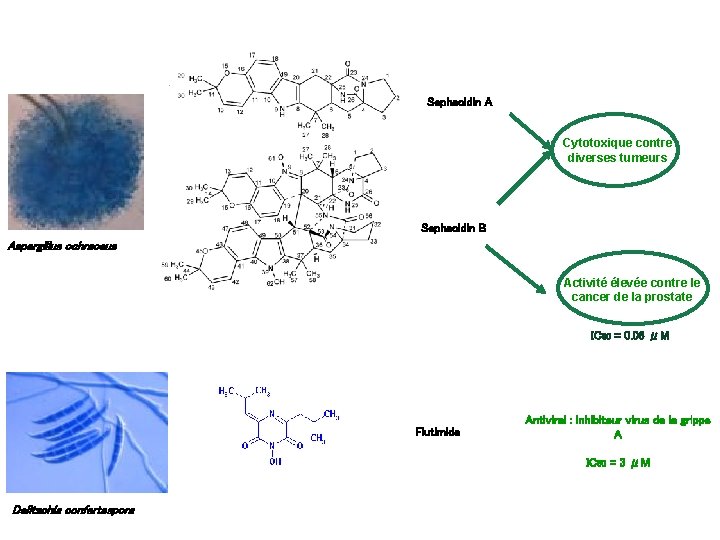
Sephacidin A Cytotoxique contre diverses tumeurs Sephacidin B Aspergillus ochraceus Activité élevée contre le cancer de la prostate IC 50 = 0. 06 μM Flutimide Antiviral : inhibiteur virus de la grippe A IC 50 = 3 μM Delitschia confertaspora

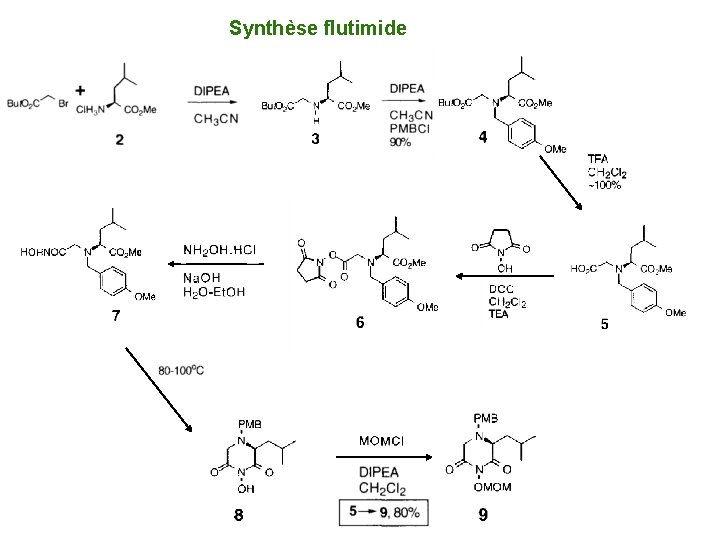
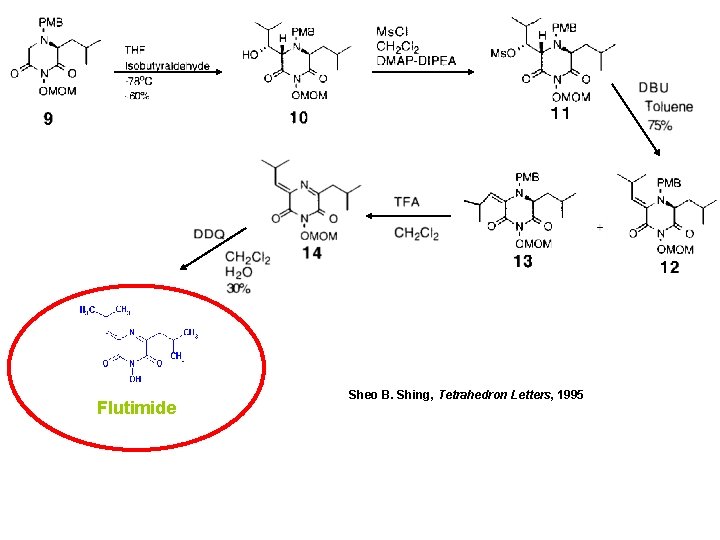
Synthèse flutimide

Flutimide Sheo B. Shing, Tetrahedron Letters, 1995
 Facult
Facult Planiquel
Planiquel Clg jf mlj
Clg jf mlj Jule bern
Jule bern Jules verne scifi
Jules verne scifi College jules verne carcassonne
College jules verne carcassonne Jules verne cesta na mesiac obsah
Jules verne cesta na mesiac obsah Picardie
Picardie Université batna 2 mostefa ben boulaid
Université batna 2 mostefa ben boulaid Cours pharmacie constantine
Cours pharmacie constantine Pharmacie beaujon
Pharmacie beaujon Manicol pharmacie
Manicol pharmacie Procedure chaine du froid pharmacie
Procedure chaine du froid pharmacie Pharmacie gamma lausanne laboratoire
Pharmacie gamma lausanne laboratoire Gyneas pessaire cube remboursement
Gyneas pessaire cube remboursement Pharmacie hippocrate sousse
Pharmacie hippocrate sousse Faculté de pharmacie de monastir
Faculté de pharmacie de monastir Manicol pharmacie
Manicol pharmacie Scolarité médecine nantes
Scolarité médecine nantes