UNIVERSITE DE PICARDIE JULES VERNE Facult de Pharmacie





























- Slides: 42

UNIVERSITE DE PICARDIE JULES VERNE Faculté de Pharmacie Chimie Organique- EA 3901 -DMAG-INERIS Réactions de couplage carbone C. Lencina; A. Dassonville; P. Sonnet 08/03/2005

Sommaire o I Réactions de couplage C=C 1. Julia-Lythgoe 2. Julia modifiée Diapositive 6 Diapositive 7 2. 1. Mécanisme réactionnelle o II Couplage C=C par réaction d'ylures 1. Généralité 2. Different types d'ylures 3. Réaction de Wittig Diapositive 10 Diapositive 11 Diapositive 12 3. 1 Mécanisme réactionnel 3. 2 Réaction de Wittig: sélectivité cis 3. 3 Réaction de Wittig: sélectivité trans 3. 3. 1 Réaction de Wittig: sélectivité trans / modification de Schlosser

Sommaire 4. Horner-Wadworth-Emmons (Wittig-Horner) Diapositive 18 4. 1 Généralité 4. 2 Mécanisme réactionnel o III Couplage C C par l'intermédiaire de métaux de transition 1. Groupes organocuivreux Diapositive 20 1. 1 Généralité 1. 2 Mécanisme réactionnel 2. Couplages catalysées par le Ni 2. 1 Généralité 2. 2 Mécanisme réactionnel Diapositive 22

Sommaire 3. Couplages Palladocatalysées Diapositive 24 3. 1 Généralité 3. 2 Couplage de groupes organiques liés au Bore ou couplage de Suzuki 3. 2. 1 Généralité 3. 2. 2 Mécanisme réactionnel 3. 2. 3 Couplage d'un iodure d'alcényle 3. 2. 4 Polysubstitution 3. 2. 5 Couplage de trialkylboranes a) Généralité 3. 2. 6 Conclusion sur la réaction de Suzuki 3. 3 Couplages de groupes organiques liés au Zinc 3. 4 Couplage de dérivé halogénés: réaction de Heck 3. 4. 1 Généralités 3. 4. 2 Mécanisme Réactionnel 3. 4. 3 Couplage entre 2 oléfines

Sommaire 3. 5 Couplage de dérivés stanneux: réaction de Stille 3. 5. 1 Généralité 3. 5. 2 Exemples 3. 5. 3 Réactions de carbonylation 3. 5. 3. 1 Mécanisme réactionnel de la carbonylation 3. 6 Réaction de couplage de Sonogashira 3. 7 Réaction de couplage de Negishi o IV Bibliographie Diapositive 42

I Réactions de couplage C=C 1. Julia-Lythgoe • Addiction des alkylphenylsulfones primaires lithiées sur aldéhydes • Il se forme un alcoolate de lithium • Lors d'addiction de l'anhydride acétique, il se forme une( -acetoxyalkyl)phénylsulphone sous la forme d'un mélange de 2 diastéréoisomères • Puis on additionne Na/Hg ce qui provoquera une élimination du groupement Na+-O 2 SPh • Les produits formés peuvent se transformer l'un l'autre • L'élimination du Na+-OAc de A se fait plus rapidement que celle du B • Grâce à l'épimérisation entre les deux, et la plus grande réactivité de A, on peut obtenir majoritairement l'oléfine trans

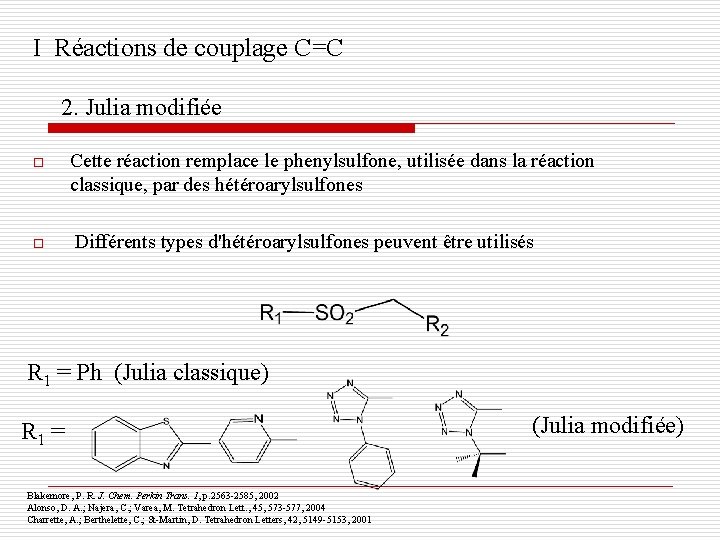
I Réactions de couplage C=C 2. Julia modifiée o o Cette réaction remplace le phenylsulfone, utilisée dans la réaction classique, par des hétéroarylsulfones Différents types d'hétéroarylsulfones peuvent être utilisés R 1 = Ph (Julia classique) R 1 = Blakemore, P. R. J. Chem. Perkin Trans. 1, p. 2563 -2585, 2002 Alonso, D. A. ; Najera, C. ; Varea, M. Tetrahedron Lett. , 45, 573 -577, 2004 Charrette, A. ; Berthelette, C. ; St-Martin, D. Tetrahedron Letters, 42, 5149 -5153, 2001 (Julia modifiée)

I Réactions de couplage C=C 2. Julia modifiée o Substrat: des aldéhydes , -insaturés (inclus les aromatiques) o Produit: alcènes 1, 2 -substitués avec haut stéréosélectivité trans Blakemore, P. R. J. Chem. Perkin Trans. 1, p. 2563 -2585, 2002

I Réactions de couplage C=C 2. 1. Mécanisme réactionnel

II Couplage C=C par réaction d'ylures 1. Généralité o C'est une synthèse d'oléfines à travers des ylures de phosphore et de composés carbonylés o Dans la plupart des réactions de Wittig, les ylures ont pour structure o Il y a 3 types différents d'ylures - Non stabilisés - semi stabilisés - stabilisés Shah, S. and Protasiewicz, J. D. Coord. Chem. Rev. , 210, p. 181 -201, 2000

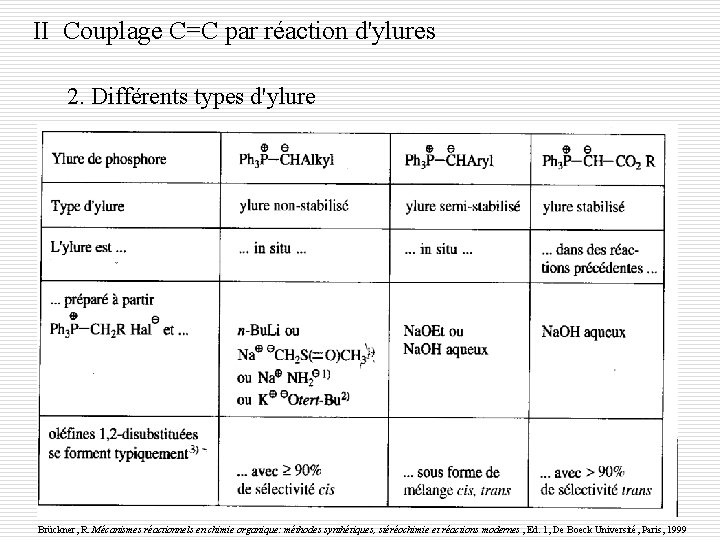
II Couplage C=C par réaction d'ylures 2. Différents types d'ylure Brückner, R. Mécanismes réactionnels en chimie organique: méthodes synthétiques, stéréochimie et réactions modernes , Ed. 1, De Boeck Université, Paris, 1999

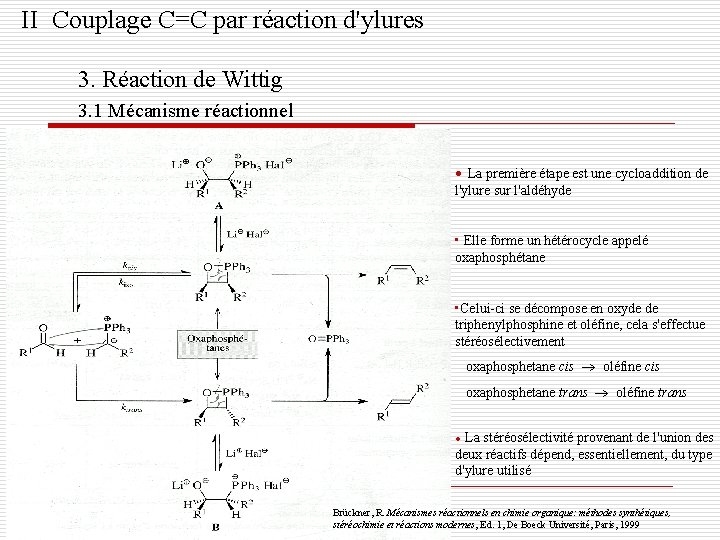
II Couplage C=C par réaction d'ylures 3. Réaction de Wittig 3. 1 Mécanisme réactionnel • La première étape est une cycloaddition de l'ylure sur l'aldéhyde • Elle forme un hétérocycle appelé oxaphosphétane • Celui-ci se décompose en oxyde de triphenylphosphine et oléfine, cela s'effectue stéréosélectivement oxaphosphetane cis oléfine cis oxaphosphetane trans oléfine trans La stéréosélectivité provenant de l'union des deux réactifs dépend, essentiellement, du type d'ylure utilisé • Brückner, R. Mécanismes réactionnels en chimie organique: méthodes synthétiques, stéréochimie et réactions modernes, Ed. 1, De Boeck Université, Paris, 1999

II Couplage C=C par réaction d'ylures 3. 2 Réaction de Wittig: sélectivité cis o Les réactions de Wittig qui utilisent des ylures non stabilisés donnent rapidement et réversiblement l'oxaphosphetane cis donnent lentement et irréversiblement l'oxaphosphétane trans o L'oxaphosphetane cis peut s'isomeriser en un phosphétane trans, irréversiblement cette transformation devient indésirable Brückner, R. Mécanismes réactionnels en chimie organique: méthodes synthétiques, stéréochimie et réactions modernes , Ed. 1, De Boeck Université, Paris, 1999 Clayden, J. ; Greeves, N. ; Warren, S. ; Wothers, P. Chimie organique, Ed. 1, De Boeck Diffusion, Paris, 2003 Boutagy, J. and Thomas, R. Chem. Rev. , 74, 1, 87 -99, 1974

II Couplage C=C par réaction d'ylures 3. 2 Réaction de Wittig: sélectivité cis o Le phosphétane trans peut être éliminé dans les réactions de Wittig des ylures non stabilisés o En utilisant des réactions en absence des sels de lithium o Ces réactions sont possibles en changeant les bases pour la déprotonation du sel de phosphore n-Bu. Li Na. NH 2 LDA tert-Bu. OK Brückner, R. Mécanismes réactionnels en chimie organique: méthodes synthétiques, stéréochimie et réactions modernes , Ed. 1, De Boeck Université, Paris, 1999 Clayden, J. ; Greeves, N. ; Warren, S. ; Wothers, P. Chimie organique, Ed. 1, De Boeck Diffusion, Paris, 2003

II Couplage C=C par réaction d'ylures 3. 3 Réaction de Wittig: sélectivité trans o On utilise des ylures stabilisés pour réagir avec les aldéhydes ou cétones et obtenir des oléfines trans o Une autre façon d'obtenir les oléfines trans consiste en l'utilisation de la modification de Schlosser Brückner, R. Mécanismes réactionnels en chimie organique: méthodes synthétiques, stéréochimie et réactions modernes , Ed. 1, De Boeck Université, Paris, 1999 Clayden, J. ; Greeves, N. ; Warren, S. ; Wothers, P. Chimie organique, Ed. 1, De Boeck Diffusion, Paris, 2003 Voguel, P. Chimie organique méthodes et modèles, Ed. 1, De Boeck et Lancier, Paris, 1997

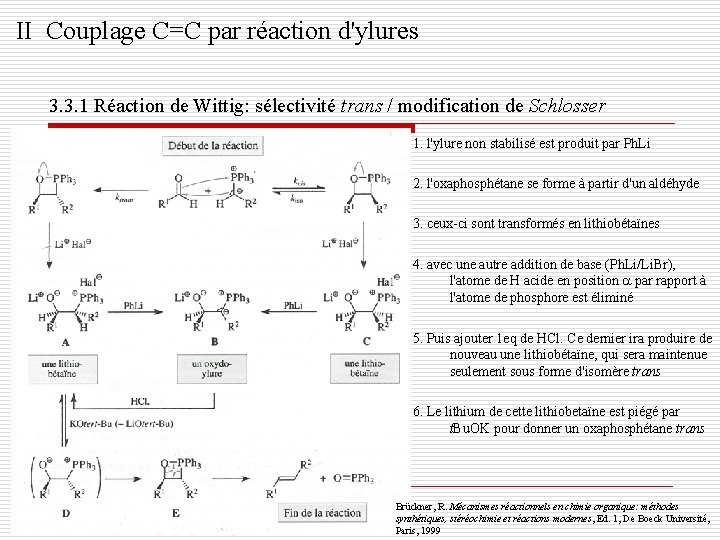
II Couplage C=C par réaction d'ylures 3. 3. 1 Réaction de Wittig: sélectivité trans / modification de Schlosser o Elle utilise des ylures non stabilisés en l'absence de sel o Il fournit exclusivement les oléfines trans o L'objectif est de convertir vite et complètement les produits de départ en lithiobétaïnes Brückner, R. Mécanismes réactionnels en chimie organique: méthodes synthétiques, stéréochimie et réactions modernes , Ed. 1, De Boeck Université, Paris, 1999 Clayden, J. ; Greeves, N. ; Warren, S. ; Wothers, P. Chimie organique, Ed. 1, De Boeck Diffusion, Paris, 2003 Voguel, P. Chimie organique méthodes et modèles, Ed. 1, De Boeck et Lancier, Paris, 1997

II Couplage C=C par réaction d'ylures 3. 3. 1 Réaction de Wittig: sélectivité trans / modification de Schlosser 1. l'ylure non stabilisé est produit par Ph. Li 2. l'oxaphosphétane se forme à partir d'un aldéhyde 3. ceux-ci sont transformés en lithiobétaïnes 4. avec une autre addition de base (Ph. Li/Li. Br), l'atome de H acide en position par rapport à l'atome de phosphore est éliminé 5. Puis ajouter 1 eq de HCl. Ce dernier ira produire de nouveau une lithiobétaïne, qui sera maintenue seulement sous forme d'isomère trans 6. Le lithium de cette lithiobetaïne est piégé par t. Bu. OK pour donner un oxaphosphétane trans Brückner, R. Mécanismes réactionnels en chimie organique: méthodes synthétiques, stéréochimie et réactions modernes, Ed. 1, De Boeck Université, Paris, 1999

II Couplage C=C par réaction d'ylures 4. Horner-Wadworth-Emmons (Wittig-Horner) 4. 1 Généralité o Cette réaction utilise un phosphonate plutôt qu'un ylure o Le phosphonate stabilise fortement la charge formelle sur l'atome de C o Cela fournit des oléfines sélectivement e majoritairement trans o Avantages de l'utilisation des phosphonates aux sels de phosphonium - réagissent mieux en général - sont soluble dans l'eau - sont plus faciles d'accés - sont moins sensibles à la nature de la base que les ylures Touloup, R. Synthèse organique, Ed. 1, Polytechnica, Paris, 1994 Darviche, F. ; Babonneau, M. T. ; Cristau, H. J. ; Torreilles, E. ; Fabre, J. M. Synthetic Metals 102, p. 1662 -65, 1999 Boutagy, J. and Thomas, R. Chem. Rev. , 74, 1, 87 -99, 1974 Wadsworth, W. J. and Emmons, W. J. Am. Chem. Soc. , 83, 1733 -1738, 1961

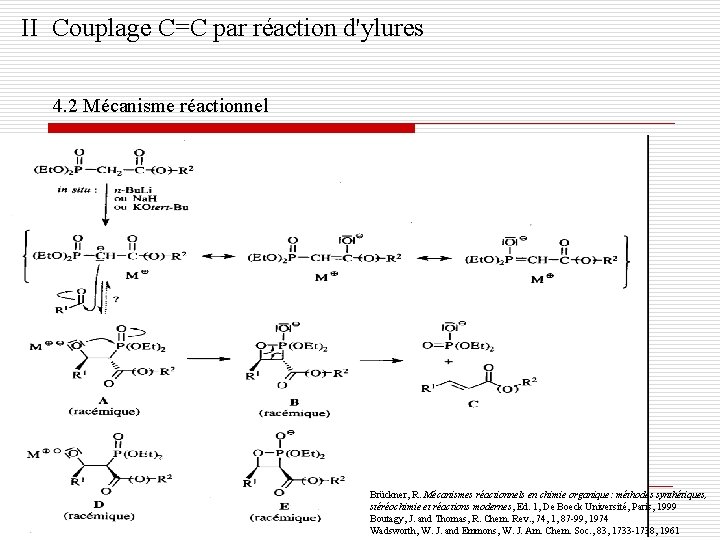
II Couplage C=C par réaction d'ylures 4. 2 Mécanisme réactionnel Brückner, R. Mécanismes réactionnels en chimie organique: méthodes synthétiques, stéréochimie et réactions modernes, Ed. 1, De Boeck Université, Paris, 1999 Boutagy, J. and Thomas, R. Chem. Rev. , 74, 1, 87 -99, 1974 Wadsworth, W. J. and Emmons, W. J. Am. Chem. Soc. , 83, 1733 -1738, 1961

III Couplage C C par l'intermédiaire de métaux de transition 1. Groupes organocuivreux 1. 1 Généralité o Me 2 Cu. Li s'additionne sur les triflates d'alcényle ou d'aryle o Le même se déroule avec les oléfines halogénées, lesquelles sont transformées avec des cuprates de Guilman o Avec complète rétention de la configuration dans la liaison Csp 2 X Csp 2 C Voguel, P. Chimie organique méthodes et modèles, Ed. 1, De Boeck et Lancier, Paris, 1997

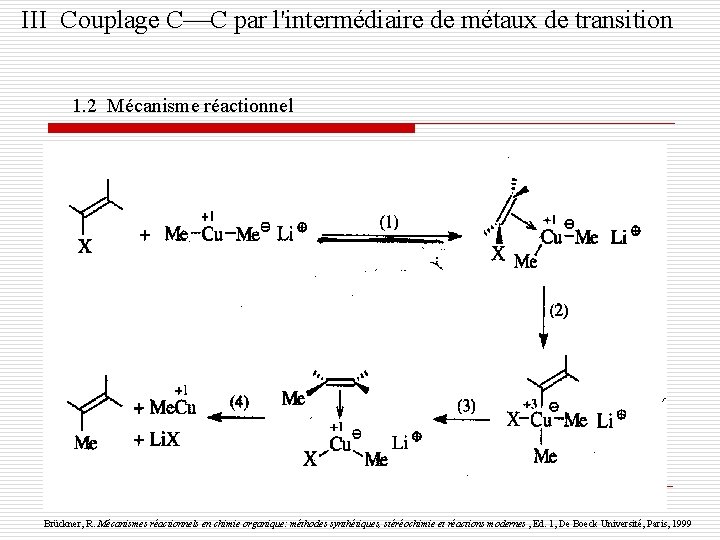
III Couplage C C par l'intermédiaire de métaux de transition 1. 2 Mécanisme réactionnel Brückner, R. Mécanismes réactionnels en chimie organique: méthodes synthétiques, stéréochimie et réactions modernes , Ed. 1, De Boeck Université, Paris, 1999

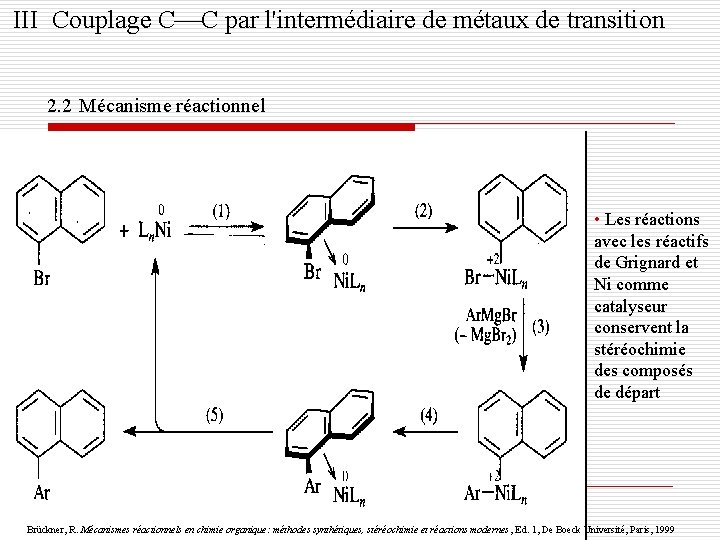
III Couplage C C par l'intermédiaire de métaux de transition 2. Couplages catalysées par le Ni 2. 1 Généralité o Bromures ou iodures d'alcényle; triflates, bromures ou iodures d'aryle Réactifs obtenus par réactions de substitution avec des Grignard o Complexe de Ni est nécessaire o Espèce catalytique: Ni 0, Ni 2+ Ni 0 Ex: Ni. Cl 2(dppe) Voguel, P. Chimie organique méthodes et modèles, Ed. 1, De Boeck et Lancier, Paris, 1997

III Couplage C C par l'intermédiaire de métaux de transition 2. 2 Mécanisme réactionnel • Les réactions avec les réactifs de Grignard et Ni comme catalyseur conservent la stéréochimie des composés de départ Brückner, R. Mécanismes réactionnels en chimie organique: méthodes synthétiques, stéréochimie et réactions modernes , Ed. 1, De Boeck Université, Paris, 1999

III Couplage C C par l'intermédiaire de métaux de transition 3. Couplages Palladocatalysées 3. 1 Généralité o Le Palladium est le composé le plus utilisé comme catalyseur de couplage C C o Dans ces réactions on utilise, normalement, comme substrat - Des dérivés halogénés (Heck) - Des dérivés de l'acide boronique (Suzuki) - Des dérivés stanneux (Stille)

III Couplage C C par l'intermédiaire de métaux de transition 3. 2 Couplage de groupes organiques liés au Bore ou couplage de Suzuki 3. 2. 1 Généralité o Ces réactions sont réalisées, généralement, avec des substrat triflates, les bromures et les iodures o Elles nécessitent une quantité catalytique de palladium o Le plus utilisé est un complexe de Pd 0 - Pd(PPh 3)4 o Les composés plus utilisés sont les esters et les acides boroniques o On peut préparer des aryloléfines - alcénylation d'un composé arylboré - arylation d'un composé alcénylboré Miyura, N. ; Suzuki, A. Chem. Rev. , 95, p. 2557 -2583, 1995 Schröter, S. ; Stock, C. and Bach, T. Tetrahedron "article in press"

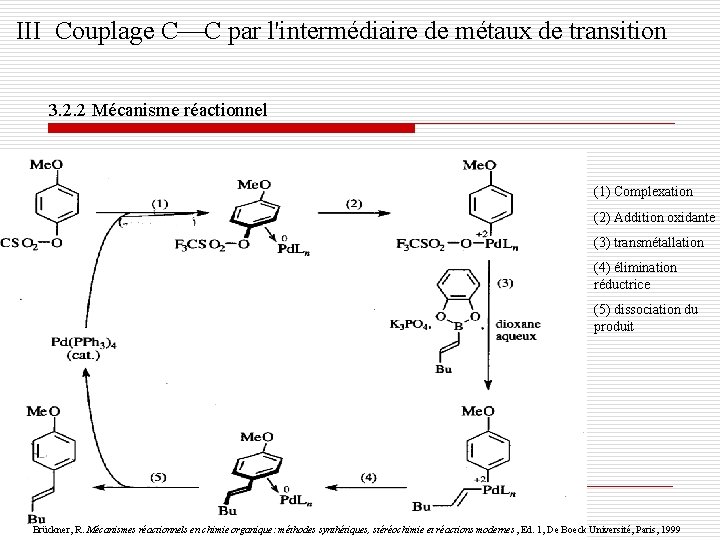
III Couplage C C par l'intermédiaire de métaux de transition 3. 2. 2 Mécanisme réactionnel (1) Complexation (2) Addition oxidante (3) transmétallation (4) élimination réductrice (5) dissociation du produit Brückner, R. Mécanismes réactionnels en chimie organique: méthodes synthétiques, stéréochimie et réactions modernes , Ed. 1, De Boeck Université, Paris, 1999

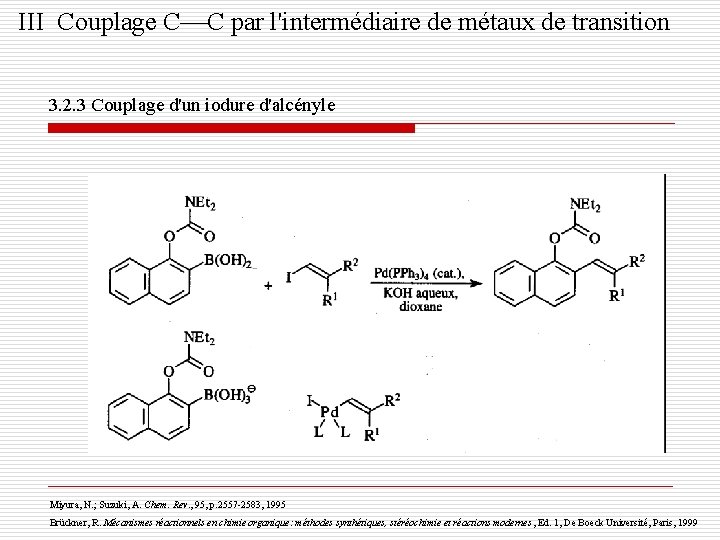
III Couplage C C par l'intermédiaire de métaux de transition 3. 2. 3 Couplage d'un iodure d'alcényle Miyura, N. ; Suzuki, A. Chem. Rev. , 95, p. 2557 -2583, 1995 Brückner, R. Mécanismes réactionnels en chimie organique: méthodes synthétiques, stéréochimie et réactions modernes , Ed. 1, De Boeck Université, Paris, 1999

III Couplage C C par l'intermédiaire de métaux de transition 3. 2. 4 Polysubstitution o Avec des composés qui contiennent 1 ou plusieurs groupements triflates, bromures ou iodures Il est possible de substituer sélectivement l'un après l'autre selon une ordre de réactivité: I Br triflate Brückner, R. Mécanismes réactionnels en chimie organique: méthodes synthétiques, stéréochimie et réactions modernes , Ed. 1, De Boeck Université, Paris, 1999 Clayden, J. ; Greeves, N. ; Warren, S. ; Wothers, P. Chimie organique, Ed. 1, De Boeck Diffusion, Paris, 2003

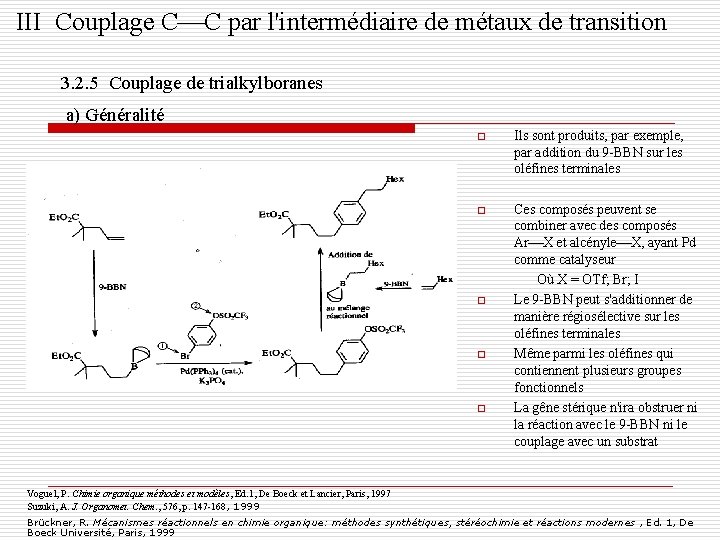
III Couplage C C par l'intermédiaire de métaux de transition 3. 2. 5 Couplage de trialkylboranes a) Généralité o Ils sont produits, par exemple, par addition du 9 -BBN sur les oléfines terminales o Ces composés peuvent se combiner avec des composés Ar X et alcényle X, ayant Pd comme catalyseur Où X = OTf; Br; I Le 9 -BBN peut s'additionner de manière régiosélective sur les oléfines terminales Même parmi les oléfines qui contiennent plusieurs groupes fonctionnels La gêne stérique n'ira obstruer ni la réaction avec le 9 -BBN ni le couplage avec un substrat o o o Voguel, P. Chimie organique méthodes et modèles, Ed. 1, De Boeck et Lancier, Paris, 1997 Suzuki, A. J. Organomet. Chem. , 576, p. 147 -168, 1999 Brückner, R. Mécanismes réactionnels en chimie organique: méthodes synthétiques, stéréochimie et réactions modernes , Ed. 1, De Boeck Université, Paris, 1999

III Couplage C C par l'intermédiaire de métaux de transition 3. 2. 6 Conclusion sur la réaction de Suzuki o Réaction de couplage entre des vinyl et arylboranes avec halogénures de vinyles ou d'aryles o Cette réaction peut coupler des composés qui sont hautement fonctionnalisés - Cela est une particularité intéressant du couplage de Suzuki o Elle utilise Pd 0 comme catalyseur o La différence de cette réaction est l'addition d'une base Na. OH; Na. OEt; KOH ou Cs. OH Schröter, S. ; Stock, C. and Bach, T. Tetrahedron "article in press" Miyura, N. ; Suzuki, A. Chem. Rev. , 95, p. 2557 -2583, 1995 Suzuki, A. J. Organomet. Chem. , 576, p. 147 -168, 1999

III Couplage C C par l'intermédiaire de métaux de transition 3. 3 Couplages de groupes organiques liés au Zinc o Substrats ROTf, RBr, RI, où R = aryle ou alcényle + RZn. I Mécanisme - 6 étapes catalysées par Pd 0 - 1 étape supplementaire au mécanisme avec les autres metaux de transition: addition de Li. Cl o Knochel, P. ; Perea, J. J. A. and Jones, P. Tetrahedron 54, p. 8275 -8319, 1998

III Couplage C C par l'intermédiaire de métaux de transition 3. 4 Couplage de dérivé halogénés: réaction de Heck 3. 4. 1 Généralités o Alcenylation ou arylation des oléfines non-metallés à l'aide de triflates d'alcenyle ou d'aryle o Pd+2 est utilisé comme catalyseur o Des quantités stoechiométries de triéthylamine sont ajoutées aux réactifs - Pour réduire le Pd+2 Pd 0 (catalyseur actif) - pour piéger l'acide fort libéré pendant la réaction (Tf. OH; HBr ou HI) Heck, R. Accounts Chem. Res. , 12, p. 146 -151, 1979

III Couplage C C par l'intermédiaire de métaux de transition 3. 4. 2 Mécanisme Réactionnel L'agent arylant est un dérivé du benzène qui contient un bon groupe partant. Celuici est substitué par l'oléfine en donnant un produit de configuration trans q (1) Complexation (2) Addition oxydante (3) transmétallation (4) addition sélective cis du complexe arylpalladé sur la double liaison de l'acrylate de méthyle (5)Rotation autour de la liaison C-C formée (6) Elimination d'un atome d'hydrogène (7) dissociation du complexe (8) élimination réductrice

III Couplage C C par l'intermédiaire de métaux de transition 3. 4. 3 Couplage entre 2 oléfines o L'autre utilisation du couplage de Heck est avec des oléfines halogénées contenant déjà une double liaison de stéréochimie définie o Celles-ci peuvent être couplées avec des autres oléfines avec totale rétention de leurs configurations de départ Heck, R. Accounts Chem. Res. , 12, p. 146 -151, 1979 Touloup, R. Synthèse organique, Ed. 1, Polytechnica, Paris, 1994

III Couplage C C par l'intermédiaire de métaux de transition 3. 5 Couplage de dérivés stanneux: réaction de Stille 3. 5. 1 Généralité o Depuis la fin des années 1970, elle a été largement utilisée o Réaction de condensation d'un vinylétain ou alcynylétain avec des halogénures de vinyle ou d'aryle et des triflates d'enols ou de phénols o Il utilise Pd 0 comme catalyseur o Ce couplage requiert de hautes températures pour faciliter l'étape de transmetallation Scott, W. ; Crisp, G. T. ; Stille, J. K. J. Am. Chem. Soc. , 106, 4630 -32, 1984 Benhida, R. ; Lecubin, F. ; Fourrey, J. L. ; Castellanos, L. R. and Quintero, L. Tetrahedron Letters, 40, p. 5701 -5703, 1999 Clayden, J. ; Greeves, N. ; Warren, S. ; Wothers, P. Chimie organique, Ed. 1, De Boeck Diffusion, Paris, 2003

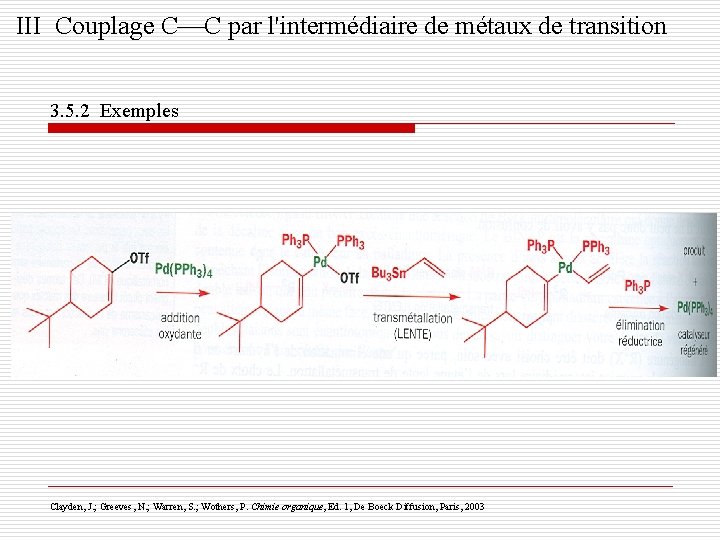
III Couplage C C par l'intermédiaire de métaux de transition 3. 5. 2 Exemples Clayden, J. ; Greeves, N. ; Warren, S. ; Wothers, P. Chimie organique, Ed. 1, De Boeck Diffusion, Paris, 2003

III Couplage C C par l'intermédiaire de métaux de transition 3. 5. 2 Exemples o L'adjonction du Li. Cl ou du Zn. Cl 2 accélère le couplage o La réaction peut s'effectuer de façon intramoléculaire avec des alcénylstannanes à la place des aryl ou vinylstannanes habituels Clayden, J. ; Greeves, N. ; Warren, S. ; Wothers, P. Chimie organique, Ed. 1, De Boeck Diffusion, Paris, 2003

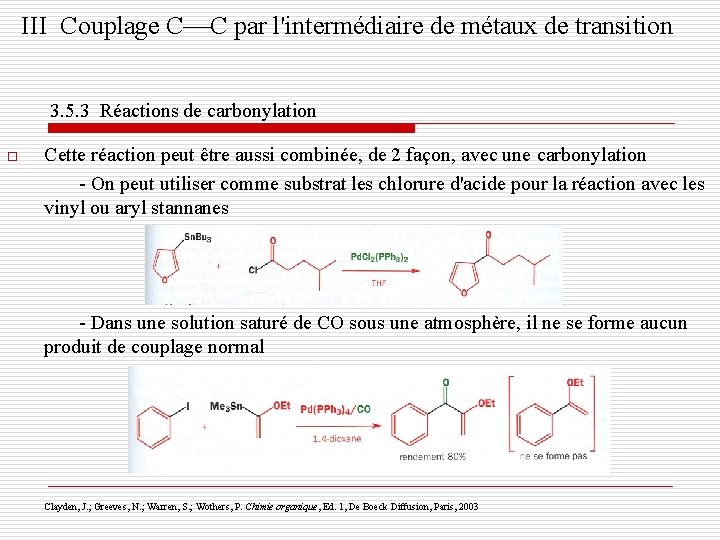
III Couplage C C par l'intermédiaire de métaux de transition 3. 5. 3 Réactions de carbonylation o Cette réaction peut être aussi combinée, de 2 façon, avec une carbonylation - On peut utiliser comme substrat les chlorure d'acide pour la réaction avec les vinyl ou aryl stannanes - Dans une solution saturé de CO sous une atmosphère, il ne se forme aucun produit de couplage normal Clayden, J. ; Greeves, N. ; Warren, S. ; Wothers, P. Chimie organique, Ed. 1, De Boeck Diffusion, Paris, 2003

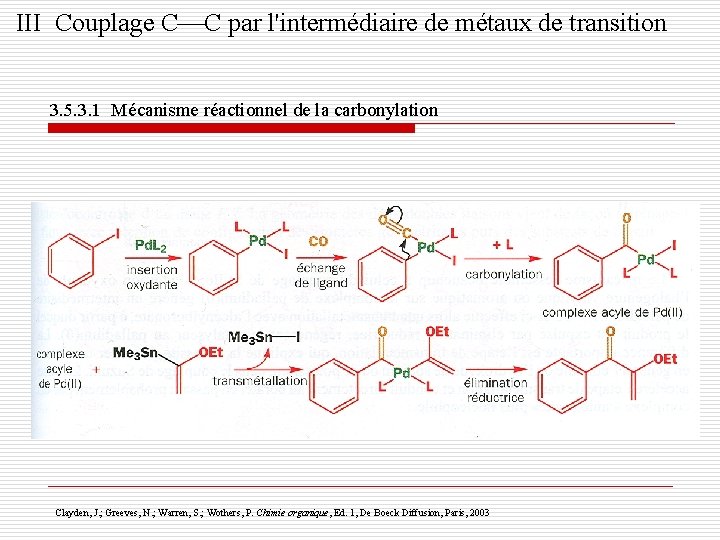
III Couplage C C par l'intermédiaire de métaux de transition 3. 5. 3. 1 Mécanisme réactionnel de la carbonylation Clayden, J. ; Greeves, N. ; Warren, S. ; Wothers, P. Chimie organique, Ed. 1, De Boeck Diffusion, Paris, 2003

III Couplage C C par l'intermédiaire de métaux de transition 3. 6 Reaction de couplage de Sonogashira Clayden, J. ; Greeves, N. ; Warren, S. ; Wothers, P. Chimie organique, Ed. 1, De Boeck Diffusion, Paris, 2003 Amatore, C. ; Bensalem, S. ; Ghalem, S. ; Jutand, A. and Medjour, Y. Eur. J. Org. Chem. , p. 366 -371, 2004 Thorand, S. and Krause, N. J. Org. Chem. , 63, p. 8551 -8553, 1998 Le couplage des alcynes terminaux avec les halogénures vinyliques ou aryliques Ce processus catalytique nécessite un complexe de Pd 0 Il s'effectue en présence d'une base et utilise Cu. I comme co-catalyseur Les conditions douces employées, souvent TA, permet d'utiliser des substrat sensible à la chaleur L'addition oxydante de l'halogénure donne un intermédiaire de Pd+2 qu'effectue une transmétallation avec l'alcynylcuivre L'élimination réductrice avec couplage des 2 ligands organiques donne le produit et régénère le catalyseur La géométrie de l'alcène est conservée

III Couplage C C par l'intermédiaire de métaux de transition 3. 7 Réaction de couplage de Negishi o Couplage entre aryl ou benzylzincique avec des dérivé arylhalydes o Catalyseurs: Ni 0 ou Pd 0 o Chimio et régioséléctif o Les conditions réactionnelles sont douces Negishi, E. ; King, A. ; Okukado, N. J. Org. Chem. , vol. 42, n. 10, p. 1821 -1823, 1977 Yus, M. and Gomis, J. Tetrahedron Lett. , 42, p. 5721 -5724, 2001

IV Bibliographie o o o o o o Blakemore, P. R. J. Chem. Perkin Trans. 1, p. 2563 -2585, 2002 Alonso, D. A. ; Najera, C. ; Varea, M. Tetrahedron Lett. , 45, 573 -577, 2004 Charrette, A. ; Berthelette, C. ; St-Martin, D. Tetrahedron Letters, 42, 5149 -5153, 2001 Shah, S. and Protasiewicz, J. D. Coord. Chem. Rev. , 210, p. 181 -201, 2000 Brückner, R. Mécanismes réactionnels en chimie organique: méthodes synthètiques, stéréochimie et réactions modernes, Ed. 1, De Boeck Université, Paris, 1999. Traduit de Reaktionmechanismen: organische reaktionen, stereochemie, moderne synthesemethoden, 1999 Boutagy, J. and Thomas, R. Chem. Rev. , 74, 1, 87 -99, 1974 Wadsworth, W. J. and Emmons, W. J. Am. Chem. Soc. , 83, 1733 -1738, 1961 Clayden, J. ; Greeves, N. ; Warren, S. ; Wothers, P. Chimie organique, Ed. 1, De Boeck Diffusion, Paris, 2003. Traduit de l'anglais Organic chemistry, Ed. 1, Oxford University Press, 2001. Voguel, P. Chimie organique méthodes et modèles, Ed. 1, De Boeck et Lancier, Paris, 1997 Touloup, R. Synthèse organique, Ed. 1, Polytechnica, Paris, 1994 Darviche, F. ; Babonneau, M. T. ; Cristau, H. J. ; Torreilles, E. ; Fabre, J. M. Synthetic Metals 102, p. 1662 -65, 1999 Schröter, S. ; Stock, C. and Bach, T. Tetrahedron "article in press" Miyura, N. ; Suzuki, A. Chem. Rev. , 95, p. 2557 -2583, 1995 Suzuki, A. J. Organomet. Chem. , 576, p. 147 -168, 1999 Knochel, P. ; Perea, J. J. A. and Jones, P. Tetrahedron 54, p. 8275 -8319, 1998 Heck, R. Accounts Chem. Res. , 12, p. 146 -151, 1979 Scott, W. ; Crisp, G. T. ; Stille, J. K. J. Am. Chem. Soc. , 106, 4630 -32, 1984 Benhida, R. ; Lecubin, F. ; Fourrey, J. L. ; Castellanos, L. R. and Quintero, L. Tetrahedron Letters, 40, p. 5701 -5703, 1999 Amatore, C. ; Bensalem, S. ; Ghalem, S. ; Jutand, A. and Medjour, Y. Eur. J. Org. Chem. , p. 366 -371, 2004 Thorand, S. and Krause, N. J. Org. Chem. , 63, p. 8551 -8553, 1998 Negishi, E. ; King, A. ; Okukado, N. J. Org. Chem. , vol. 42, n. 10, p. 1821 -1823, 1977 Yus, M. and Gomis, J. Tetrahedron Lett. , 42, p. 5721 -5724, 2001
 Facult
Facult College jules verne carcassonne
College jules verne carcassonne Cesta na mesiac jules verne obsah
Cesta na mesiac jules verne obsah Collège jules verne neuville en ferrain
Collège jules verne neuville en ferrain Ent jules verne neuville en ferrain
Ent jules verne neuville en ferrain Jules verne famous books
Jules verne famous books Jules verne scifi
Jules verne scifi Picardie
Picardie Pharmacie
Pharmacie Esther kellenberger
Esther kellenberger Faculté de médecine constantine cours
Faculté de médecine constantine cours Scolarite medecine nantes
Scolarite medecine nantes Pharmacie beaujon
Pharmacie beaujon Pharmacie.univ-batna2
Pharmacie.univ-batna2 Pharmacie gamma lausanne laboratoire
Pharmacie gamma lausanne laboratoire Coursif
Coursif Gyneas pessaire cube remboursement
Gyneas pessaire cube remboursement Procedure chaine du froid pharmacie
Procedure chaine du froid pharmacie Faculté de pharmacie monastir
Faculté de pharmacie monastir Pharmacie hippocrate sousse
Pharmacie hippocrate sousse Scolarité médecine nantes
Scolarité médecine nantes Celestene betamethasone gouttes
Celestene betamethasone gouttes Manicol pharmacie
Manicol pharmacie Aleler
Aleler Ann letellier chercheuse
Ann letellier chercheuse Université vasile alecsandri de bacau
Université vasile alecsandri de bacau Université dunărea de jos
Université dunărea de jos üniversite harf notu
üniversite harf notu Claroline université lyon 1
Claroline université lyon 1 Centre universitaire nour el bachir el bayadh
Centre universitaire nour el bachir el bayadh Manuele
Manuele Gebze anadolu lisesi üniversite başarısı
Gebze anadolu lisesi üniversite başarısı Université de la princesse noura bint abdulrahman
Université de la princesse noura bint abdulrahman Gümüşhane üni dbs
Gümüşhane üni dbs Université paris 1
Université paris 1 Larsh uphf
Larsh uphf Faculté de medecine constantine 3
Faculté de medecine constantine 3 Slidetodoc.com
Slidetodoc.com Universite de geneve
Universite de geneve Rainer hasiba orf
Rainer hasiba orf Université mentouri constantine biologie
Université mentouri constantine biologie Nanterre université plan
Nanterre université plan Erasmus uae
Erasmus uae