TEMA 5 PROTENAS 1 AMINOCIDOS ESTRUCTURA CARACTERSTICAS Son






- Slides: 18

TEMA 5 PROTEÍNAS

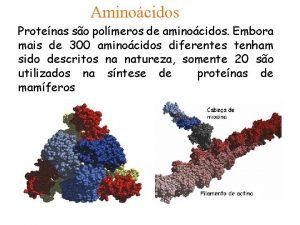
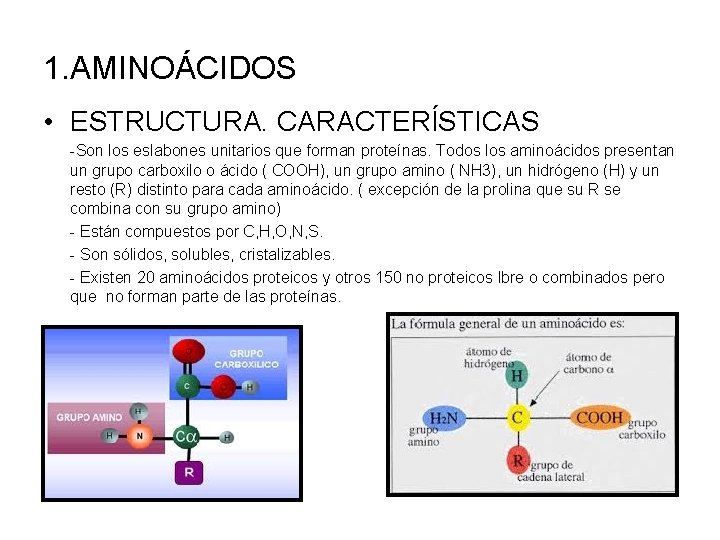
1. AMINOÁCIDOS • ESTRUCTURA. CARACTERÍSTICAS -Son los eslabones unitarios que forman proteínas. Todos los aminoácidos presentan un grupo carboxilo o ácido ( COOH), un grupo amino ( NH 3), un hidrógeno (H) y un resto (R) distinto para cada aminoácido. ( excepción de la prolina que su R se combina con su grupo amino) - Están compuestos por C, H, O, N, S. - Son sólidos, solubles, cristalizables. - Existen 20 aminoácidos proteicos y otros 150 no proteicos lbre o combinados pero que no forman parte de las proteínas.

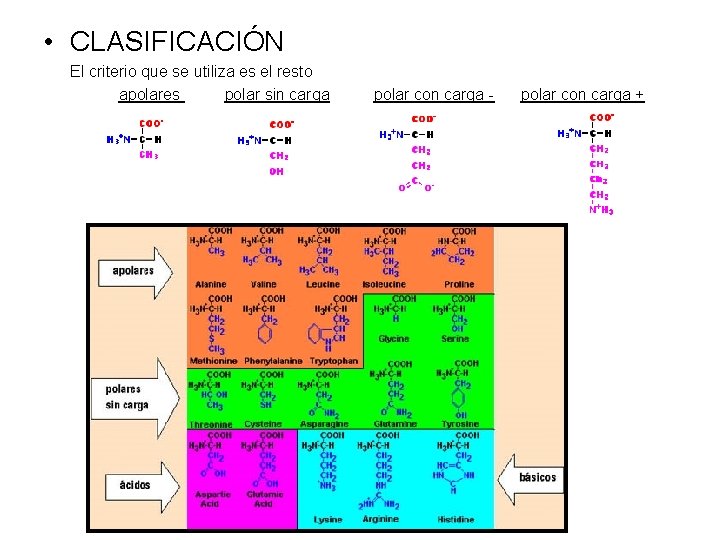
• CLASIFICACIÓN El criterio que se utiliza es el resto apolares polar sin carga polar con carga - polar con carga +

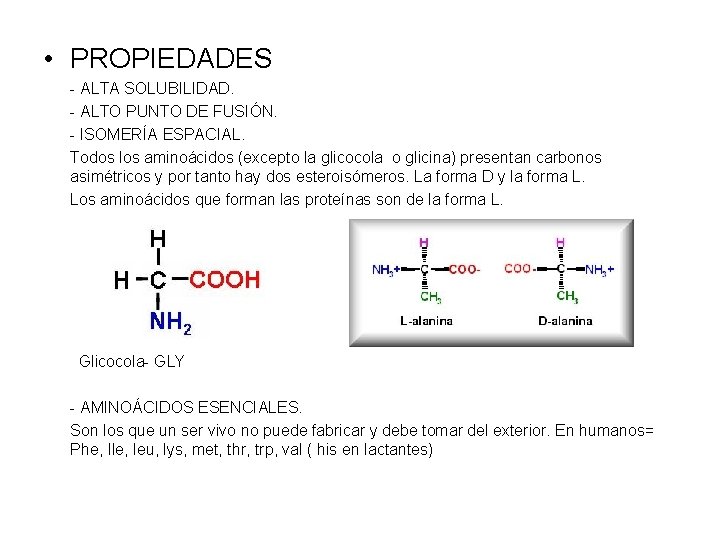
• PROPIEDADES - ALTA SOLUBILIDAD. - ALTO PUNTO DE FUSIÓN. - ISOMERÍA ESPACIAL. Todos los aminoácidos (excepto la glicocola o glicina) presentan carbonos asimétricos y por tanto hay dos esteroisómeros. La forma D y la forma L. Los aminoácidos que forman las proteínas son de la forma L. Glicocola- GLY - AMINOÁCIDOS ESENCIALES. Son los que un ser vivo no puede fabricar y debe tomar del exterior. En humanos= Phe, Ile, leu, lys, met, thr, trp, val ( his en lactantes)

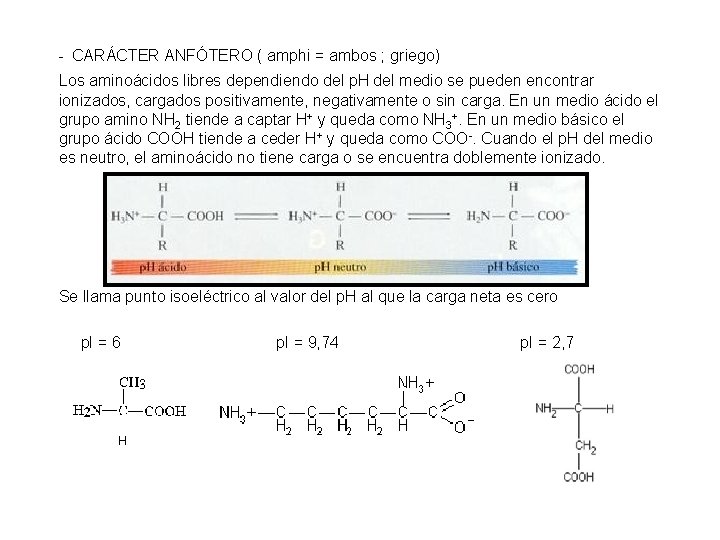
- CARÁCTER ANFÓTERO ( amphi = ambos ; griego) Los aminoácidos libres dependiendo del p. H del medio se pueden encontrar ionizados, cargados positivamente, negativamente o sin carga. En un medio ácido el grupo amino NH 2 tiende a captar H+ y queda como NH 3+. En un medio básico el grupo ácido COOH tiende a ceder H+ y queda como COO-. Cuando el p. H del medio es neutro, el aminoácido no tiene carga o se encuentra doblemente ionizado. Se llama punto isoeléctrico al valor del p. H al que la carga neta es cero p. I = 6 p. I = 9, 74 p. I = 2, 7

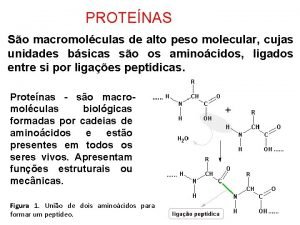
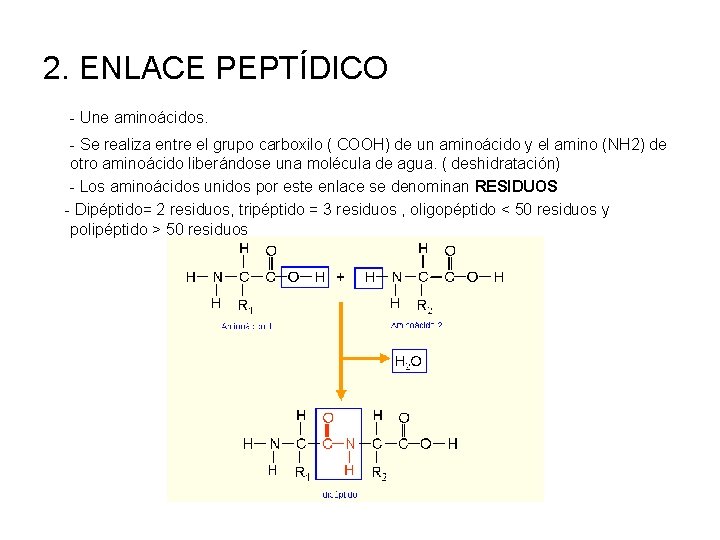
2. ENLACE PEPTÍDICO - Une aminoácidos. - Se realiza entre el grupo carboxilo ( COOH) de un aminoácido y el amino (NH 2) de otro aminoácido liberándose una molécula de agua. ( deshidratación) - Los aminoácidos unidos por este enlace se denominan RESIDUOS - Dipéptido= 2 residuos, tripéptido = 3 residuos , oligopéptido < 50 residuos y polipéptido > 50 residuos

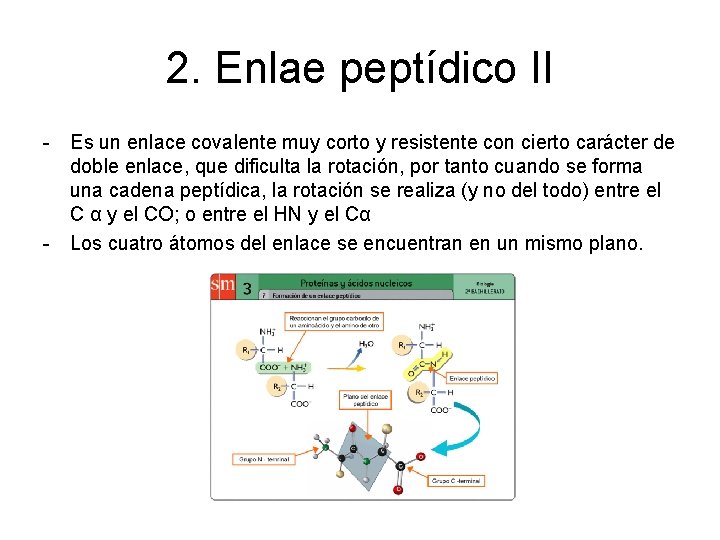
2. Enlae peptídico II - Es un enlace covalente muy corto y resistente con cierto carácter de doble enlace, que dificulta la rotación, por tanto cuando se forma una cadena peptídica, la rotación se realiza (y no del todo) entre el C α y el CO; o entre el HN y el Cα - Los cuatro átomos del enlace se encuentran en un mismo plano.

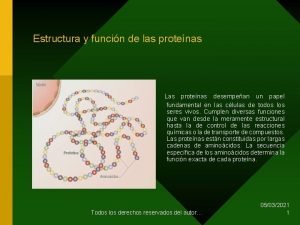
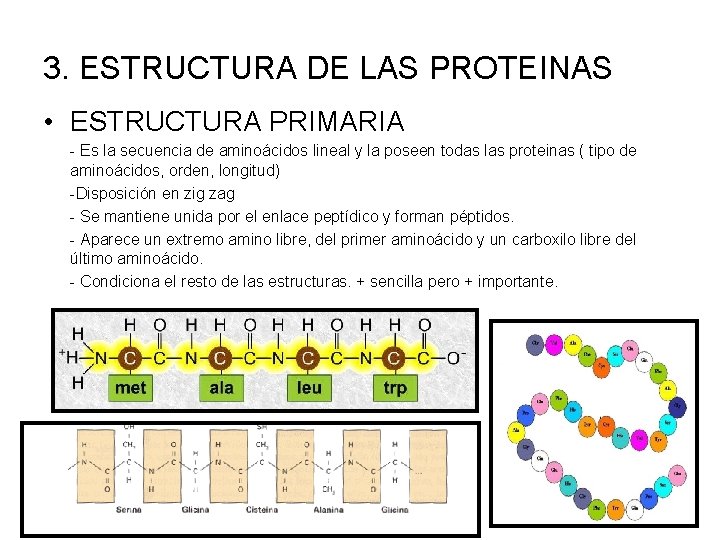
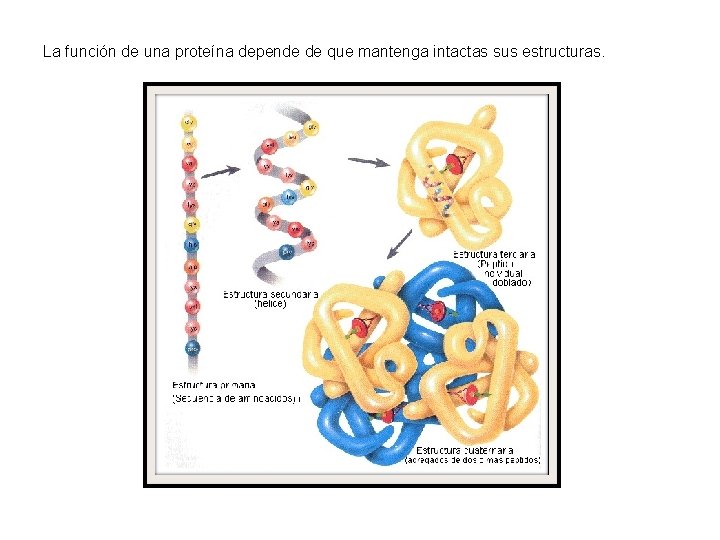
3. ESTRUCTURA DE LAS PROTEINAS • ESTRUCTURA PRIMARIA - Es la secuencia de aminoácidos lineal y la poseen todas las proteinas ( tipo de aminoácidos, orden, longitud) -Disposición en zig zag - Se mantiene unida por el enlace peptídico y forman péptidos. - Aparece un extremo amino libre, del primer aminoácido y un carboxilo libre del último aminoácido. - Condiciona el resto de las estructuras. + sencilla pero + importante.

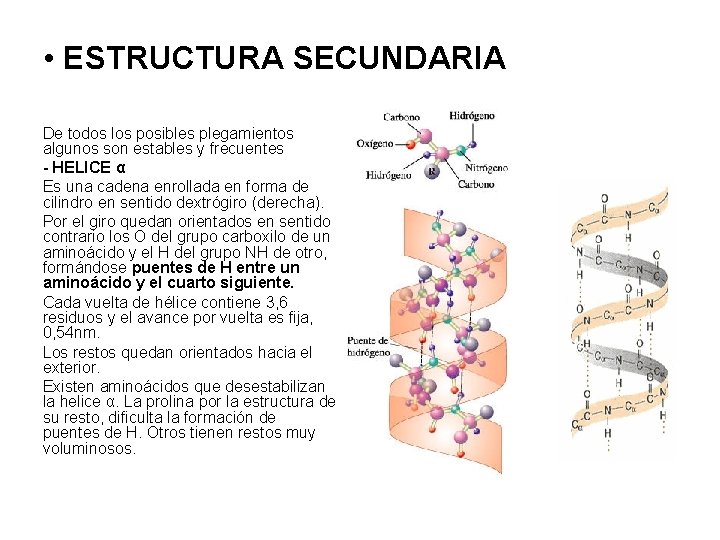
• ESTRUCTURA SECUNDARIA De todos los posibles plegamientos algunos son estables y frecuentes - HELICE α Es una cadena enrollada en forma de cilindro en sentido dextrógiro (derecha). Por el giro quedan orientados en sentido contrario los O del grupo carboxilo de un aminoácido y el H del grupo NH de otro, formándose puentes de H entre un aminoácido y el cuarto siguiente. Cada vuelta de hélice contiene 3, 6 residuos y el avance por vuelta es fija, 0, 54 nm. Los restos quedan orientados hacia el exterior. Existen aminoácidos que desestabilizan la helice α. La prolina por la estructura de su resto, dificulta la formación de puentes de H. Otros tienen restos muy voluminosos.

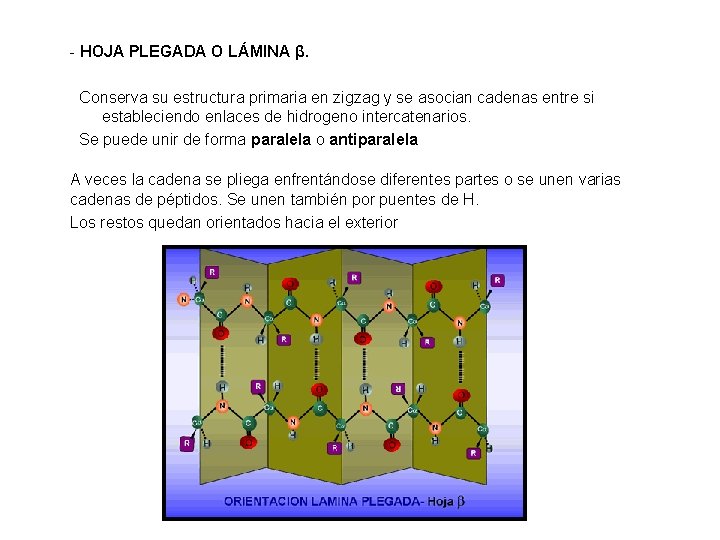
- HOJA PLEGADA O LÁMINA β. Conserva su estructura primaria en zigzag y se asocian cadenas entre si estableciendo enlaces de hidrogeno intercatenarios. Se puede unir de forma paralela o antiparalela A veces la cadena se pliega enfrentándose diferentes partes o se unen varias cadenas de péptidos. Se unen también por puentes de H. Los restos quedan orientados hacia el exterior

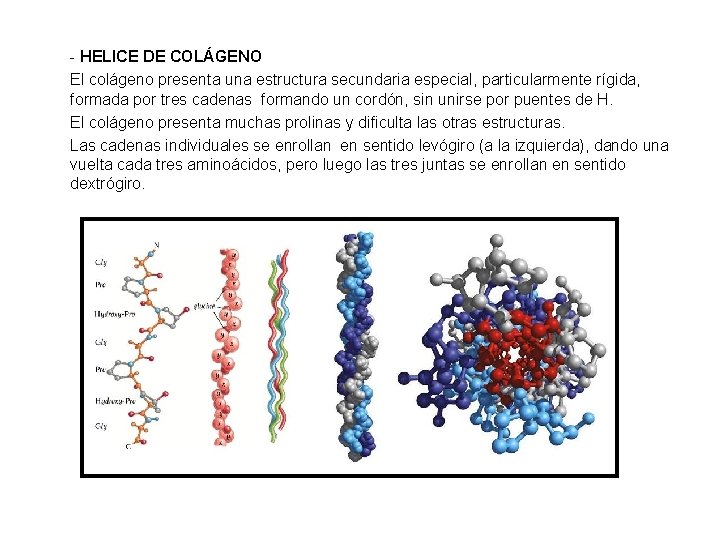
- HELICE DE COLÁGENO El colágeno presenta una estructura secundaria especial, particularmente rígida, formada por tres cadenas formando un cordón, sin unirse por puentes de H. El colágeno presenta muchas prolinas y dificulta las otras estructuras. Las cadenas individuales se enrollan en sentido levógiro (a la izquierda), dando una vuelta cada tres aminoácidos, pero luego las tres juntas se enrollan en sentido dextrógiro.

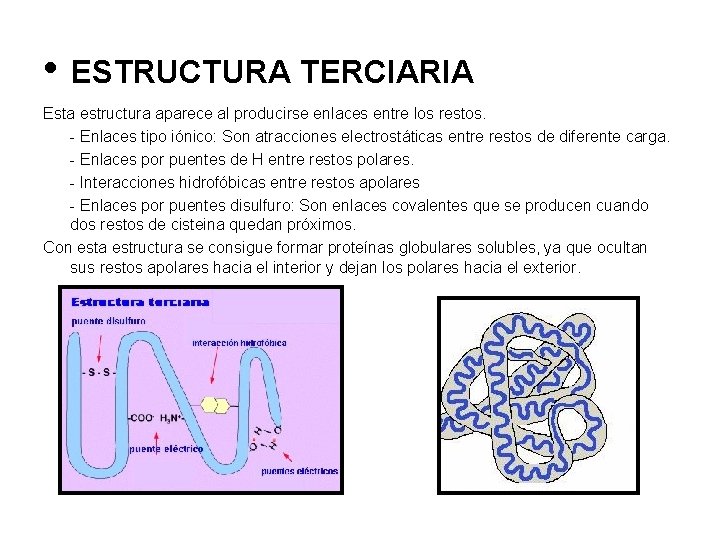
• ESTRUCTURA TERCIARIA Esta estructura aparece al producirse enlaces entre los restos. - Enlaces tipo iónico: Son atracciones electrostáticas entre restos de diferente carga. - Enlaces por puentes de H entre restos polares. - Interacciones hidrofóbicas entre restos apolares - Enlaces por puentes disulfuro: Son enlaces covalentes que se producen cuando dos restos de cisteina quedan próximos. Con esta estructura se consigue formar proteínas globulares solubles, ya que ocultan sus restos apolares hacia el interior y dejan los polares hacia el exterior.

• ESTRUCTURA CUATERNARIA Se realiza al unirse varias cadenas polipeptídicas, que presentan estructura terciaria, llamadas subunidades o monómeros. Se unen por enlaces entre restos, del mismo tipo que mantienen la estructura terciaria. ( pte. Hidrógeno, fuerzas Van der Waals o ptes. Disulfuro) La importancia de esta estructura es que disminuye el efecto de error en la síntesis. Así si una subunidad es defectuosa, se cambia y no es necesario cambiar toda la proteína. Las subunidades pueden ser diferentes o repetidas, como ocurre con la hemoglobina que posee 4 subunidades dos α y dos β. En este caso se produce una economía de ADN ya que sólo necesitan dos genes.

La función de una proteína depende de que mantenga intactas sus estructuras.

4. PROPIEDADES • DESNATURALIZACIÓN - Son los cambios en la estructura de la proteína y por tanto la perdida de su función. Se pierden la 4º, 3º, 2º, pero raramente la 1º. Se altera su solubilidad y puede precipitar. - Causas: Físicas: temperatura, presión, radiación. Químicas: p. H, iones, disolventes orgánicos ( urea) - Si los cambios son poco intensos, se puede dar la renaturalización. - Al perder la estructura 3ª, los restos hidrófobos que estaban ocultos en el interior, dejando de ser soluble y provocando una agregación que conduce a la precipitación.

• ESPECIFICIDAD -Especificidad de función: Depende de la estructura primaria de la proteína que condiciona la estructura cuaternaria. Asi que la secuencia de aminoácidos es la responsable de la función última de la proteína. -Especificidad de especie: Las proteínas son específicas de cada ser vivo. Las proteínas con igual función en especies próximas son parecidas y varían en pocos aminoácidos. Estas proteínas se llaman proteínas homologas Hemoglobina de gorila y humano sólo se diferencian en un aminoácido. Esto es la causa del rechazo en los trasplantes. • SOLUBILIDAD - Las proteínas fibrosas son insolubles. - Las proteínas globulares son solubles, ya que los restos apolares de los aminoácidos quedan ocultos en la estructura 3ª y los polares periféricos reaccionan con el agua.

5. CLASIFICACIÓN • HOLOPROTEÍNAS. - Formadas sólo por aminoácidos. - Proteínas fibrosas o escleroproteínas. Alcanzan estructura 2ª, insolubles y resistentes. Colágeno, elastina, queratina, fibrina, miosina - Proteínas globulares o esferoproteínas. Alcanzan estructura 3ª y generalmente solubles. Albúmina, globulinas, histonas, protaminas ( asociadas al ADN) • HETEROPROTEINAS - Formadas por un grupo proteico( aminoácidos) y un g. prostético( distinto de aa). - Glucoproteínas: G. prostético un azucar. Inmunoglobulinas. - Lipoproteínas: G: prostético un lípido. LDL, HDL. - Nucleoproteínas: G. prostético un ácido nucleico. Histonas unido a ADN. - Cromoproteínas: G. prostético una sustancia coloreada. Hemoglobina, mioglobina. - Fosfoproteínas: G. prostético un ácido fosfórico. Caseína.

6. FUNCIONES • • • ESTRUCTURAL. En la membrana plasmática, citoesqueleto, colágeno. TRANSPORTE. Hemoglobina ( transporta oxígeno) citocromos ( electrones), lipoproteínas (lípidos) HORMONAL. Insulina ( glucosa) hormona del crecimiento, adrenalina, tiroxina. MOVIMIENTO. Actina y miosina (contracción muscular), tubulina y actina (cilios y flagelos) PROTECTORA. Inmunoglobulinas ( anticuerpos), mucina (revestimiento). ENZIMÁTICA. Las enzimas son proteínas que catalizan las reacciones. Deshidrogenasa. HOMEOSTÁTICA. Regulan los procesos fisiológicos, mantienen el p. H, equilibrio osmótico. RECEPTORA. Proteínas de la membrana que realizan el papel de reconocimiento. Proteina G RESERVA. Ovoalbúmina, lactoalbúmina, caseina.
 Caractersticas
Caractersticas So
So Proteinas monomericas
Proteinas monomericas Proteinas funcion en el organismo
Proteinas funcion en el organismo Interacciones que estabilizan la estructura terciaria
Interacciones que estabilizan la estructura terciaria Protenas
Protenas Protenas
Protenas Protenas
Protenas Cromoproteínas porfirínicas
Cromoproteínas porfirínicas Protenas
Protenas Protenas
Protenas Estructura quimica general de los aminoacidos
Estructura quimica general de los aminoacidos Protenas
Protenas Tema-tema teologi perjanjian lama
Tema-tema teologi perjanjian lama El tema y sub tema
El tema y sub tema Tipos de entrevista psicológica
Tipos de entrevista psicológica Aliran seni lukis tertua di dunia adalah
Aliran seni lukis tertua di dunia adalah Delimitación de un proyecto de tesis ejemplo
Delimitación de un proyecto de tesis ejemplo Plantas superiores o fanerogamas
Plantas superiores o fanerogamas