Spcificits pdiatriques Epilepsies Nadine Girard Hpital Timone Marseille








- Slides: 23

Spécificités pédiatriques Epilepsies Nadine Girard Hôpital Timone Marseille France 2008

Epilepsies de l’enfant • • Pathologie fréquente Seuil épileptogène abaissé Formes bénignes communes Causes constitutionnelles, ou pathologies périnatales • Manifestations âge-dépendantes, donc évolutives • Effets néfastes de l’épilepsie sur le développement • Effet des drogues sur le comportement

Techniques IRM • Identiques à l’adulte • Protocole minimum: T 2 axial (coronal), Flair et IR coronal, 3 D-FT. Gadolinium au besoin • Séquences complémentaires: T 2*EG, T 1 TM, diffusion • IRM doit être répétée – Après chaque avancée technique – D’autant que les explorations précédentes sont considérées normales

Techniques IRM enfant • Anesthésie chez le petit enfant ou non coopérant: IRM n’est pas réellement non invasive • Les paramètres des séquences IRM doivent être adaptées à l’âge de l’enfant car la composition physicochimique affecte le signal IRM: T 2 • Entre la naissance et l’adolescence la composition physicochimique du parenchyme change (maturation) avec évolution des images en fonction de l’âge: les anomalies IRM changent donc aussi avec le développement • Signification des images FLAIR est incertaine avant 3 -4 ans

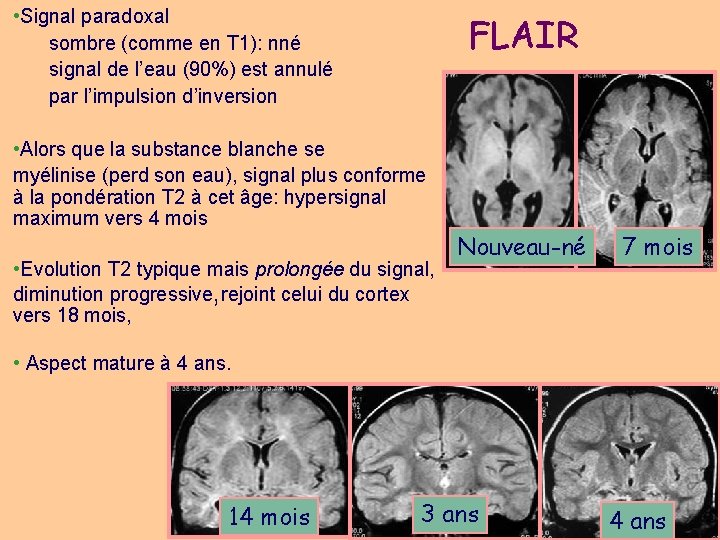
• Signal paradoxal sombre (comme en T 1): nné signal de l’eau (90%) est annulé par l’impulsion d’inversion FLAIR • Alors que la substance blanche se myélinise (perd son eau), signal plus conforme à la pondération T 2 à cet âge: hypersignal maximum vers 4 mois • Evolution T 2 typique mais prolongée du signal, diminution progressive, rejoint celui du cortex vers 18 mois, Nouveau-né 7 mois • Aspect mature à 4 ans. 14 mois 3 ans 4 ans

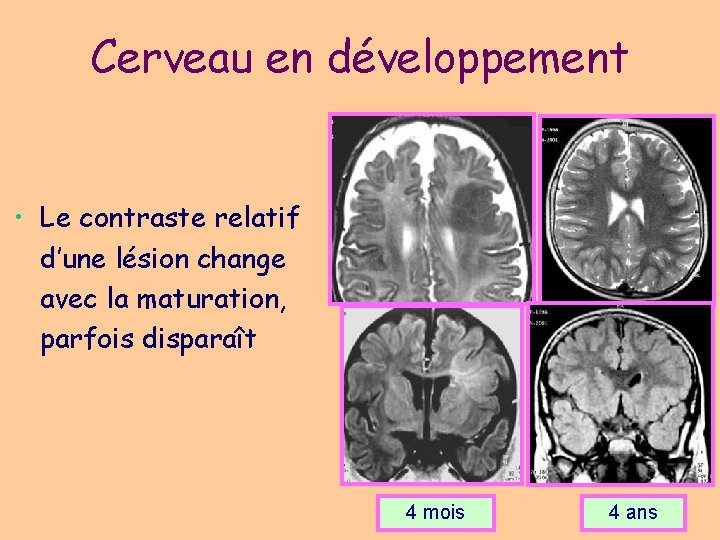
Cerveau en développement • Le contraste relatif d’une lésion change avec la maturation, parfois disparaît 4 mois 4 ans

IRM de l’enfant épileptique • Le signal exprime le signal de la maturation que dans les cas normaux • Plus ambigu dans les cas pathologiques – Hyper T 2: retard ou anomalies de myélinisation, gliose, oedème, dysplasie – Hypo T 2: avance de myélinisation, minéralisation, lésion très compacte et cellulaire

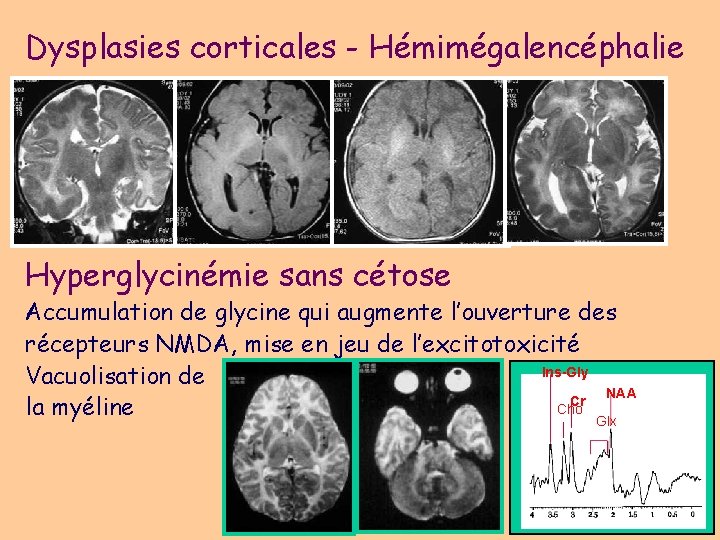
Syndromes période néonatale • Crises néonatales familiales bénignes • Crises néonatales bénignes idiopathiques (convulsions du 5ème jour) • Crises symptomatiques – Encéphalopathie infantile épileptique précoce (EIEP) avec tracé de supression-burst (syndrome d ’Ohtahara) : anomalies structurelles du SNC (malformations) – encéphalopathie myoclonique précoce (néonatale) (EMP ou EMN) : maladies métaboliques (hyperglycinémie sans cétose)

Dysplasies corticales - Hémimégalencéphalie Hyperglycinémie sans cétose Accumulation de glycine qui augmente l’ouverture des récepteurs NMDA, mise en jeu de l’excitotoxicité Ins-Gly Vacuolisation de NAA Cr Cho la myéline Glx

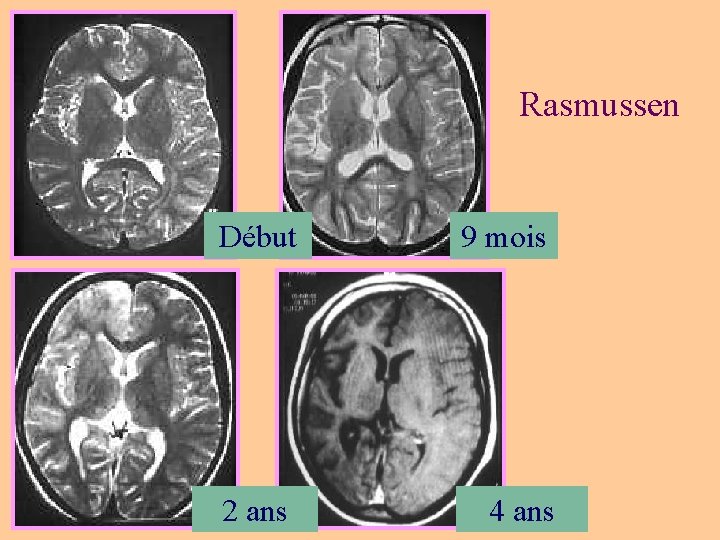
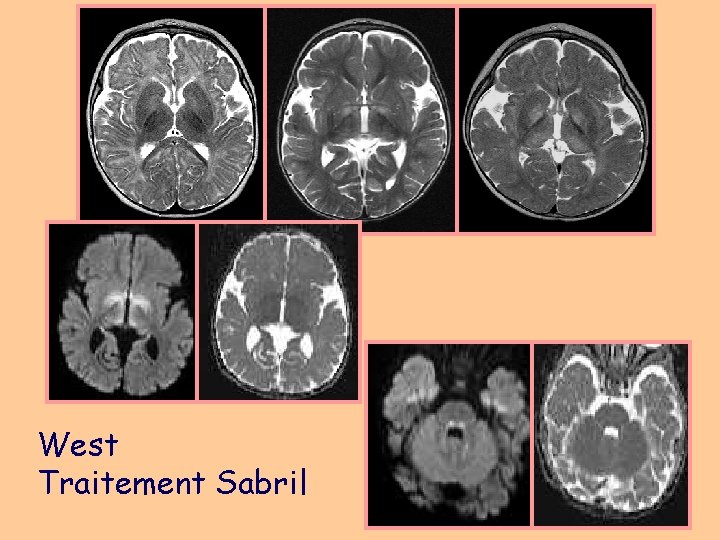
Épilepsies spécifiques à l’enfant • West: spasme infantile, hypsarythmies (Bourneville +++) • Lennox-Gastaud (séquelles, malformations du cortex) • État de mal épileptique unilatéral: syndromes HH (hemiatrophy-hemiplegia), HHE (HH epilepsy) • Épilepsies catastrophiques : hemimégalencéphalie, Stürge. Weber, Rasmussen (épilepsie unilatérale) • Hamartome Hypothalamique: crises gélastiques • Épilepsies myocloniques : – maladies métaboliques (i. e céroïde lipofuscinose), – EM sévère (convulsions fébriles et non fébriles, syndrome de Dravet, imagerie normale) • Syndrome de Landau-Kleffner (aphasie): imagerie normale

Rasmussen Début 9 mois 2 ans 4 ans

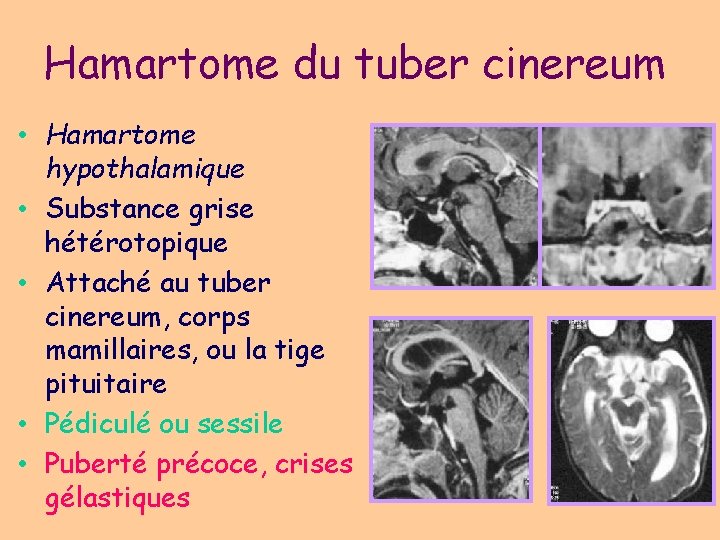
Hamartome du tuber cinereum • Hamartome hypothalamique • Substance grise hétérotopique • Attaché au tuber cinereum, corps mamillaires, ou la tige pituitaire • Pédiculé ou sessile • Puberté précoce, crises gélastiques

West Traitement Sabril

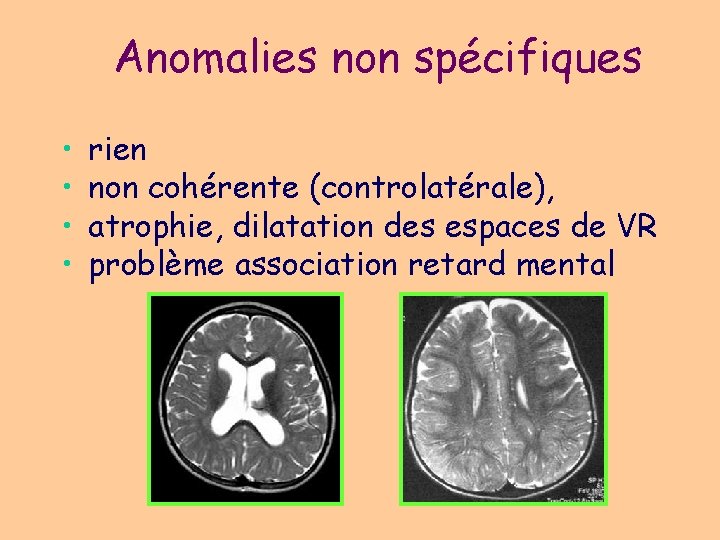
Anomalies non spécifiques • • rien non cohérente (controlatérale), atrophie, dilatation des espaces de VR problème association retard mental

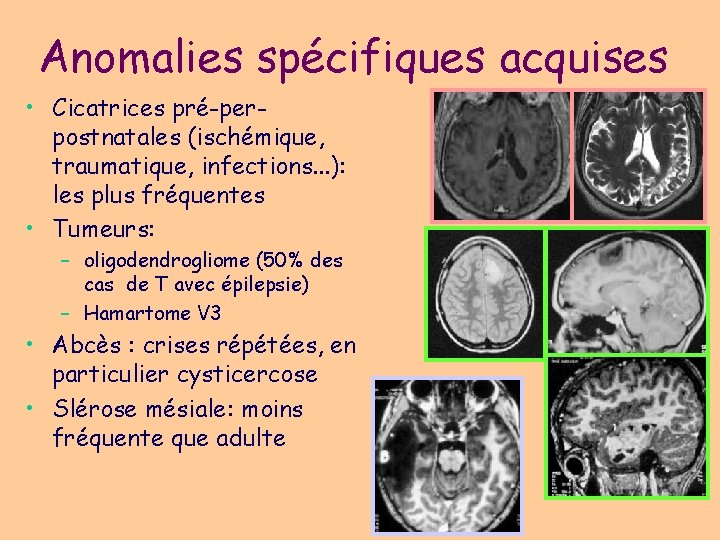
Anomalies spécifiques acquises • Cicatrices pré-perpostnatales (ischémique, traumatique, infections. . . ): les plus fréquentes • Tumeurs: – oligodendrogliome (50% des cas de T avec épilepsie) – Hamartome V 3 • Abcès : crises répétées, en particulier cysticercose • Slérose mésiale: moins fréquente que adulte

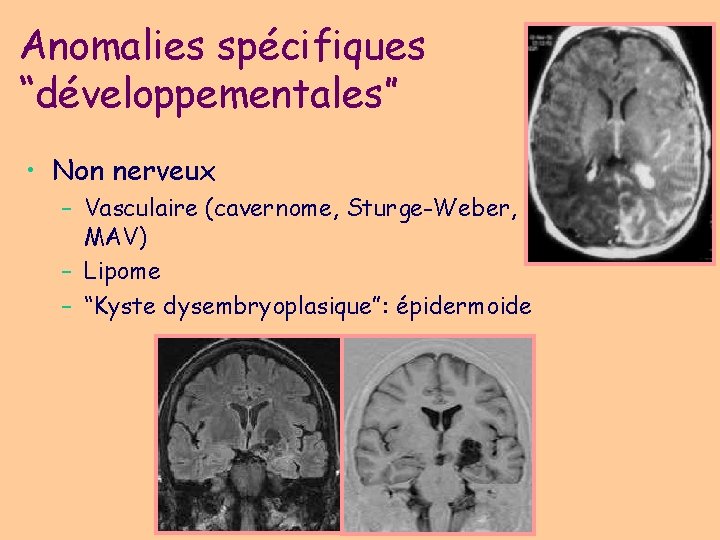
Anomalies spécifiques “développementales” • Non nerveux – Vasculaire (cavernome, Sturge-Weber, MAV) – Lipome – “Kyste dysembryoplasique”: épidermoide

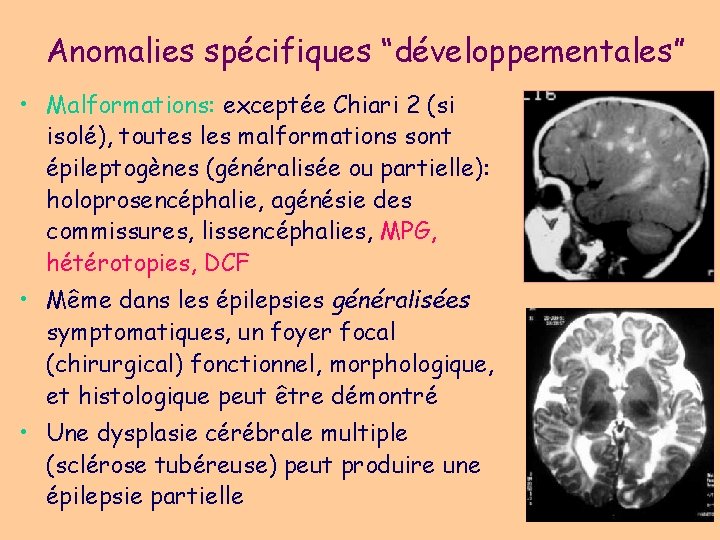
Anomalies spécifiques “développementales” • Malformations: exceptée Chiari 2 (si isolé), toutes les malformations sont épileptogènes (généralisée ou partielle): holoprosencéphalie, agénésie des commissures, lissencéphalies, MPG, hétérotopies, DCF • Même dans les épilepsies généralisées symptomatiques, un foyer focal (chirurgical) fonctionnel, morphologique, et histologique peut être démontré • Une dysplasie cérébrale multiple (sclérose tubéreuse) peut produire une épilepsie partielle

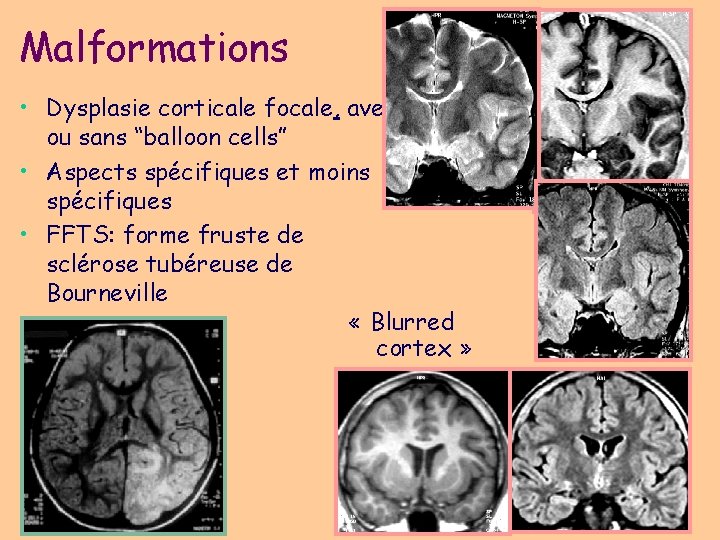
Malformations • Dysplasie corticale focale, avec ou sans “balloon cells” • Aspects spécifiques et moins spécifiques • FFTS: forme fruste de sclérose tubéreuse de Bourneville « Blurred cortex »

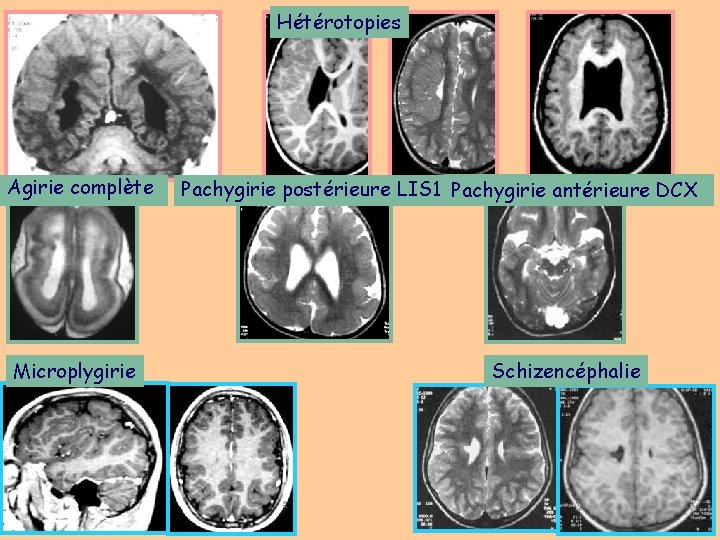
Hétérotopies Agirie complète Microplygirie Pachygirie postérieure LIS 1 Pachygirie antérieure DCX Schizencéphalie

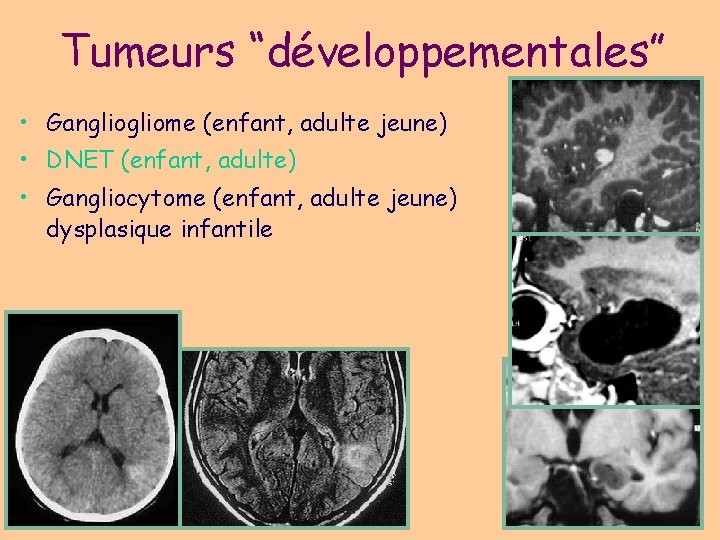
Tumeurs “développementales” • Gangliome (enfant, adulte jeune) • DNET (enfant, adulte) • Gangliocytome (enfant, adulte jeune) dysplasique infantile

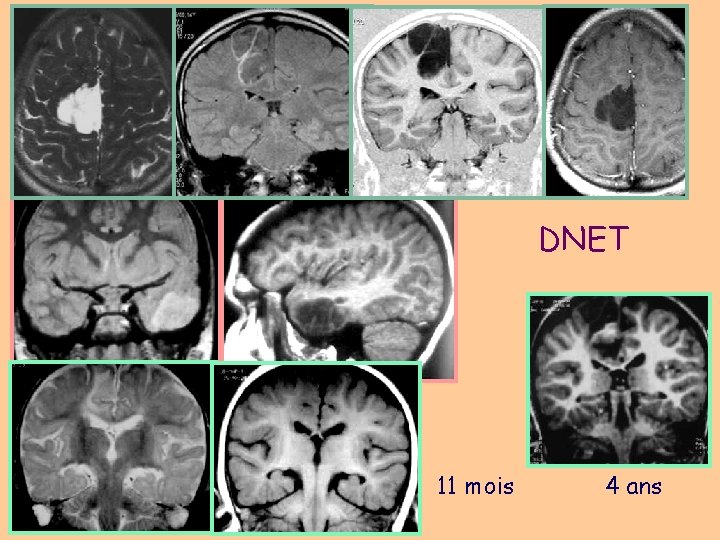
DNET 11 mois 4 ans

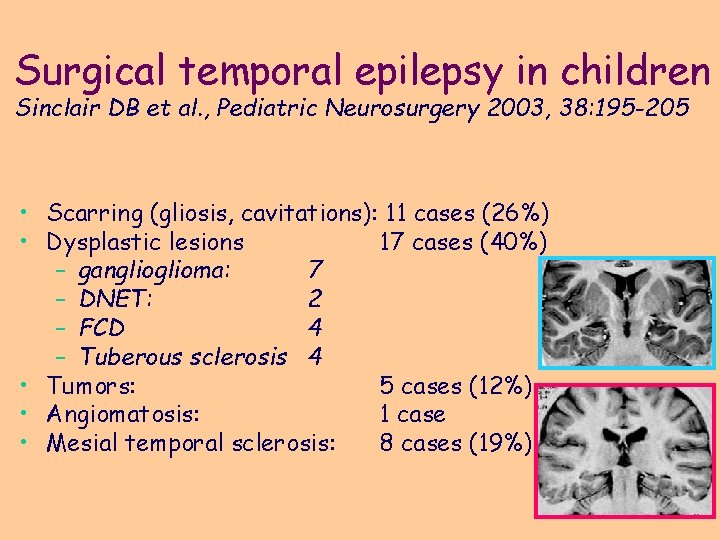
Surgical temporal epilepsy in children Sinclair DB et al. , Pediatric Neurosurgery 2003, 38: 195 -205 • Scarring (gliosis, cavitations): 11 cases (26%) • Dysplastic lesions 17 cases (40%) – ganglioma: 7 – DNET: 2 – FCD 4 – Tuberous sclerosis 4 • Tumors: 5 cases (12%) • Angiomatosis: 1 case • Mesial temporal sclerosis: 8 cases (19%)

Conclusions • IRM: – Identification de groupes cohérents de malformations – Contribution pour aider à l’identification de gènes responsables de ces malformations • Intérêt de l’IRM haute résolution: anomalie subtile du cortex et/ou substance blanche • Neuroradiologie moderne: – Volumétrie – Haut champ: 3 T, augmentation résolution – Spectroscopie – Connectivité: diffusion tractographie – Cortex mapping Bernasconi Neuroimag Clin N Am 2004
 Pachygirie
Pachygirie Timone compensato
Timone compensato Nutrition entérale
Nutrition entérale Bruce girard
Bruce girard Dull revenge meaning
Dull revenge meaning Tommy girard
Tommy girard Carroll girard screw
Carroll girard screw Dr bruno girard
Dr bruno girard Bruno girard inspecteur
Bruno girard inspecteur Didier girard sfeir
Didier girard sfeir Terre ouverte aix marseille
Terre ouverte aix marseille Polarisation
Polarisation Ifsi croix rouge marseille
Ifsi croix rouge marseille Marchespublics.mairie-marseille.fr
Marchespublics.mairie-marseille.fr Terre ouverte aix marseille
Terre ouverte aix marseille Terre ouverte aix marseille
Terre ouverte aix marseille Terre ouverte aix marseille
Terre ouverte aix marseille Terre ouverte aix marseille
Terre ouverte aix marseille La chrysalide marseille
La chrysalide marseille Canal de provence carte
Canal de provence carte Iprofessionnel marseille
Iprofessionnel marseille Terre ouverte aix marseille
Terre ouverte aix marseille Terre ouverte aix marseille
Terre ouverte aix marseille Casnav marseille
Casnav marseille