Sclrose en plaques et autres maladies dmylinisantes du








































- Slides: 48

Sclérose en plaques et autres maladies démyélinisantes du système nerveux central Dr Elisabeth MAILLART CCA Département de neurologie Hôpital de la Pitié-Salpêtrière DU de Neuro-réanimation 25 janvier 2013

Plan • Sclérose en plaques • Maladies démyélinisantes: – Maladie de Devic – Sclérose concentrique de Balo

Evolution des critères diagnostiques et des traitements Arrivée IRM* 1868 Description Charcot 1965 1983 1997 2001 2005 2010 Barkhof Schumacher Poser Révision Mc Donald Hydrothérapie Graines de moutarde Traiter tôt… Interférons copolymère fingolimod natalizumab

Historique • Triade de Charcot – Dysarthrie – Nystagmus – Tremblement • Diagnostic de syphilis • Anatomopathologie: Charcot 1898 démyélinisation « sclérose » en plaques • Traitements de l’époque : – Doses d’argent, d’iodine, d’arsenic, moutarde – électrochocs – bains d’eau froide

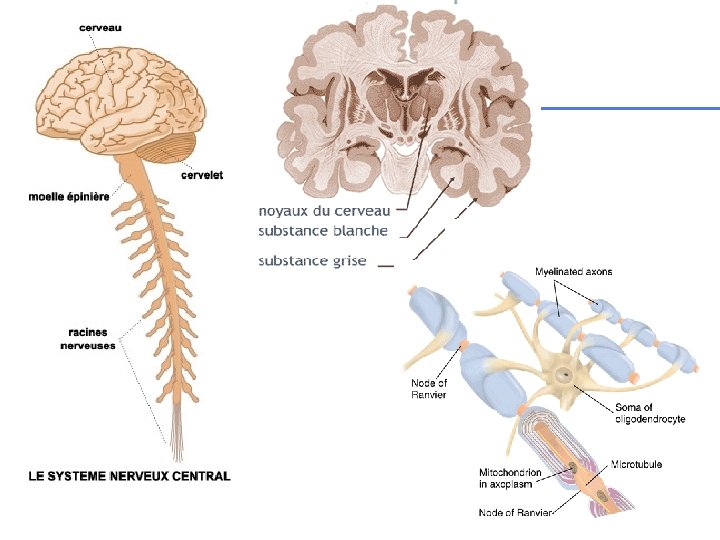
Sclérose en plaques Maladie inflammatoire démyélinisante (de la substance blanche) chronique du SNC Dissémination temporelle Dissémination spatiale (Clinique+IRM) IRM encéphalique + moelle potentiels évoqués ponction lombaire

Axone


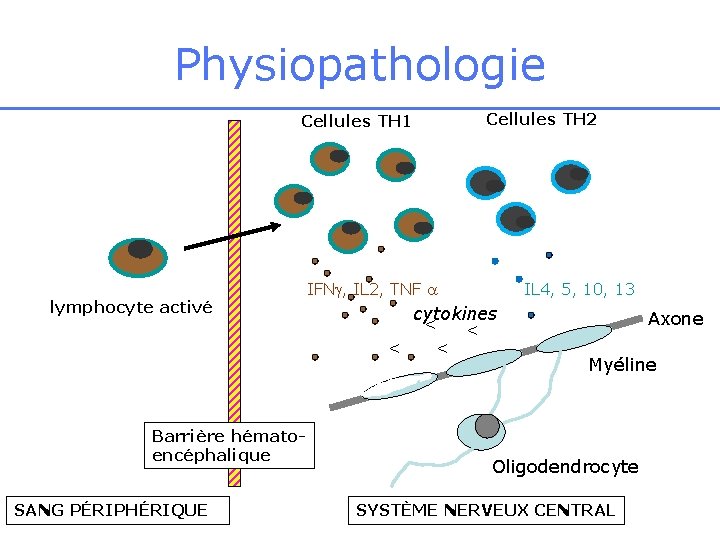
Physiopathologie Cellules TH 1 lymphocyte activé Barrière hématoencéphalique SANG PÉRIPHÉRIQUE Cellules TH 2 IFN , IL 2, TNF IL 4, 5, 10, 13 cytokines < < Axone Myéline Oligodendrocyte SYSTÈME NERVEUX CENTRAL

Épidémiologie • 80 000 cas en France • 350 000 cas en Europe • Enjeux: – Seconde cause de handicap acquis chez l’adulte jeune – Après 15 ans, 80% ont un déficit neurologique permanent traiter tôt +++

Histoire naturelle Formes rémittentes Formes secondairement progressives Formes progressives d'emblée Formes progressives avec poussées L'axe des abscisses correspond au temps, l'axe des ordonnées au handicap, en unités arbitraires

Symptômes • • • Névrite optique Myélite sensitive>motrice Syndrome cérébelleux, nystagmus Troubles vésico-sphinctériens Troubles cognitifs, épilepsie • Rares: surdité, aphasie, HLH

Pronostic • Variabilité de la maladie: – Dans sa sévérité – Dans sa modalité évolutive • Pronostic imprévisible mais …. – Facteurs pronostiques liés à la présentation clinique – Facteurs pronostiques IRM ++++ – Influence de l’âge sur la phase progressive

Objectifs des traitements • Traitement de la poussée – Réduire le handicap à court terme • Traitements de fond – Réduire la fréquence des poussées – Réduire le handicap à long terme – Réduire l’activité IRM

Traitement des poussées • Vérifier l’absence d’infection (Uthoff? ) • Repos • Bolus de SOLUMEDROL: – Permet d’accélérer la récupération (étude ONTT) – N’améliore pas le pronostic de récupération – 3 à 5 g – Pas de relais per os

Traitement de fond: SEP RR • Première intention: immunomodulateurs (SC) – interféron bêta (Bétaferon®, Avonex®, Rebif®, Extavia®) – acétate de glatiramère (Copaxone ®) • atténuation de l’activation des LT, switch Th 1 vers Th 2 • modulation de la permabilité de la BHE

Traitement de fond: SEP RR • Deuxième intention ou forme agressive d’emblée: –natalizumab IV mensuel TYSABRI ® • Ac monoclonal anti-intégrine alpha 4 (VLA 4) –fingolimod per os GILENYA ® • ligand des récepteurs sphingosine-1 -phosphate –mitoxantrone IV mensuel ELSEP ® • anthracènedione

Traitement Natalizumab Cellules TH 2 IFN beta, AG Cellules TH 1 IFN beta, AG Neuroprotection? fingolimod lymphocyte activé IFN , IL 2, TNF IL 4, 5, 10, 13 cytokines < < Axone Myéline Remyélinisation? Barrière hématoencéphalique SANG PÉRIPHÉRIQUE Oligodendrocyte SYSTÈME NERVEUX CENTRAL

Traitement de fond: SEP SP • Avec poussées : Bétaféron® (AMM) • Sans poussées : (hors AMM) – Méthotrexate per os – Cyclophosphamide IV mensuel – corticoïdes IV mensuels

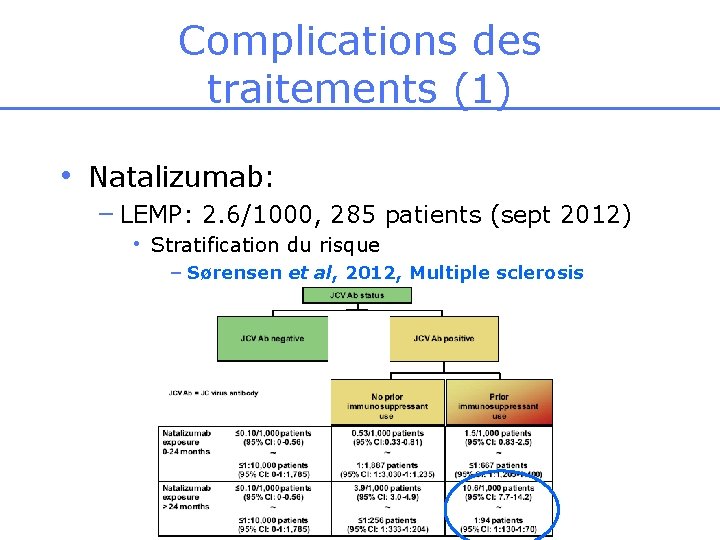
Complications des traitements (1) • Natalizumab: – LEMP: 2. 6/1000, 285 patients (sept 2012) • Stratification du risque – Sørensen et al, 2012, Multiple sclerosis

Complications des traitements (1) • Natalizumab: – LEMP: 2. 6/1000, 285 patients (ECTRIMS 2012) • Stratification du risque • Pronostic – Décès: 22% – Survivants: > 2 points d’EDSS à 1 an • Y penser: – « poussée » sous Tysabri qui ne récupère pas – Crise, état de mal • Traitement: arrêt du natalizumab IRIS – EP, SMD – Lariam®: échec – Maraviroc ? : récept des LT anti-CCR 5

Complications des traitements (2) • Fingolimod: – troubles de la conduction cardiaque à l’introduction du traitement – encéphalite varicelleuse fatale (1) • Immunosupresseurs

Plan • Sclérose en plaques • Maladies démyélinisantes: a. Maladie de Devic b. Sclérose concentrique de Balo – Distinctes de la sclérose en plaques • • • pronostic IRM anatomopathologie +/- biologie traitement – Modification des frontières

Maladie de Devic • Eugène Devic, en 1894 • Femme de 45 ans • Névrite optique – Bilatérale – Sévère • Myélite – Transverse aiguë – Sévère • Décès en 1 mois • Anatomo-pathologie : • – démyélinisation des nerfs optiques et de la moelle. – encéphale normal Rare (12 cas rapportés)

Épidémiologie Collongues et al, 2010, Neurology Série française 125 patients • Prévalence: 1/100. 000 • Ethnies: Japon, Afro-américains, • • africains, Brésiliens. SR 3/1 Age de début: 35 ans ou plus

Clinique • Névrite optique / myélite SEVERE • Signes cliniques « red flags » : –douleur radiculaire –atteinte respiratoire –hoquet et nausées

Évolution • Par poussées: 73% –délai entre P 1 et P 2 <5 ans moyenne 1 an –diminution du nombre de poussées après 2 ans d’évolution –taux annualisée de poussée: 0. 99 • Forme monophasique: 26% • Forme progressive: 1. 6%

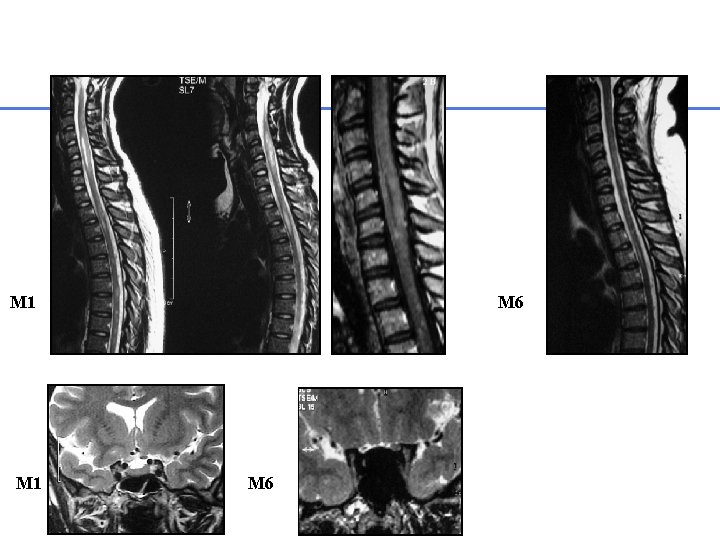
Critères diagnostiques Wingerchuk et al, Neurology 1999 Tous les critères absolus + 1 majeur ou 2 mineurs 71 CRITERES ABSOLUS 1. Névrite optique 2. Myélite 3. Pas d’atteinte en dehors du nerf optique et de la moelle épinière CRITERES MAJEURS 25/28 IRM cérébrale normale au début 21/23 IRM médullaire : myélite étendue > 3 espaces vertébraux 20/54 LCR : > 50 GB/mm 3 ou > 5 PNN/mm 3 CRITERES MINEURS Névrite optique bilatérale 59/71 Névrite optique sévère (AV<1/10) fixée sur au moins un oeil 31/71 Déficit moteur sévère (MRC grade 2) fixé sur au moins un membre 32/71

M 1 M 6

Anatomo-pathologie Lucchinetti et al, 2002, Brain • • Démyélinisation Cavité nécrotique centrale Vaisseaux hyalinisés Immunité humorale : – complément activé – macrophages, éosinophiles – dépôts d’immunoglobulines

Anticorps anti-aquaporine 4 Lennon et al, 2004, Lancet • Ac anti-NMO: – Ig. G co-localisée avec le canal aquaporin-4 – composant du complexe protéique dystroglycane – sur le pied des astrocytes de la BHE • 102 sérums de patients suivis aux USA pour une maladie de Devic sensibilité 73%, spécificité 91%

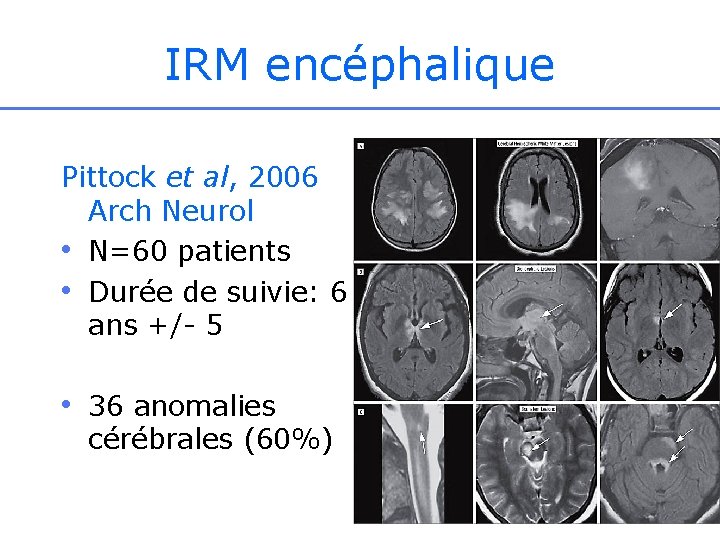
IRM encéphalique Pittock et al, 2006 Arch Neurol • N=60 patients • Durée de suivie: 6 ans +/- 5 • 36 anomalies cérébrales (60%)

2008 January 2010 32

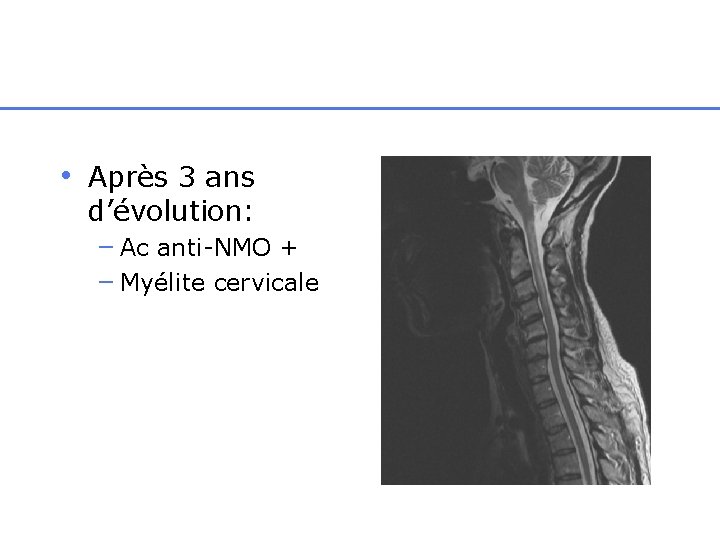
• Après 3 ans d’évolution: – Ac anti-NMO + – Myélite cervicale

Nouveaux critères Wingerchuk et al, 2006, Neurology • Névrite optique • Myélite aigue • 2 critères sur 3: 1. IRM médullaire: 1 HS T 2 étendu ≥ 3 corps vertébraux 2. IRM cérébrale ne remplissant pas les critères de SEP 3. Ig. G anti-aquaporine 4 sensibilité 99%, spécificité 90%

Traitements (1) • Immunosuppresseurs: – Azathioprine 2 mg/kg/j Mandler et al, Neurology, 1998 • 7 patients, en début d’évolution, stabilisés à 18 mois EDSS=8. 2 (6. 0 -9. 0) • à 6 mois EDSS=6. 6 (4. 4 -8) p<0. 001) • à 18 mois EDSS=4 (3 -6) (p<0. 001) – Methotrexate 50 mg/s Minagar et al, 2000, Int. J. MS Care • 8 patients EDSS = 6. 6 à 5 en 1 an • pas de rechute en 1 an. – Cyclophosphamide O'Riordan et al, 1996, JNNP Wingerchuk et al, 1999, Neurology

Traitements (2) Cree et al, 2005, Neurology • Rituximab – étude prospective, non contrôlée – 8 patients – 375 mg/m 2/s pendant 4 semaines – médiane de fréquence des poussées: • 2. 6 poussées • Passe à 0/patient/an (p=0. 0078). – EDSS 7. 5 à 5. 5 (p=0. 013).

Traitements (3) Papeix et al, Multiple sclerosis, 2007 • Interférons bêta: – Étude rétrospective – 26 patients – Critère de jugement : fréquence des poussées – Résultats: 2 groupes • interféron bêta (7 patients) • immunosuppresseurs (19 patients) Probabilité de ne pas faire de poussée: plus faible sous IFN que sous IS (p = 0. 0007).

Évolution du concept • Modifications des critères nouveaux critères de Devic ? syndrome des anticorps anti. NMO?

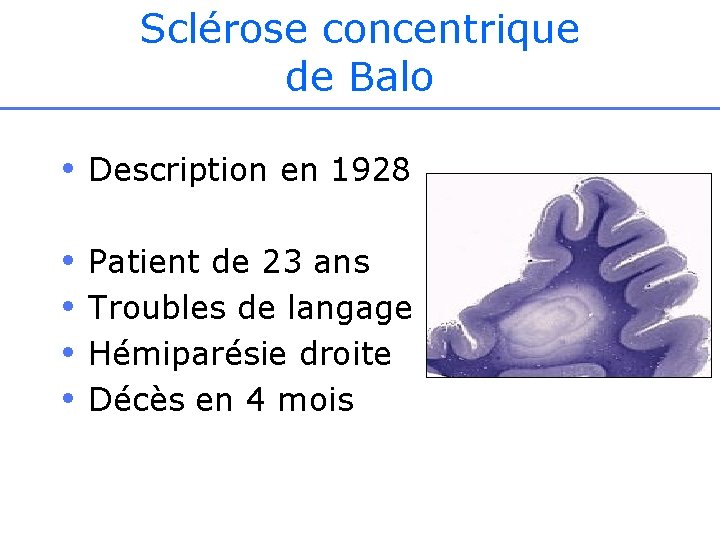
Sclérose concentrique de Balo • Description en 1928 • • Patient de 23 ans Troubles de langage Hémiparésie droite Décès en 4 mois

Sclérose concentrique de Balo • Rare (Philippines, hommes) • Clinique: – aiguë ou sub-aiguë – monophasique – sévère – encéphalopathie, troubles du langage, déficit hémicorporel • Neuropathologique: démyélinisation concentrique

IRM: évolution du concept • Peut être associée • • à des lésions de SEP Parfois pronostic moins sévère Nécessité d’un suivi régulier clinique et IRM à long terme

Traitement • Absence d’essai contrôlé • Identique à la SEP – Corticoïdes pendant les poussées – Immuno-modulateurs (1 ligne) – Immuno-suppresseurs (2 nde ligne) ère

Maladies démyélinisantes et Réanimation • Poussée sévère du tronc cérébral (parfois atteinte respiratoire aigue) – Solumédrol jusqu’à 10 g – Échanges plasmatiques – Immunosuppresseurs

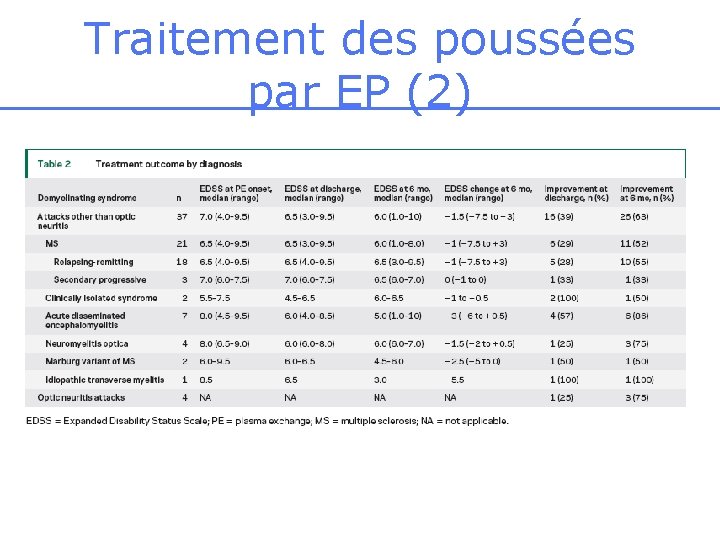
Traitement des poussées par EP (1) Llufriu et al, 2009, Neurology • Étude rétrospective (1995 -2007) • 41 patients • Objectif primaire: amélioration d’un point d’EDSS à 6 mois ou de deux lignes sur l’échelle visuelle. • Nombre moyen d’EP = 6 ( 5 -15) • Amélioration de 63 % des patients à M 6

Traitement des poussées par EP (2)

Maladies démyélinisantes et Réanimation (2) • Complications infectieuses: – liée au handicap • infections broncho-pulmonaires • infections urinaires Toute infection aggrave les signes neurologiques Traiter l’infection avant de se prononcer sur handicap du patient – iatrogènes: LEMP, encéphalites …

Conclusions • Maladies démyélinisantes en Réanimation: – pronostic variable – poussées sévères à traiter activement • Solumedrol 10 g • EP 5 -7 • Traitements immunosuppresseurs – complications iatrogènes – traiter les infections

Bibliographie • • • • Collongues et al. Neurology. 2010; 74: 736 -42. Cree, et al. Neurology. 2005; 64(7): 1270‑ 1272. Lennon, et al. Lancet. 2004; 364(9451): 2106‑ 2112. Lucchinetti, et al. Brain. 2002; 125(7): 1450‑ 1461. Llufriu et al, 2009, Neurology; 73(12): 949 -53. Mandler, et al. Neurology. 1998; 51(4): 1219‑ 1220. Minagar et al, Int J MS Care. 2000; 2: 39 -43. O'Riordan et al, 1996. JNNP; 60(4): 382 -7. Papeix, et al. Multiple sclerosis. 2007; 13(2): 256‑ 259. Pittock, et al. Archives of neurology. 2006; 63(3): 390‑ 396. Polman, et al, Ann Neurol. 2011; 69(2): 292 -302. Sørensen, et al, Multiple sclerosis. 2012 18(2): 143‑ 152. Wingerchuk, et al. Neurology. 2006; 66(10): 1485‑ 1489. Wingerchuk et al, Neurology. 1999; 53(5): 1107 -14.