Sciences physiques 416 Ghislain Jean MarieJose Rvision de


































- Slides: 46

Sciences physiques 416 Ghislain, Jean & Marie-Josée Révision de fin d'année juin, 2001

Le but de la présentation Au cours de l ’heure qui va suivre nous ferons le tour du programme de sciences physiques 416. Espérons que ce survol général vous aidera lors de votre prochain examen.

Le programme de sciences physiques 416 • Module 1: LA MATIÈRE • Module 2: L ’ÉLECTRICITÉ • Module 3: LES SOLUTIONS

Module 1: LA MATIÈRE • 2. Propriétés caractéristiques • 3. Changements physiques et chimiques • 4. La structure atomique • 5. La classification des éléments

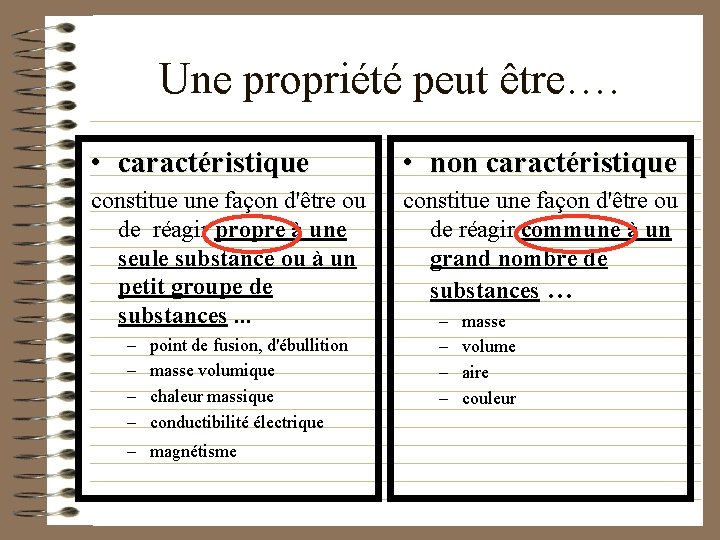
Une propriété peut être…. • caractéristique • non caractéristique constitue une façon d'être ou de réagir propre à une seule substance ou à un petit groupe de substances. . . constitue une façon d'être ou de réagir commune à un grand nombre de substances … – – point de fusion, d'ébullition masse volumique chaleur massique conductibilité électrique – magnétisme – – masse volume aire couleur

Une propriété peut être…. physique • Elle exprime l ’état d ’une substance. Ex: . L ’objet est rouge. chimique • Elle exprime le comportement d ’une substance. Ex: . Le dihydrogène explose en présence de la flamme.

Une propriété peut être…. qualitative • Elle exprime une qualité. Ex: . L ’objet a une forme arrondie. quantitative • Elle s ’exprime habituellement par une valeur numérique. Ex: . La masse est de 50 grammes

2. Propriétés caractéristiques ……………. . . ………. …. . . (des gaz) Des tests caractéristiques nous permettent d ’identifier une substance gazeuse • L ’hydrogène >>>>>>le test de la flamme • L ’oxygène >>>>>> le test du tison • Le CO 2 >>>>>> le test de l ’eau de chaux

2. Propriétés caractéristiques ………………. . . …. …. . . (des liquides) Les propriétés caractéristiques nous permettent d’identifier une substance liquide • Conductibilité électrique • Papier au dichlorure de cobalt = beige rosé • Mesure du degré d ’acidité >>>>>> test du tournesol • Mesure de la masse volumique

La masse volumique ……………. . . ………. …. . . (protocole) • • 1. Peser un cylindre gradué vide 2. Remplir le cylindre gradué de liquide. 3. Peser le cylindre gradué plein. 4. Soustraire les deux masses pour trouver la masse du liquide seul. • 5. Mesurer le volume du liquide. • 6. Diviser la masse par le volume Ex: . Un liquide mesure 20 m. L. Il pèse 15, 8 grammes. Sa masse volumique est de….

2. Propriétés caractéristiques ……………. . . ………. …. . . (des solides) • Les propriétés caractéristiques nous permettent d ’identifier une substance solide • Conductibilité électrique • Mesure de la masse volumique

La masse volumique ……………………. . . (protocole) • 1. Mesurer la masse du solide • 2. Mesurer le volume du solide – mesurer un volume d'eau dans le cylindre – placer le solide dans le cylindre – calculer l ’augmentation du volume de l ’eau. • 3. Diviser la masse par le volume ex: . Un objet mesure 20 m. L. Il pèse 150 grammes. Sa masse volumique est de….

3. Les changements…. . physiques • Ils ne modifient pas la nature de la substance. Ex: . La glace, l’eau et un nuage sont formés de la même substance chimiques • Ils changent la nature , la composition de la substance. Ex: . La rouille et le fer n ’ont pas la même formule chimique.

Les changements chimiques se reconnaissent par. . . • La production de chaleur et de lumière. • Le dégagement d ’un gaz. • La formation d ’un précipité. • Le changement de couleur. CE NE SONT QUE DES INDICES. Est-ce que la composition de la substance est modifiée ? ? ?

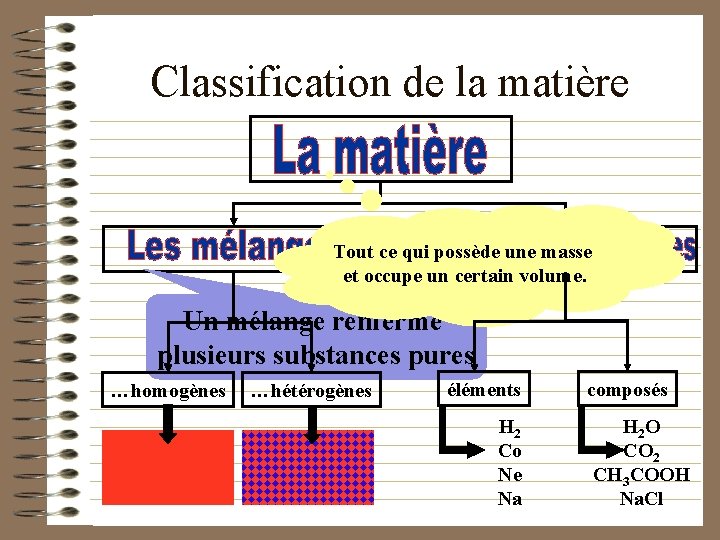
Classification de la matière Tout ce qui possède une masse et occupe un certain volume. Un mélange renferme plusieurs substances pures …homogènes …hétérogènes éléments H 2 Co Ne Na composés H 2 O CO 2 CH 3 COOH Na. Cl

Qui peut me dire…. Dans quelle S catégorie. S peut-on situer. . . 1. - l ’eau distillée. . . 2. - la crème glacée aux cerises. . . 3. - le jus de tomates. . . ? ? ? Une substance matérielle ? Un mélange. . . ? ? hétérogène Une substance matérielle Une substance pure Un composé Une substance matérielle Un mélange. . . homogène ? ? ?

Qui peut me dire…. (suite) Dans quelle S catégorie. S peut-on situer. . . 1. - le cuivre. . . Une substance matérielle Une substance pure Un composé 2. - la crème glacée aux cerises. . . Une substance matérielle Un mélange. . . hétérogène 3. - le jus de tomates. . . Une substance matérielle Un mélange. . . homogène ? ? ?

Impacts des changements

4. Les modèles atomiques • • • Aristote et Démocrite (400 av JC) Modèle de Dalton (1850) Modèle de Thomson (1880) Modèle de Rutherford (1903) Modèle actuel simplifié - Rutherford-Bohr (1930)

Aristote et Démocrite (400 av JC) Démocrite • La matière est discontinue • Elle est formée de particules que je nomme: atomes Aristote • La matière est uniforme • Il ne peut pas y avoir de vide dans la matière

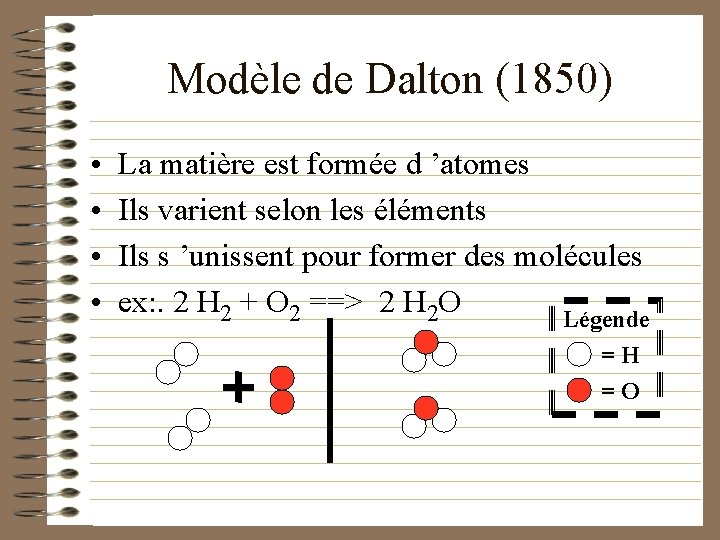
Modèle de Dalton (1850) • • La matière est formée d ’atomes Ils varient selon les éléments Ils s ’unissent pour former des molécules ex: . 2 H 2 + O 2 ==> 2 H 2 O Légende =H =O

Modèle de Thomson (1880) • Les atomes sont formés d ’une masse positive parsemée d ’électrons négatifs. _ _ __ _ _

Modèle de Rutherford (1903) • Les atomes sont formés d’un noyau positif dense et compact entouré d ’électrons. +++

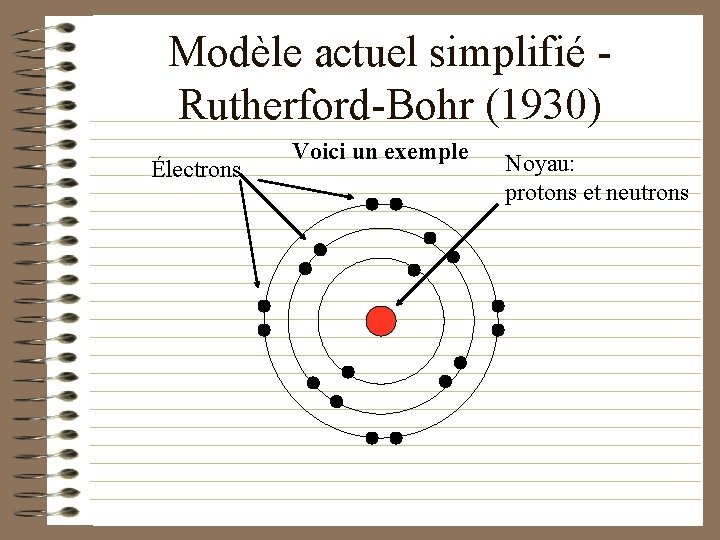
Modèle actuel simplifié Rutherford-Bohr (1930) • Les atomes sont formés d’un noyau positif dense et compact entouré d ’électrons répartis sur plusieurs couches électroniques.

Modèle actuel simplifié Rutherford-Bohr (1930) Électrons Voici un exemple Noyau: protons et neutrons

Les isotopes (définition) • Les isotopes sont des éléments ayant le même numéro atomique mais des masses différentes. Exemple: • Le carbone 12 ==> no 6, symbole C, masse 12 • Le carbone 14 ==> no 6, symbole C, masse 14

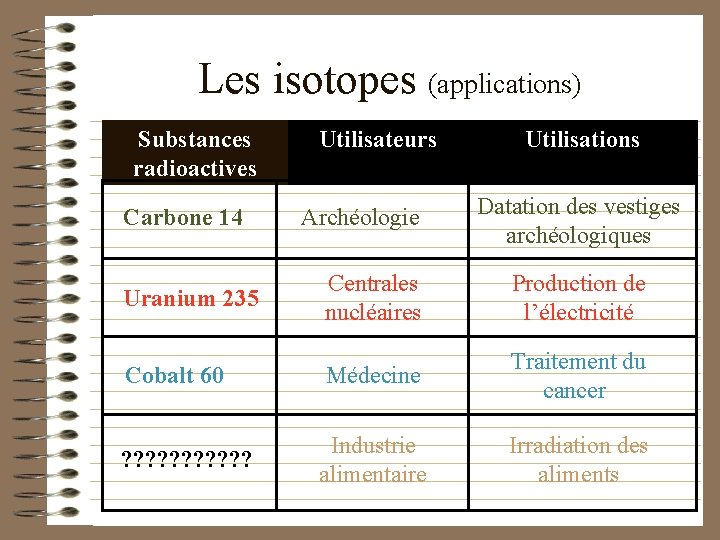
Les isotopes (applications) Substances radioactives Carbone 14 Utilisateurs Archéologie Utilisations Datation des vestiges archéologiques Uranium 235 Centrales nucléaires Production de l’électricité Cobalt 60 Médecine Traitement du cancer ? ? ? Industrie alimentaire Irradiation des aliments

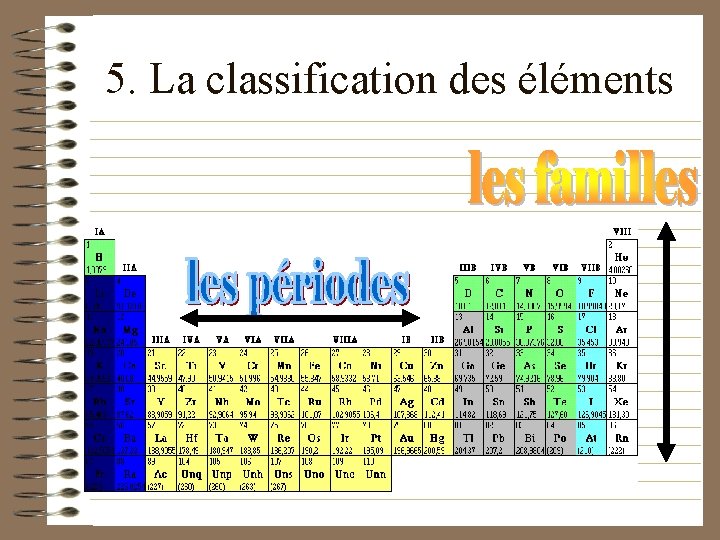
5. La classification des éléments

Les métaux et les non métaux (positions)

Les métaux et les non métaux (propriétés métalliques) • • Ils sont brillants Ils sont conducteurs Ils sont malléables Ils réagissent aux acides

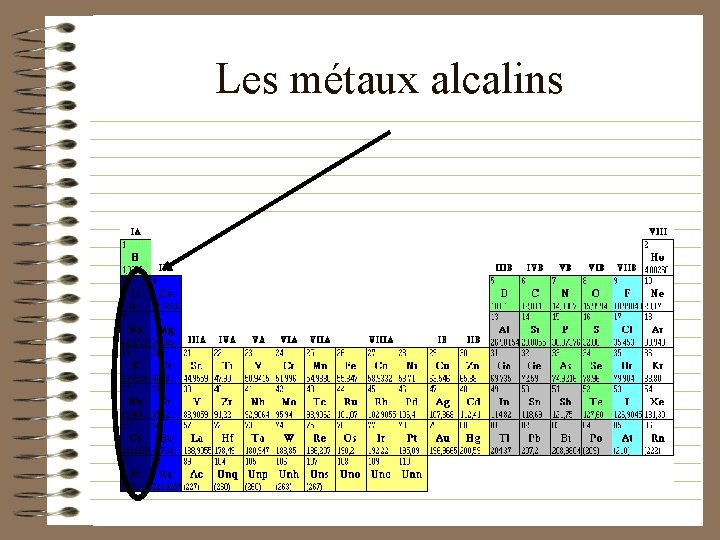
Les métaux alcalins

Les métaux alcalins (propriétés) • Ils sont mous (facile à couper) • Ils réagissent facilement à l ’eau

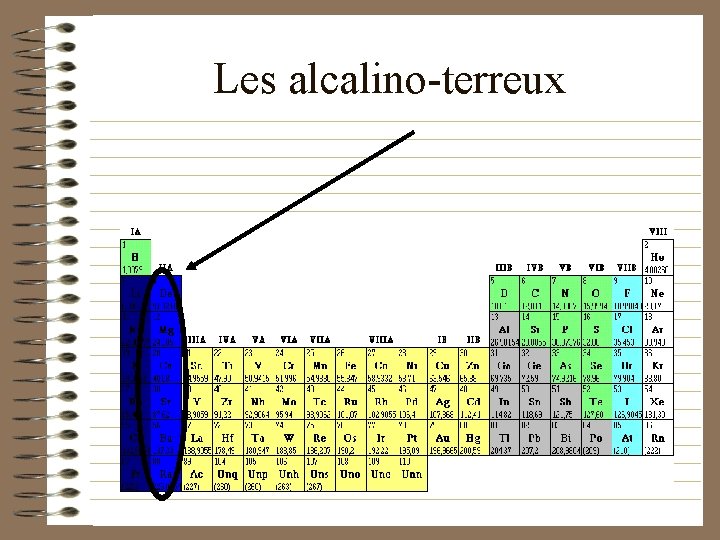
Les alcalino-terreux

Les alcalino-terreux (propriétés) • Ils sont plus durs que les métaux alcalins • Ils sont moins réactifs

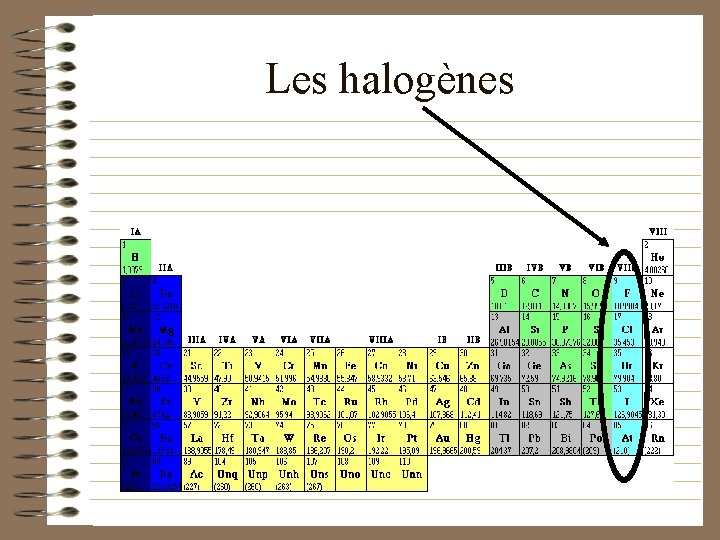
Les halogènes

Les halogènes (propriétés) • Ils sont corrosifs • Ils sont bactéricides

Les gaz inertes

Les gaz inertes (propriétés) • Ils ne réagissent pas, ils sont inertes (!)

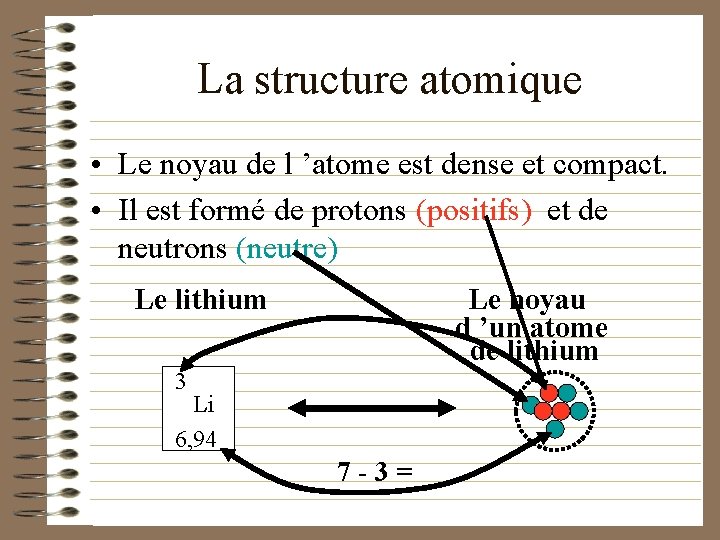
La structure atomique • Le noyau de l ’atome est dense et compact. • Il est formé de protons (positifs) et de neutrons (neutre) Le noyau d ’un atome de lithium Le lithium 3 Li 6, 94 7 -3=

La structure atomique (suite) • Le noyau de l ’atome est entouré d ’électrons (négatifs) • Ils sont répartis sur plusieurs couches … électroniques

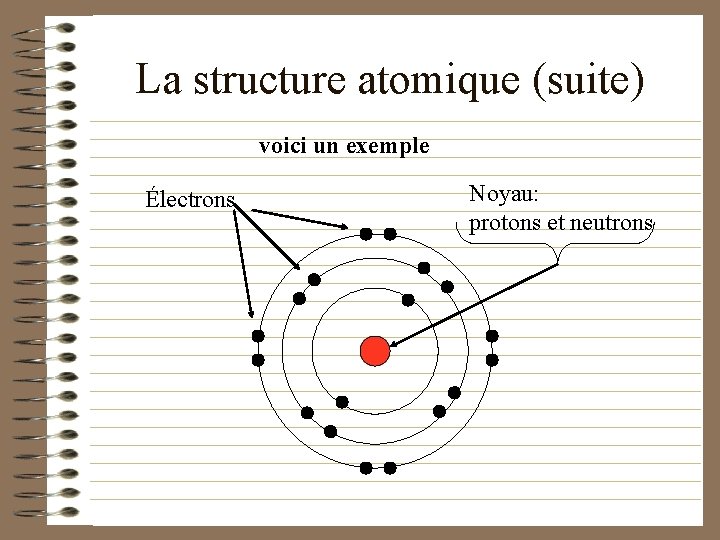
La structure atomique (suite) voici un exemple Électrons Noyau: protons et neutrons

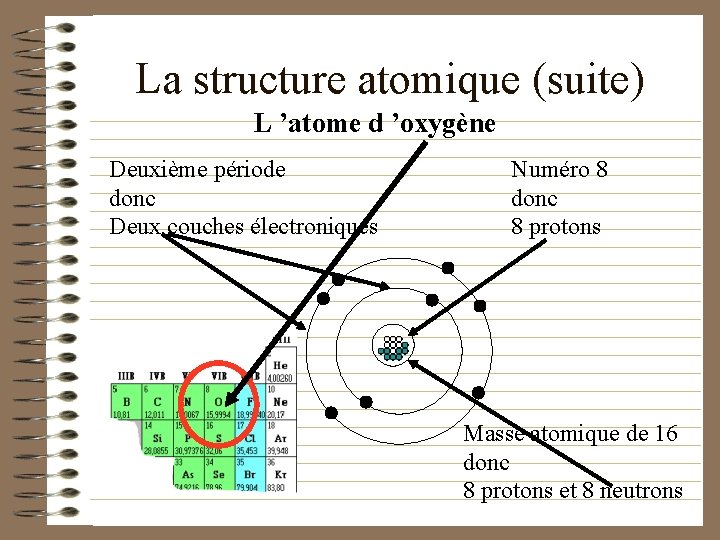
La structure atomique (suite) • Le numéro atomique nous indique le nombre de protons dans le noyau. • Le numéro de la période nous indique le nombre de couches électroniques. • Le numéro de la famille nous indique le électrons sur la dernière couche nombre d ’électrons couche. • À titre d ’exemple, voici une représentation d ’un atome d ’oxygène…. .

La structure atomique (suite) L ’atome d ’oxygène Deuxième période donc Deux couches électroniques Numéro 8 donc 8 protons Masse atomique de 16 donc 8 protons et 8 neutrons

La structure atomique (suite) • On peut aussi indiquer la configuration électronique de la façon suivante: O 2) 6) • Dans ce cas on n’indique pas la composition du noyau

La nomenclature Na. Cl se nomme chlorure de sodium Mg F 2 se nomme Na 2 O se nomme Al. Br 3 se nomme bi fluorure de magnésium oxyde de bi sodium tri bromure d ’aluminium

Fin du module 1
 Ghislain nourissat
Ghislain nourissat Human science
Human science Comp416
Comp416 Tri a 19 omega-5 gliadin wheat
Tri a 19 omega-5 gliadin wheat Gezang 250
Gezang 250 416 lec
416 lec Opwekking 416
Opwekking 416 Tca 55-10-416
Tca 55-10-416 Nlb 416
Nlb 416 La 416
La 416 Math 416 equivalent
Math 416 equivalent Tram 2 paris
Tram 2 paris Jean monnet jean-gabriel monnet
Jean monnet jean-gabriel monnet Jean omer marie gabriel monnet
Jean omer marie gabriel monnet Properties of materials grade 7
Properties of materials grade 7 University of applied sciences vaasa
University of applied sciences vaasa Fusion energy sciences
Fusion energy sciences Life and living grade 7 resources
Life and living grade 7 resources Writing papers in the biological sciences
Writing papers in the biological sciences Fusion energy sciences
Fusion energy sciences Cleveland arts & social sciences academy
Cleveland arts & social sciences academy Melissa reedy uiuc
Melissa reedy uiuc Western norway university of applied sciences
Western norway university of applied sciences Family and consumer sciences.com
Family and consumer sciences.com Duke masters of biomedical sciences
Duke masters of biomedical sciences Rmre journal
Rmre journal Sakarya university of applied sciences
Sakarya university of applied sciences Sciences de l'ingénieur
Sciences de l'ingénieur College of information sciences and technology
College of information sciences and technology Meril life sciences
Meril life sciences Observational health data sciences and informatics
Observational health data sciences and informatics Site:slidetodoc.com
Site:slidetodoc.com Danish institute of agricultural sciences
Danish institute of agricultural sciences Queens high school for the sciences at york college
Queens high school for the sciences at york college Uf clas advisors
Uf clas advisors Fusion energy sciences
Fusion energy sciences Ibn sina university of medical and pharmaceutical sciences
Ibn sina university of medical and pharmaceutical sciences Lsssdc
Lsssdc Symbiosis institute of health sciences
Symbiosis institute of health sciences Isparta university of applied sciences
Isparta university of applied sciences Life sciences
Life sciences Applied medical sciences
Applied medical sciences Relationship between social work and political science
Relationship between social work and political science Rmit chiropractic
Rmit chiropractic Kafue institute of health sciences
Kafue institute of health sciences Term 4 natural science grade 6
Term 4 natural science grade 6 Scope of farm management
Scope of farm management