REACCIONES QUMICAS Mara Franco Pajuelo Conocimientos previos Fsica













- Slides: 18

REACCIONES QUÍMICAS María Franco Pajuelo

Conocimientos previos • Física y química: Diferencia entre elemento y compuesto Símbolos de los elementos Concepto de masa molar Concepto de mol Estados de la materia Concepto de mezcla Unidades del sistema internacional

ÍNDICE 1. 2. 3. 4. Cambios químicos Características de las reacciones químicas Ecuaciones químicas Tipos de reacciones químicas

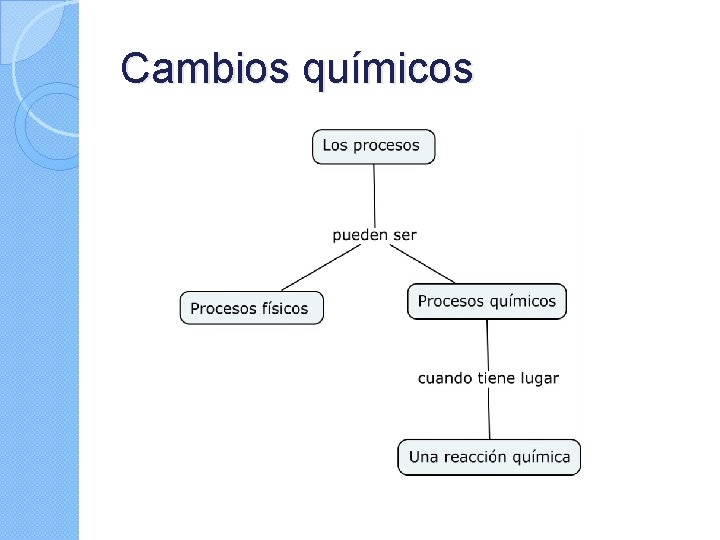
Cambios químicos

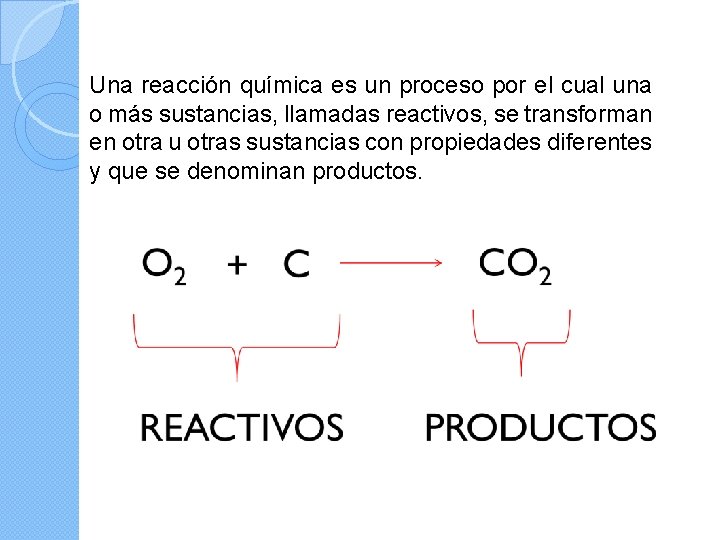
Una reacción química es un proceso por el cual una o más sustancias, llamadas reactivos, se transforman en otra u otras sustancias con propiedades diferentes y que se denominan productos.

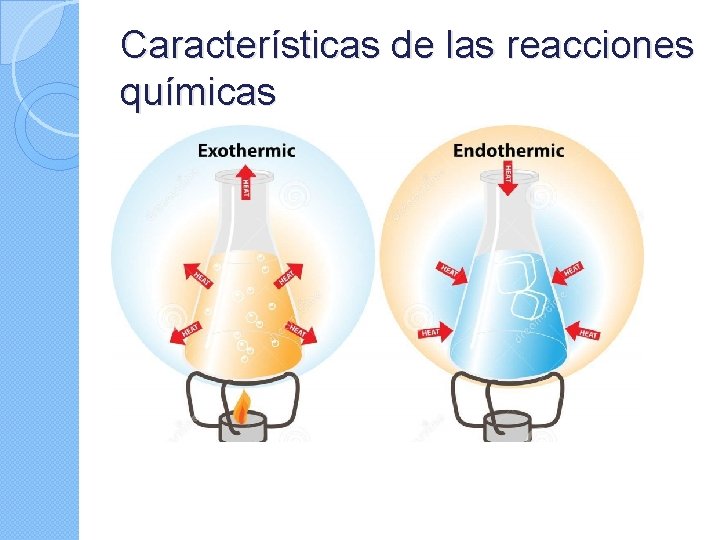
Características de las reacciones químicas

EN UNA REACCIÓN QUÍMICA SIEMPRE SE CUMPLE: PRINCIPIO DE CONSERVACIÓN DE LA MASA (Ley de Lavoisier)

Ejercicio: �Al calentar una mezcla de aluminio y yodo, la mezcla se quema con abundantes llamas (desprendimiento de energía). Cuando cesan, aparece un polvo blanco de yoduro de aluminio. a) Identifica reactivos y productos b) ¿Es exotérmica? c) ¿Cómo comprobarías que se cumple la ley de Lavoisier? Datos: PESO ATÓMICO: Al: 27 g/mol I: 126, 9 g/mol

https: //www. youtube. com/watch? v=e. JOi 6 GLwcv w

Solución • Sí es exotérmica • Se cumple la ley de Lavoisier porque: (54 + 762) g/mol = 816 g/mol

Ecuaciones químicas �Reactivos a la izquierda y productos a la derecha, separados por una flecha que indica el sentido de la reacción �Como en una reacción química se conserva la masa, debe existir en ambos lados de la reacción, el mismo número de átomos de cada elemento AJUSTAD A

• Para equilibrar reacciones químicas, se ponen delante las fórmulas unos coeficientes, que indican el número relativo de átomos y moléculas que intervienen en la reacción. • No se tocan los subíndices. • Se debe indicar el estado físico en el que se encuentran los reactivos y los productos a la presión y temperatura a las que tiene lugar la reacción.

Ejemplo Cuando se hace pasar por un tubo de acero caliente, el amoniaco se descompone en los dos elementos que lo forman, nitrógeno e hidrógeno: Amoniaco (g) nitrógeno (g) + hidrógeno (g) ¿Cuál es la ecuación química en esta reacción y como se ajusta?

Pasos a seguir 1. 2. 3. 4. Formular los reactivos y productos Escribir la ecuación no equilibrada Ajustar átomos de N e H. La reacción equilibrada es: 2 NH 3 (g) N 2 (g) + 3 H 2

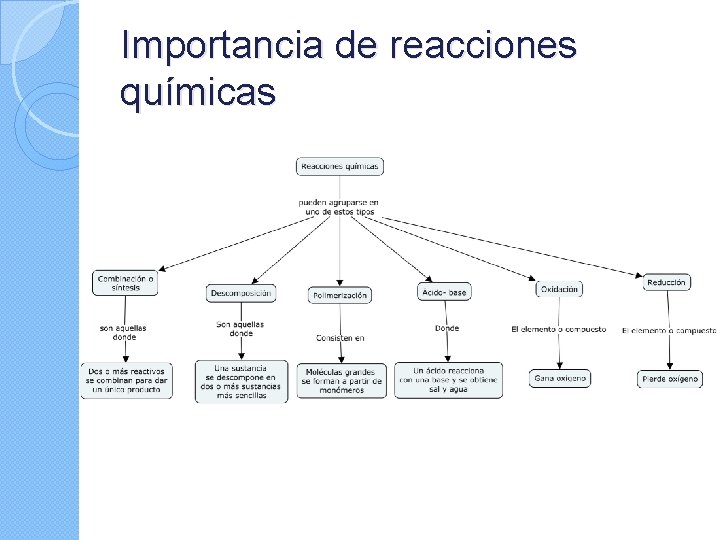
Importancia de reacciones químicas


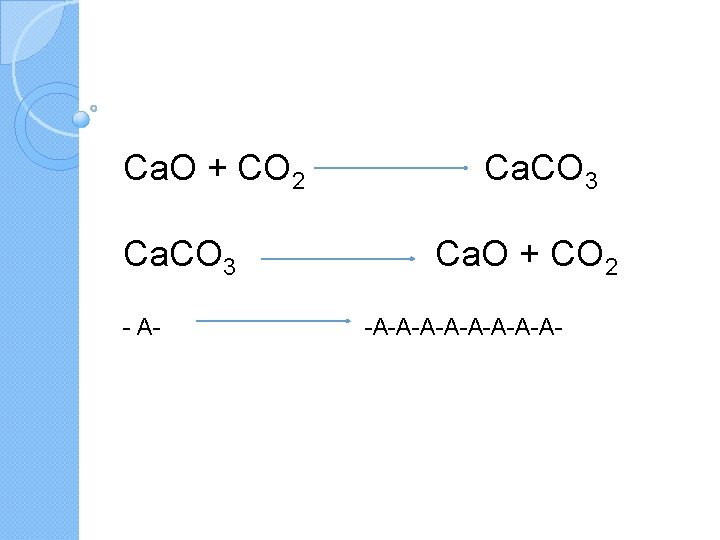
Ca. O + CO 2 Ca. CO 3 - A- Ca. CO 3 Ca. O + CO 2 -A-A-A-A-

¡GRACIAS POR SU ATENCIÓN!
 Conocimientos previos
Conocimientos previos Qumicas
Qumicas Fsica
Fsica Particula en movimiento
Particula en movimiento Vector
Vector Formula centripeta
Formula centripeta Modulo direção sentido
Modulo direção sentido Cual es la constante universal de los gases
Cual es la constante universal de los gases Resolução
Resolução Fsica
Fsica Movimento retardado e acelerado
Movimento retardado e acelerado Fsica
Fsica Ramas de la física moderna
Ramas de la física moderna Vectores fisica
Vectores fisica Fsica
Fsica Apoyo fijo movil y empotrado
Apoyo fijo movil y empotrado Fsica
Fsica Movimento retilíneo uniforme
Movimento retilíneo uniforme Fsica
Fsica



































