Reacciones de Oxido Reduccin Semana 5 2015 Licda




















- Slides: 21

Reacciones de Oxido- Reducción Semana 5 : 2015 Licda: Isabel Fratti de Del Cid Diseño de diapositivas, imágenes e ilustraciones cortesía de: Licda. Lilian Judith Guzmán Melgar

Reacciones de Oxido Reducción (Redox) Son las reacciones en las cuales cambia el número de oxidación de los reactivos en los productos formados. En toda reacción de oxido-reducción los electrones se «transfieren de una sustancia a otra» . Si una sustancia pierde electrones otra debe ganarlos. Debemos recordar que no todas las reacciones son de Oxido-Reducción 2

Oxidación Proceso en el cual un átomo pierde electrones, hay pérdida de cargas negativas por lo tanto hay aumento en el número de oxidación de un elemento hacia un valor más positivo ( incremento de cargas positivas ó disminución de negativas). Ejemplo de Oxidaciones C 0 C +4 Mn +2 Mn +7 O -2 O -1 3

Reducción Proceso en el cual, un átomo gana electrones durante una reacción química. Debido a que hay ganancia de cargas negativas, hay disminución en el número de oxidación de un elemento (disminución de cargas positivas ó aumento de cargas negativas). Ejemplo de reducciones : Cr +6 Cr N 2 0 N -3 O -1 O -2 4 +3

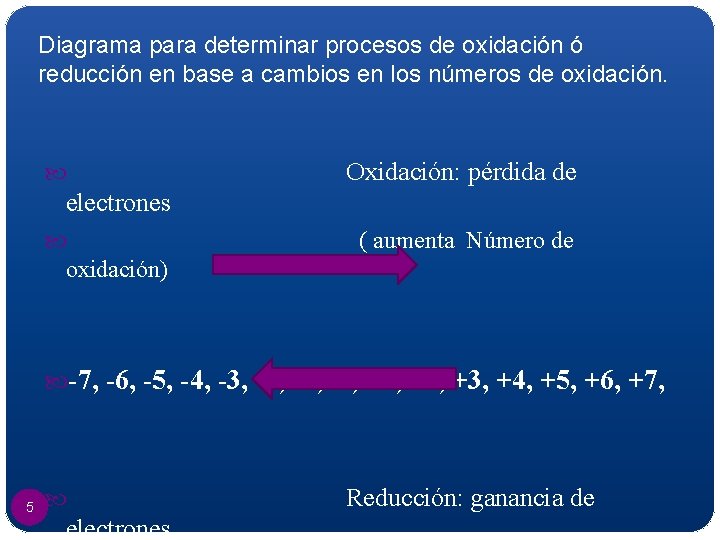
Diagrama para determinar procesos de oxidación ó reducción en base a cambios en los números de oxidación. Oxidación: pérdida de electrones ( aumenta Número de oxidación) -7, -6, -5, -4, -3, -2, -1, 0 , +1, +2, +3, +4, +5, +6, +7, 5 electrones Reducción: ganancia de

La oxidación también puede observarse a través de: 1 -Adición de Oxígenos es decir aumento en la proporción de Oxígenos: CH 3 CHO CH 3 COOH 2 C : 4 H : 1 O * 2 C : 4 H: 2 O * * : Aumenta proporción de oxígenos( note no hay cambios el número de los otros átomos ) 2 - Pérdida ó disminución de Hidrógenos CH 3 CH 2 OH CH 3 CHO 2 C : 6 H * : 1 O 2 C : 4 H *: 1 O * : Disminuye proporción de Hidrógenos ( note no hay cambios en el número de los otros átomos) 6

La reducción también puede observarse a través de: 1 -Pérdida de oxígenos ( disminuye proporción de oxígeno): C 6 H 5 COOH C 6 H 5 CHO 7 C : 6 H : 2 O * 7 C : 6 H : 1 O * * Disminuye proporción de oxígenos ( note no cambia el número de los otros átomos ). 2 - Aumento en la proporción de Hidrógenos: CH 3 COCOOH CH 3 CHOHCOOH 3 C 4 H * 3 O 3 C 6 H * 3 O * Aumenta proporción de Hidrógenos ( note no cambia la proporción de los otros átomos) 7

Proceso e Oxidación Proceso de reducción Pérdida de electrones Ganancia de electrones Valor del número de oxidación valor del numero de cargas positivas, oxidación cargas negativas Cargas positivas Proporción de oxígenos Proporción de Hidrógenos 8

Agente Reductor y Agente Oxidante AGENTE REDUCTOR Sustancia que contiene al elemento que se oxida. Al oxidarse, pierde electrones, favoreciendo que otra sustancia los gane, es decir que se reduzca, por eso se llama agente reductor. Debe buscarse del lado de los reactivos ( del lado izquierdo de la ecuación) 9 AGENTE OXIDANTE Sustancia que contiene al elemento que se reduce. Al reducirse, gana electrones, favoreciendo que otra sustancia los pierda, es decir se oxide, por eso se llama agente oxidante. Debe buscarse del lado de los reactivos ( del lado izquierdo de la ecuación)

Procedimiento para balancear ecuaciones de oxido-Reducción ( REDOX) 1 - Coloque a cada elemento su número de oxidación de acuerdo a normas vistas( semana 4). 2 - Observe los cambios en el número de oxidación de reactivos a productos e identifique los átomos que cambiaron. 3 - Determine el elemento que se oxido ó redujo y en cuantas unidades cambió cada uno.

Coloque como coeficiente las unidades de reducción ( electrones ganados), delante de la sustancia que contiene al elemento que se oxidó. Y las unidades de oxidación (electrones perdidos) delante de la sustancia que contiene al elemento que se redujo. 5 - Balancee del lado de los productos a las sustancias que contienen a los elementos que cambiaron. 4 - 11

6 - Ahora calcule y coloque coeficientes al resto de las sustancias de la ecuación, que no tuvieron cambios en sus números de oxidación por tanteo ó simple inspección. Empezando primero con los metales, luego no metales, después Hidrógenos y Oxígenos. 7 - Verifique todos los elementos queden balanceados ( es decir se halle el mismo número de ellos en reactivos y productos. ) 12

NOTA SI LE PIDEN ENCONTRAR: 13 A- Agente Oxidante y Reductor, búsquelos del lado de los reactivos, de acuerdo a conceptos dados anteriormente. B- Número total de electrones transferidos: Debe hacerlo en la ecuación balanceada, multiplicando el coeficiente obtenido para la sustancia que contiene al elemento que se oxidó ó redujo por el número de unidades de oxidación o reducción. En ambos casos se debe obtener el mismo número, pues el Número total de electrones ganados y perdidos debe ser el mismo.

Ejemplo: Balancee la siguiente ecuación: HNO 3 + H 2 S - S + NO + H 2 O Coloque números de oxidación: a cada átomo, . H +1 N +5 O -2 3 + H +12 S -2 S 0 + N +2 O -2 + H +1 2 O-2 Note que cambiaron : N +5 N +2 : Se redujo en 3 unidades (ganó 3 electrones) S -2 S 0 : Se oxidó en 2 unidades ( perdió 2 electrones) 14

Coloque el coeficiente 3 ( unidades de reducción ) al H 2 S, y al HNO 3 el coeficiente 2 ( unidades de oxidación) 2 HNO 3 + 3 H 2 S S + NO + H 2 O Ahora coloque coeficientes en los productos que poseen elementos que se oxidaron ó redujeron: 2 HNO 3 + 3 H 2 S 3 S + 2 NO + H 2 O Note el H 2 O, no posee coeficiente, ya que sus elementos NO tuvieron cambios, en sus números de oxidación. por eso se le asigna por tanteo: 2 HNO 3 + 3 H 2 S 3 S + 2 NO + 4 H 2 O La ecuación, quedó balanceada. 15

16 Si queremos averiguar cual es el agente Oxidante y el Agente Reductor, los buscamos de el lado de los reactivos: Agente Oxidante HNO 3 ( contiene al elemento que se reduce ) Agente Reductor H 2 S ( contiene al elemento que se oxida) El Número total de electrones transferidos: Debe hacerse en la ecuación balanceada. Puede usar las unidades de reducción ó de oxidación multiplicándolas por el coeficiente respectivo: N +5 + 3 e- N +2 Con la ecuación balanceada: 2 N +5 + 6 e- 2 N +2 Por lo tanto son 6 e- transferidos en total. Daria lo mismo si se hace con las unidades de oxidación: S -2 -2 e- S 0 En la ecuación balanceada: 3 S -2 -6 e- - 2 S 0 Note son 6 e- transferidos.

Ejercicios Balancee las sigs ecuaciónes y para c/u llene los datos solicitados en el cuadro siguiente. a) b) 17 P + HNO 3 + H 2 O → H 3 PO 4+ NO As 2 S 5 + HNO 3 - H 3 ASO 4 + H 2 SO 4 + NO 2 + H 20

ECUA-CION a) b) 18 ELEMENTO QUE SE OXIDA ELEMENTO QUE SE REDUCE # ELECTRON ES GANADOS # ELECT RONES PERDI DOS AGENTE OXIDANTE AGENTE REDUCTOR ELECTRO NES TRASNFE RIDOS COEFICIENTES QUE BALANCEAN LA ECUACIÓN reactivos productos

Oxidación y Reducción en sistemas biológicos. En sistemas biológicos la oxidación, implica generalmente aumento en la proporción de Oxígenos ó Disminución en la proporción de Hidrógenos. La reducción implica aumento en la proporción de Hidrógenos ó disminución en la proporción de oxígenos. Cuando se pierden Hidrógenos, generalmente se transfieren a Coenzimas, resultando éstas reducidas: ejemplo: Formas Oxidadas Formas Reducidas FADH 2 NAD+ NADH+H+ 19

Cont, oxidación en sist. biológicos Resuelva las siguientes preguntas del libro de texto: A) 6. 17 página: 220 B) 6. 19 página 220 20

Cont. Ejercicios oxidación biológica. Pregunta 6. 20 pág. 220 21
 Reacciones oxido reduccion ejemplos
Reacciones oxido reduccion ejemplos Reduccin
Reduccin Oxidacin
Oxidacin Nomenclatura del oxigeno
Nomenclatura del oxigeno Acido hipotelurioso
Acido hipotelurioso Tabela de nox fixos
Tabela de nox fixos Oxido acido
Oxido acido Oxido perfluorico
Oxido perfluorico Ito quimica
Ito quimica Oxido de etilenio
Oxido de etilenio Oxido de nitrogeno
Oxido de nitrogeno Oxido de etileno esterilizacion
Oxido de etileno esterilizacion Ecuacion quimica de oxido de litio
Ecuacion quimica de oxido de litio Fertilizantes
Fertilizantes Heptaóxido de difluor
Heptaóxido de difluor Hidruro mercúroso
Hidruro mercúroso Oxidos
Oxidos Oxido nitrico
Oxido nitrico Clasificacion de spaulding
Clasificacion de spaulding óxido-reducción ejemplos
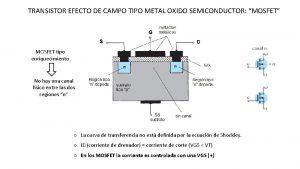
óxido-reducción ejemplos Transistor de efecto de campo metal-óxido-semiconductor
Transistor de efecto de campo metal-óxido-semiconductor Nomenclatura óxidos
Nomenclatura óxidos