CINTICA QUMICA Prof Leadina Snchez Elementos de Fisicoqumica

![Experimento 1 2 3 4 [A 0] (M) 0, 20 0, 40 0, 20 Experimento 1 2 3 4 [A 0] (M) 0, 20 0, 40 0, 20](https://slidetodoc.com/presentation_image/0b8d1a3e5f970fea08868b9ba4993b86/image-5.jpg)
![la ecuación de velocidad es v = k [A]2 [B] el orden global es la ecuación de velocidad es v = k [A]2 [B] el orden global es](https://slidetodoc.com/presentation_image/0b8d1a3e5f970fea08868b9ba4993b86/image-6.jpg)

- Slides: 15

CINÉTICA QUÍMICA Prof. Leadina Sánchez Elementos de Fisicoquímica

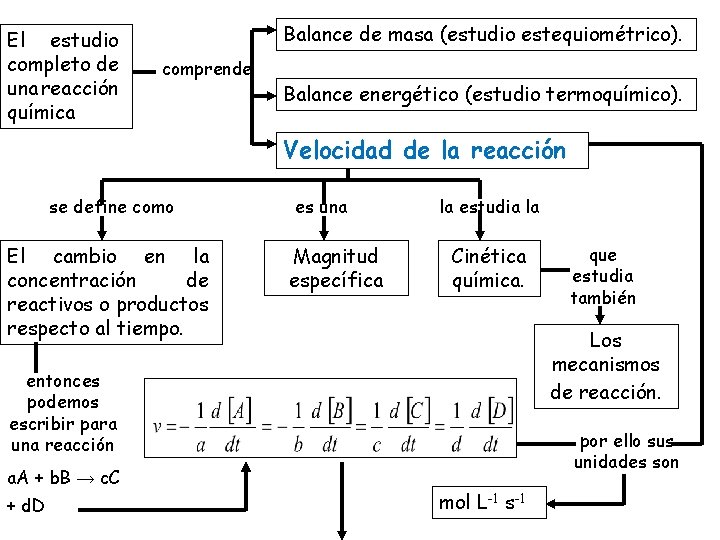
El estudio completo de una reacción química Balance de masa (estudio estequiométrico). comprende Balance energético (estudio termoquímico). Velocidad de la reacción se define como El cambio en la concentración de reactivos o productos respecto al tiempo. es una Magnitud específica la estudia la Cinética química. Los mecanismos de reacción. entonces podemos escribir para una reacción a. A + b. B → c. C + d. D que estudia también por ello sus unidades son mol L-1 s-1

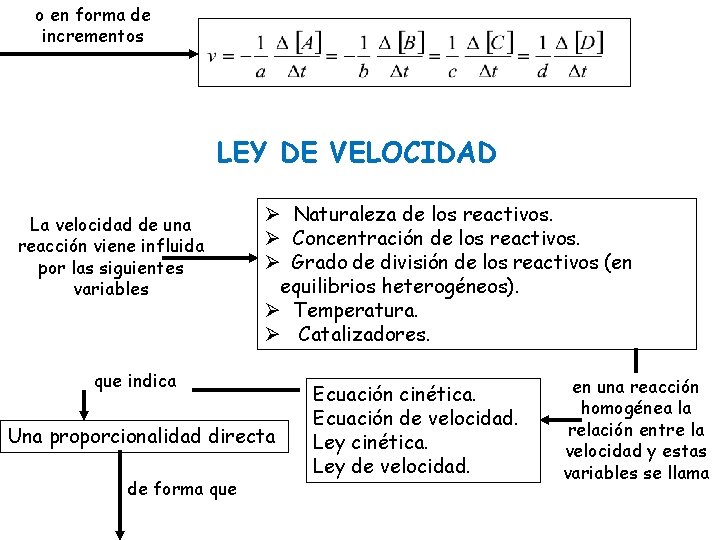
o en forma de incrementos LEY DE VELOCIDAD La velocidad de una reacción viene influida por las siguientes variables Ø Naturaleza de los reactivos. Ø Concentración de los reactivos. Ø Grado de división de los reactivos (en equilibrios heterogéneos). Ø Temperatura. Ø Catalizadores. que indica Una proporcionalidad directa de forma que Ecuación cinética. Ecuación de velocidad. Ley cinética. Ley de velocidad. en una reacción homogénea la relación entre la velocidad y estas variables se llama

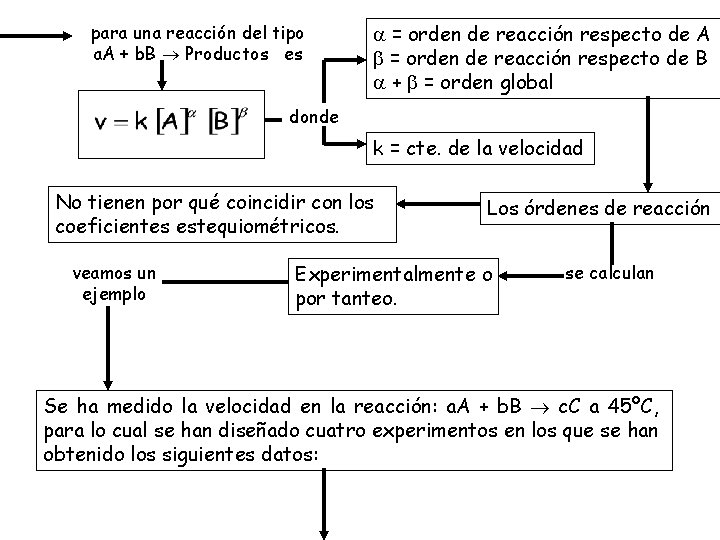
para una reacción del tipo a. A + b. B Productos es = orden de reacción respecto de A = orden de reacción respecto de B + = orden global donde k = cte. de la velocidad No tienen por qué coincidir con los coeficientes estequiométricos. veamos un ejemplo Los órdenes de reacción Experimentalmente o por tanteo. se calculan Se ha medido la velocidad en la reacción: a. A + b. B c. C a 45ºC, para lo cual se han diseñado cuatro experimentos en los que se han obtenido los siguientes datos:
![Experimento 1 2 3 4 A 0 M 0 20 0 40 0 20 Experimento 1 2 3 4 [A 0] (M) 0, 20 0, 40 0, 20](https://slidetodoc.com/presentation_image/0b8d1a3e5f970fea08868b9ba4993b86/image-5.jpg)
Experimento 1 2 3 4 [A 0] (M) 0, 20 0, 40 0, 20 [B 0] (M) 0, 20 0, 60 1, 20 V 0 (mol. L-1. s-1) 1, 1. 10 -6 4, 4. 10 -6 3, 3. 10 -6 6, 6. 10 -6 Determina la ley de velocidad para la reacción y su constante de velocidad La ley de velocidad es del tipo v = k [A]α [B]β en las experiencias 3 y 4 [A] = cte, al duplicarse [B] se duplica v. luego Es de primer orden respecto a B, o sea = 1. en conclusión en las experiencias 1 y 2 Se mantiene constante [B] y al duplicarse la [A] la velocidad se incrementa cuatro veces. por tanto Es de segundo orden respecto a A, o sea = 2.
![la ecuación de velocidad es v k A2 B el orden global es la ecuación de velocidad es v = k [A]2 [B] el orden global es](https://slidetodoc.com/presentation_image/0b8d1a3e5f970fea08868b9ba4993b86/image-6.jpg)
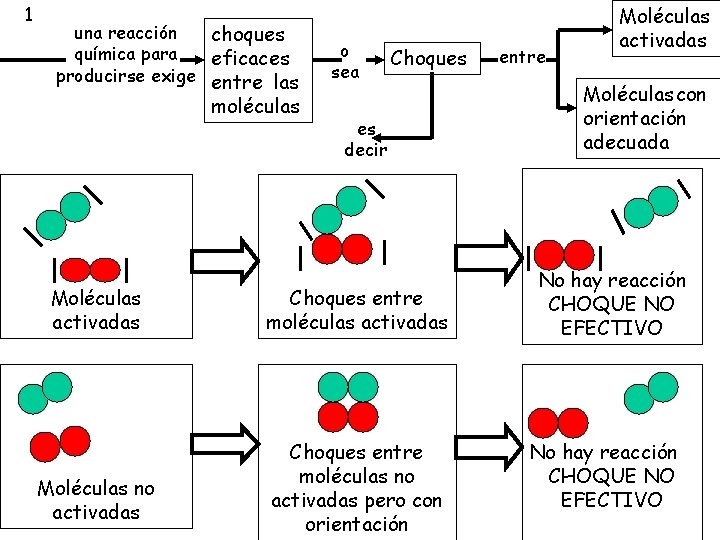
la ecuación de velocidad es v = k [A]2 [B] el orden global es 2+1=3 y sustituyendo en cualquiera de las experiencias calculamos k MECANISMOS DE REACCIÓN Un mecanismo de reacción es la secuencia de etapas que explica cómo los reactivos se transforman en productos. se denomina Molecularidad al número de especies (átomos o moléculas) de reactivo que intervienen en una etapa elemental del mecanismo de reacción. se explica mediante La teoría de las colisiones. 1 La teoría del estado de transición. 2

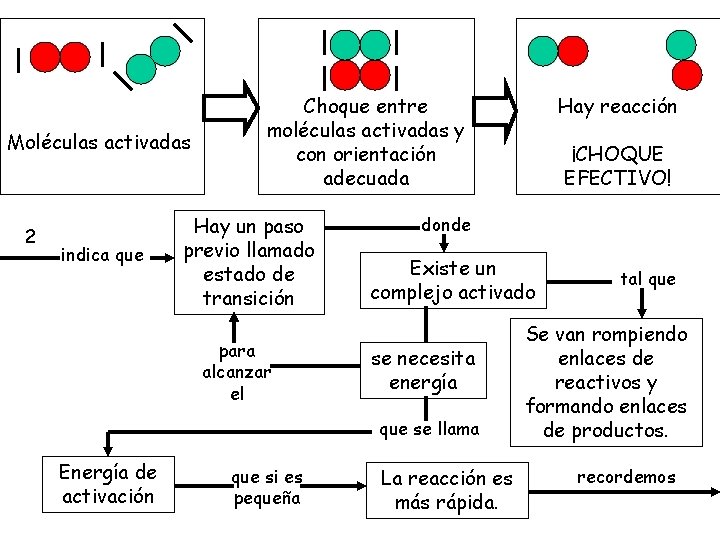
1 una reacción choques química para eficaces producirse exige entre las moléculas Moléculas activadas Moléculas no activadas o sea Choques es decir Choques entre moléculas activadas Choques entre moléculas no activadas pero con orientación entre Moléculas activadas Moléculas con orientación adecuada No hay reacción CHOQUE NO EFECTIVO

Moléculas activadas 2 indica que Choque entre moléculas activadas y con orientación adecuada Hay un paso previo llamado estado de transición para alcanzar el que si es pequeña ¡CHOQUE EFECTIVO! donde Existe un complejo activado se necesita energía que se llama Energía de activación Hay reacción La reacción es más rápida. tal que Se van rompiendo enlaces de reactivos y formando enlaces de productos. recordemos

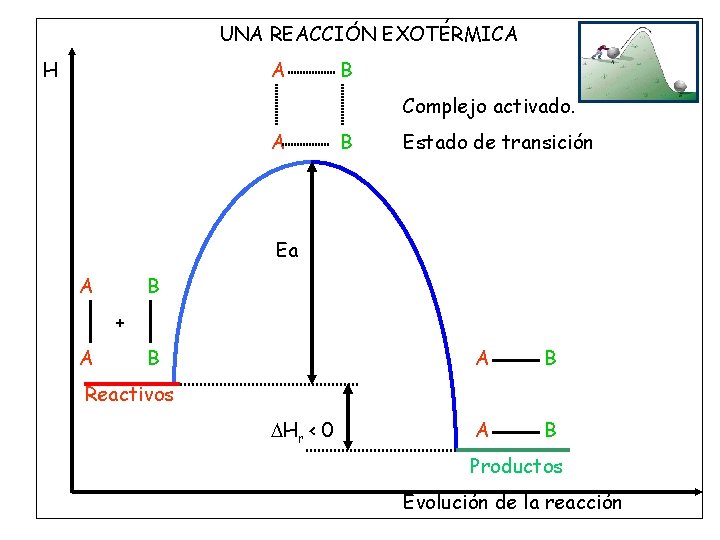
UNA REACCIÓN EXOTÉRMICA H A B Complejo activado. A B Estado de transición Ea A B + A B A B Reactivos Hr < 0 Productos Evolución de la reacción

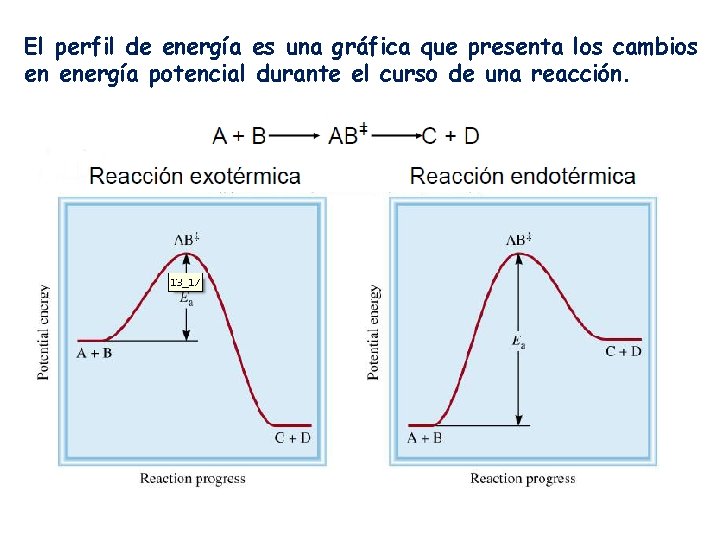
El perfil de energía es una gráfica que presenta los cambios en energía potencial durante el curso de una reacción.

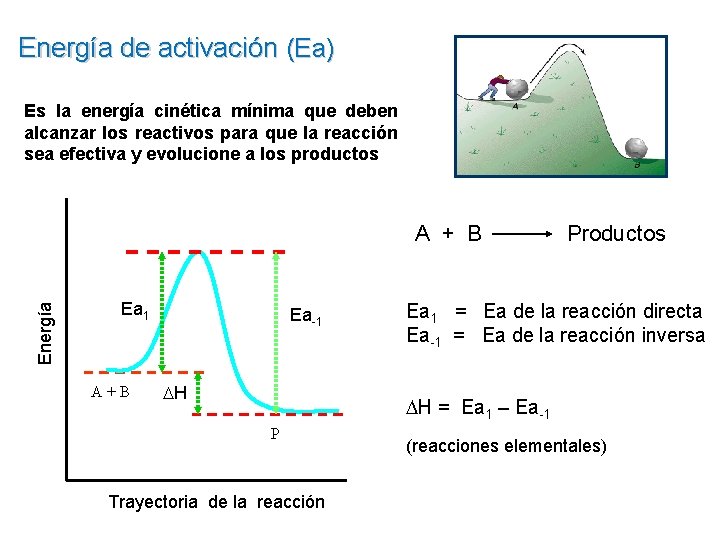
Energía de activación (Ea) Es la energía cinética mínima que deben alcanzar los reactivos para que la reacción sea efectiva y evolucione a los productos Energía A + B Ea 1 A+B Ea-1 H Productos Ea 1 = Ea de la reacción directa Ea-1 = Ea de la reacción inversa H = Ea 1 – Ea-1 P Trayectoria de la reacción (reacciones elementales)

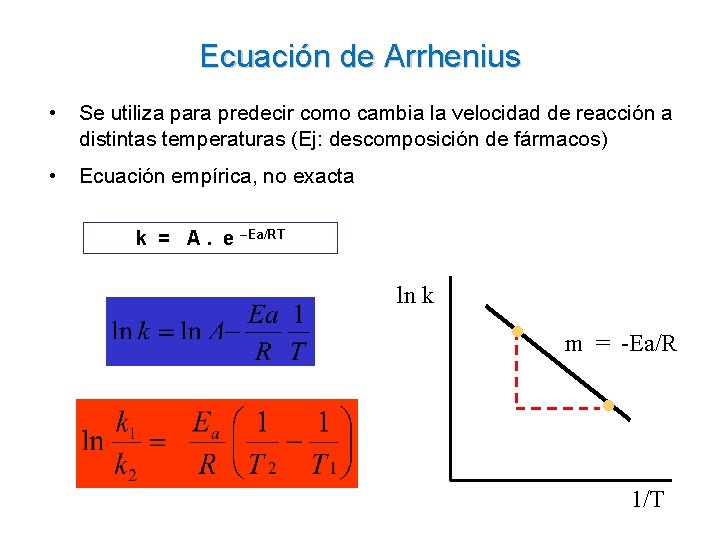
Ecuación de Arrhenius • Se utiliza para predecir como cambia la velocidad de reacción a distintas temperaturas (Ej: descomposición de fármacos) • Ecuación empírica, no exacta k = A. e –Ea/RT ln k m = -Ea/R 1/T

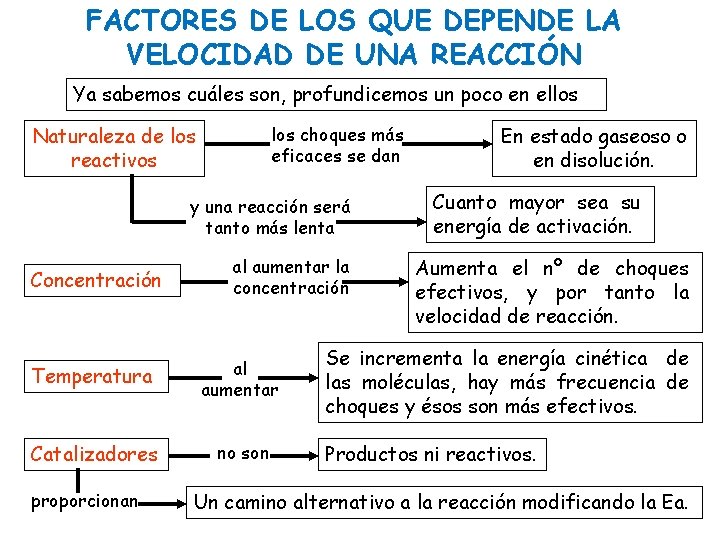
FACTORES DE LOS QUE DEPENDE LA VELOCIDAD DE UNA REACCIÓN Ya sabemos cuáles son, profundicemos un poco en ellos Naturaleza de los reactivos los choques más eficaces se dan y una reacción será tanto más lenta Concentración al aumentar la concentración Temperatura al aumentar Catalizadores no son proporcionan En estado gaseoso o en disolución. Cuanto mayor sea su energía de activación. Aumenta el nº de choques efectivos, y por tanto la velocidad de reacción. Se incrementa la energía cinética de las moléculas, hay más frecuencia de choques y ésos son más efectivos. Productos ni reactivos. Un camino alternativo a la reacción modificando la Ea.

RESUMEN DE LA CINETICA DE REACCIONES DE ORDEN CERO, ORDEN UNO, Y ORDEN DOS. Unidades de K M s-1 M-1 s-1

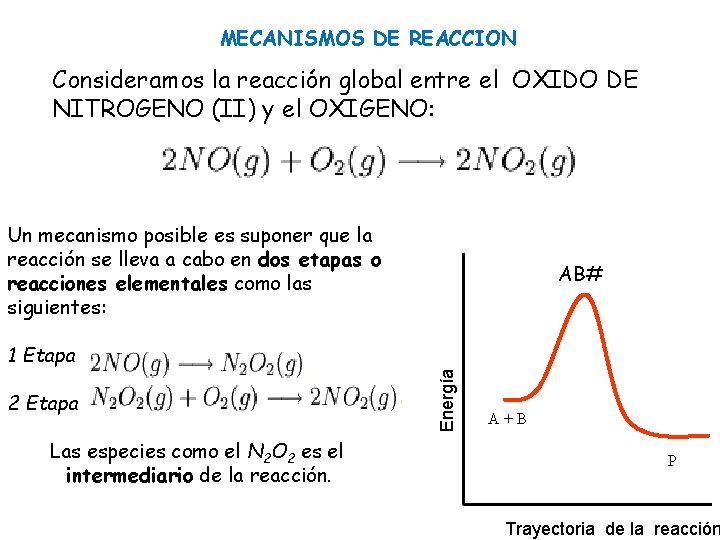
MECANISMOS DE REACCION Consideramos la reacción global entre el OXIDO DE NITROGENO (II) y el OXIGENO: Un mecanismo posible es suponer que la reacción se lleva a cabo en dos etapas o reacciones elementales como las siguientes: AB# 2 Etapa Las especies como el N 2 O 2 es el intermediario de la reacción. Energía 1 Etapa A+B P Trayectoria de la reacción


























