Reacciones de OxidoReduccin REDOX SEMANA 05 Licda Lilian










- Slides: 17

Reacciones de Oxido-Reducción (REDOX) SEMANA 05 Licda. Lilian Judith Guzmán Melgar

Reacciones de Oxido Reducción (Redox) Son las ecuaciones químicas en las cuales cambia el número de oxidación de los reactivos. En toda reacción de oxido-reducción los electrones se transfieren de una sustancia a otra. Si una sustancia pierde electrones otra debe ganarlos.

OXIDACION Es la pérdida de electrones o un aumento en el número de oxidación de un elemento hacia un valor más positivo. El reactivo que se oxida pierde electrones y también puede ganar átomos de oxígeno o perder átomos de hidrógeno.

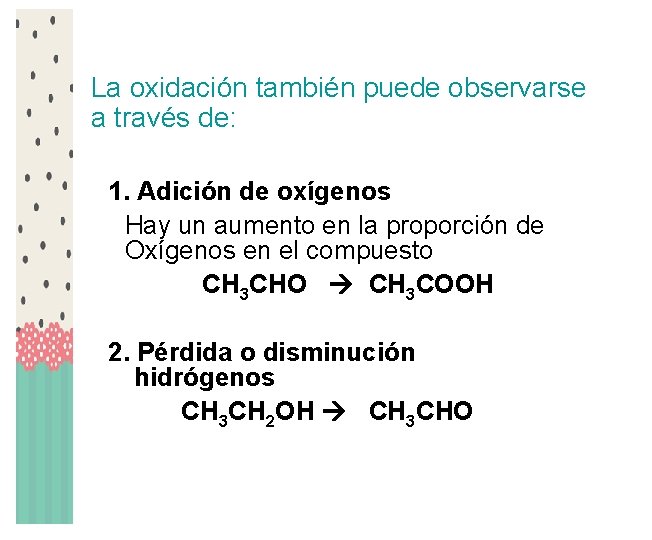
La oxidación también puede observarse a través de: 1. Adición de oxígenos Hay un aumento en la proporción de Oxígenos en el compuesto CH 3 CHO CH 3 COOH 2. Pérdida o disminución hidrógenos CH 3 CH 2 OH CH 3 CHO

REDUCCION Es la ganancia de electrones o una disminución en el número de oxidación hacia un valor menos positivo. El reactivo que se reduce gana electrones y también puede perder átomos de oxígeno o ganar átomos de hidrógeno.

La reducción también puede observarse a través de: 1. Pérdida de oxígenos (disminuye proporción de oxígeno en el compuesto): C 6 H 5 COOH C 6 H 5 CHO 2. Aumento en la proporción de hidrógenos: CH 3 COCOOH CH 3 CHOHCOOH

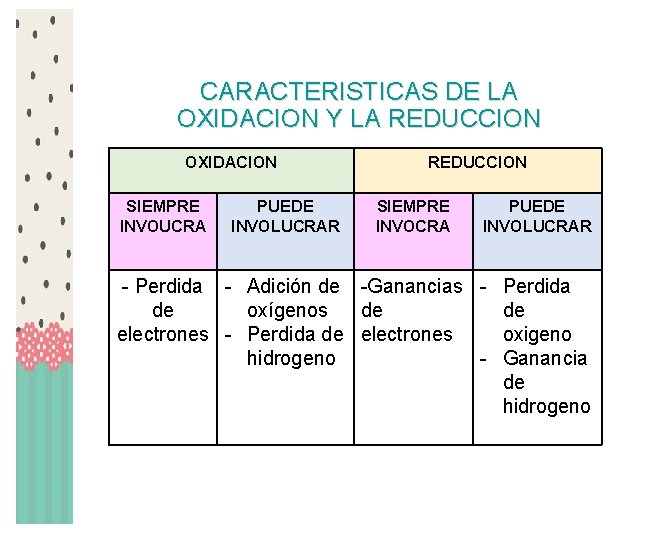
CARACTERISTICAS DE LA OXIDACION Y LA REDUCCION OXIDACION SIEMPRE INVOUCRA PUEDE INVOLUCRAR REDUCCION SIEMPRE INVOCRA PUEDE INVOLUCRAR - Perdida - Adición de -Ganancias de oxígenos de electrones - Perdida de electrones hidrogeno - Perdida de oxigeno Ganancia de hidrogeno


Agente Reductor y Agente Oxidante AGENTE REDUCTOR AGENTE OXIDANTE La sustancia que se oxida y que causa la reducción. Proporciona electrones La sustancia que se reduce y causa la oxidación. Acepta electrones

IMPORTANCIA BIOLOGICA § OXIDACIÓN DE LA GLUCOSA POR EL OXÍGENO Durante el metabolismo la glucosa reacciona con el oxigeno para producir CO 2, agua y energia C 6 H 12 O 6 + 6 O 2 → 6 CO 2 + 6 H 2 O +energía § FOTOSINTESIS Reducción de CO 2 por el agua Las plantas utilizan la energía solar para producir glucosa y oxígeno 6 CO 2 + 6 H 2 O + energía → C 6 H 12 O 6 + 6 O 2

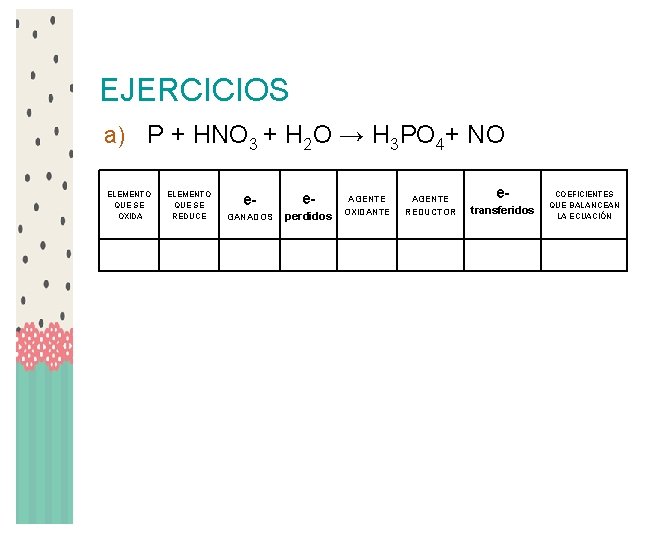
EJERCICIOS a) P + HNO 3 + H 2 O → H 3 PO 4+ NO ELEMENTO QUE SE OXIDA ELEMENTO QUE SE REDUCE e- e- GANADOS perdidos AGENTE OXIDANTE AGENTE REDUCTOR etransferidos COEFICIENTES QUE BALANCEAN LA ECUACIÓN

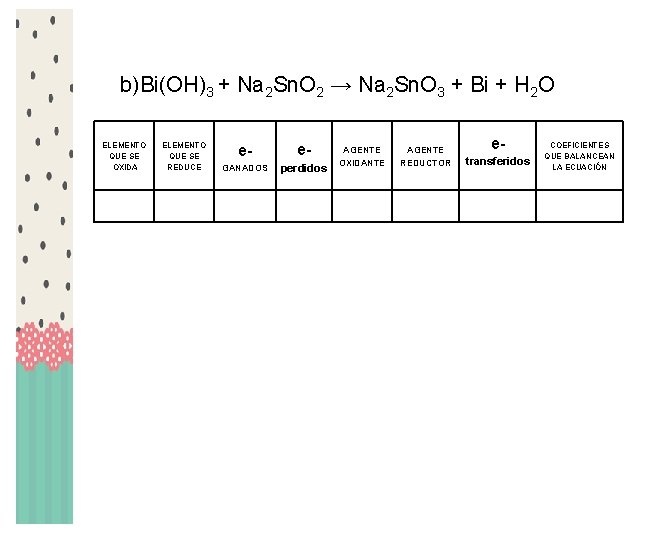
b)Bi(OH)3 + Na 2 Sn. O 2 → Na 2 Sn. O 3 + Bi + H 2 O ELEMENTO QUE SE OXIDA ELEMENTO QUE SE REDUCE e- e- GANADOS perdidos AGENTE OXIDANTE AGENTE REDUCTOR etransferidos COEFICIENTES QUE BALANCEAN LA ECUACIÓN

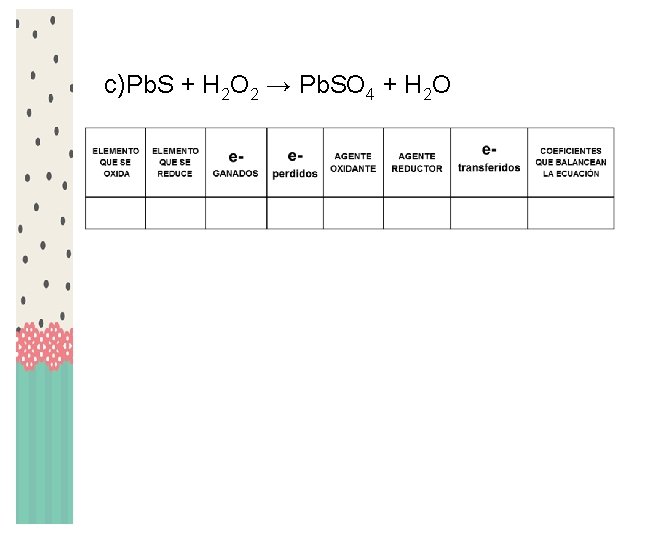
c)Pb. S + H 2 O 2 → Pb. SO 4 + H 2 O

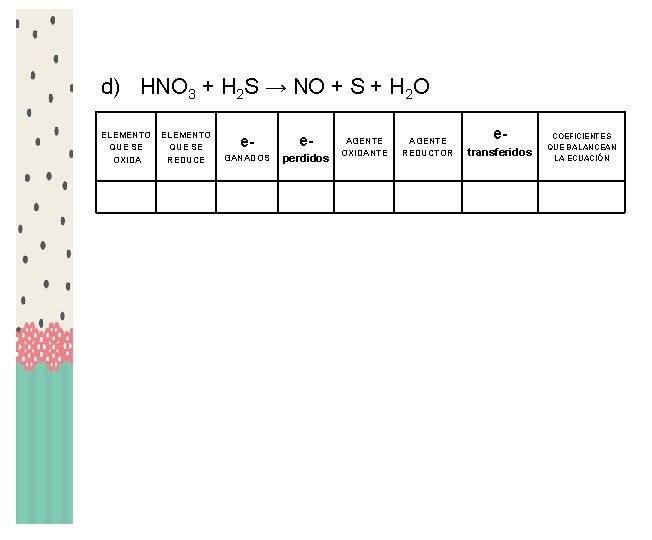
d) HNO 3 + H 2 S → NO + S + H 2 O ELEMENTO QUE SE OXIDA ELEMENTO QUE SE REDUCE e- e- GANADOS perdidos AGENTE OXIDANTE AGENTE REDUCTOR etransferidos COEFICIENTES QUE BALANCEAN LA ECUACIÓN

Las siguientes ecuaciones deben balancearse del lado de los productos Al + H 3 PO 4 → H 2 + Al. PO 4

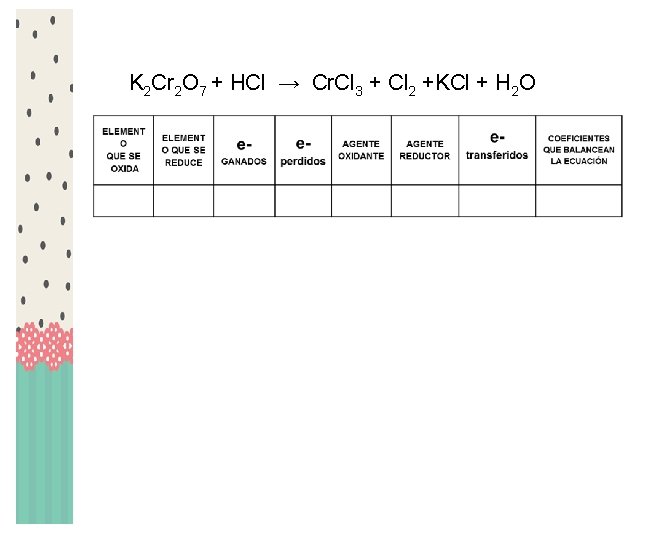
K 2 Cr 2 O 7 + HCl → Cr. Cl 3 + Cl 2 +KCl + H 2 O

Fin
 Ejemplos de reacciones redox
Ejemplos de reacciones redox Mapa conceptual de las reacciones redox
Mapa conceptual de las reacciones redox Reacciones redox
Reacciones redox Reacciones redox 2 bachillerato
Reacciones redox 2 bachillerato Arn mensajero
Arn mensajero Lilian de greef
Lilian de greef Lilian passos scatalon
Lilian passos scatalon Lilian alessa
Lilian alessa Lilian grego
Lilian grego Lilian rose goldstein
Lilian rose goldstein Openingswoord voorbeeld
Openingswoord voorbeeld Lilian origem
Lilian origem Lilian chan hku
Lilian chan hku Lilian benet
Lilian benet Lilian rolfe
Lilian rolfe Lilian schafirovits morillo
Lilian schafirovits morillo Ergonomy
Ergonomy Besuch im pfiffikus-haus material
Besuch im pfiffikus-haus material































