Prv zkon termodynamiky Zkon zachovania energie 1 Jouleov



































- Slides: 48

Prvý zákon termodynamiky Zákon zachovania energie 1

Jouleov mechanický ekvivalent tepla • James Joule ukázal, že mechanická energia sa mení na teplo a že teplo je iná forma energie • Ukázal, že 1 cal tepla je ekvivalentná 4. 184 J práce. 1 cal = 4. 184 J 2

Energia • Mechanická energia: KE, PE, E • Práca sa koná pri prenose energie. • Teplo je iná forma energie. Zákon zachovania energie rozšírený tak, aby mohol použiť aj na tepelné sústavy. 3

1. Zákon termodynamiky • Energia sa nedá vytvoriť, ani zničiť, iba sa môže meniť jej forma. • Energia izolovanej sústavy je konštantná • Nedá sa zostrojiť perpetum mobile • Nič nemôžete dostať zadarmo 4

Fyzikálne vlastnosti plynov • Plyny nemajú tvar ani objem. Prijímajú objem a tvar nádoby, v ktorej sa nachádzajú • Plyny sú veľmi stlačiteľné. S rastom tlaku klesá ich objem a naopak. • Plyny difundujú. Zaberú celý priestor, ktorý majú k dispozícii. • Plyny sa s inými plynmi okamžite zmiešajú. 5

Ideálny plyn • Je dokonale stlačiteľný • Molekuly nemajú vlastný objem • Medzi molekulami nepôsobia sily 6

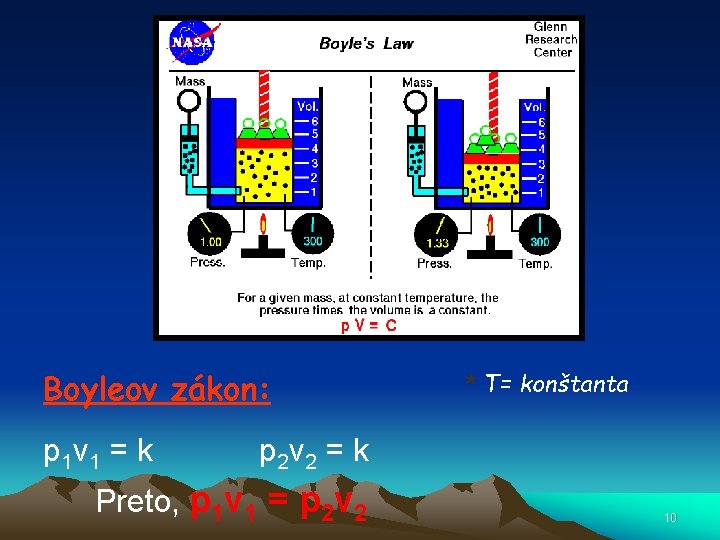
Boyleov zákon • Robert Boyle (1662) popísal vzťah medzi tlakom a objemom plynov. • So zvyšujúcim sa tlakom objem klesá za predpokladu, že teplota a množstvo plynu sú konštantné. 7

• Tlak a objem sú nepriamo úmerné. • Nepriama úmera znamená, že ak sa jedna premenná zvyšuje, druhá premenná klesá. 8

9

Boyleov zákon: p 1 v 1 = k * T= konštanta p 2 v 2 = k Preto, p 1 v 1 = p 2 v 2 10

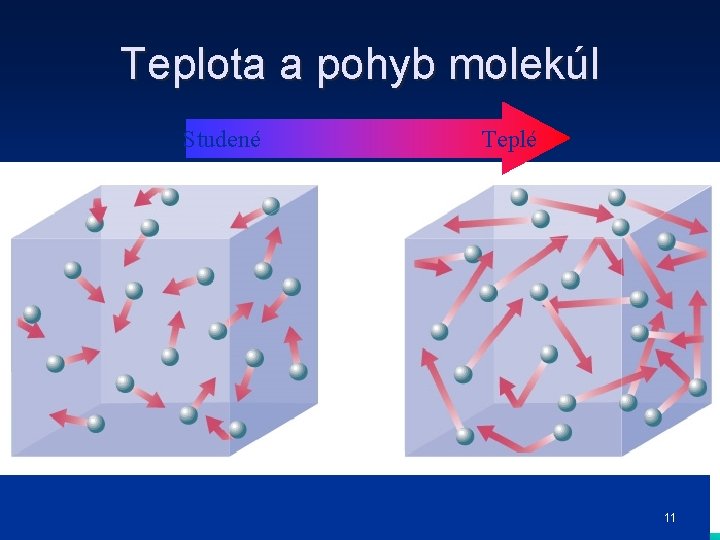
Teplota a pohyb molekúl Studené Teplé 11

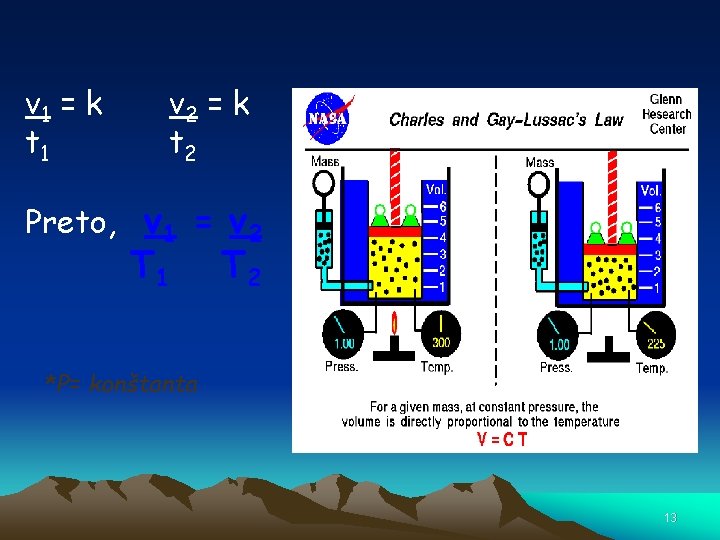
Charlesov zákon • Teplota je mierou kinetickej energie molekúl (pohybu molekúl), ktoré sa nachádzajú vo vzorke plynu. • Čím vyššia je teplota, tým rýchlejší je pohyb molekúl. • Čím je vyššia teplota tým sú molekuly od seba vzdialenejšie • Jacques Charles určil vzťah medzi objemom plynu a jeho teplotou 12

v 1 = k t 1 v 2 = k t 2 Preto, v 1 = v 2 T 1 T 2 *P= konštanta 13

• Teplota vplýva na objem a/alebo tlak plynu. • Ak teplota klesá, objem plynu klesá • Ak teplota rastie, objem plynu rastie 14

• Toto nazývame priama úmera, pretože obe premenné sa menia rovnomerne. 15

16

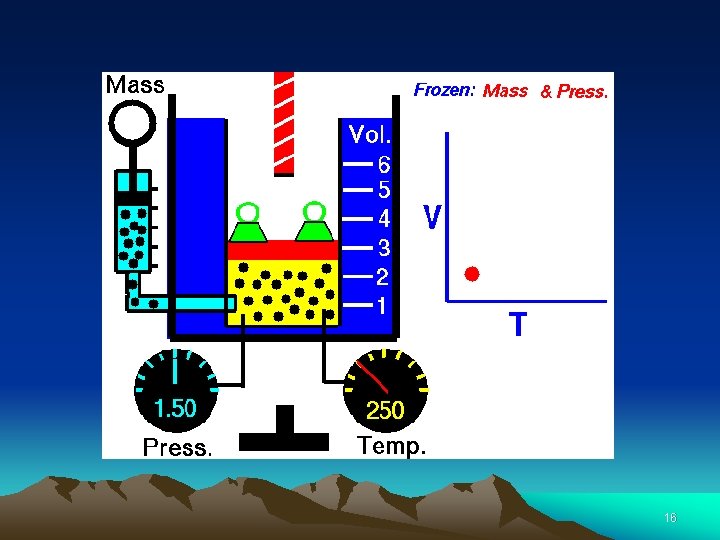
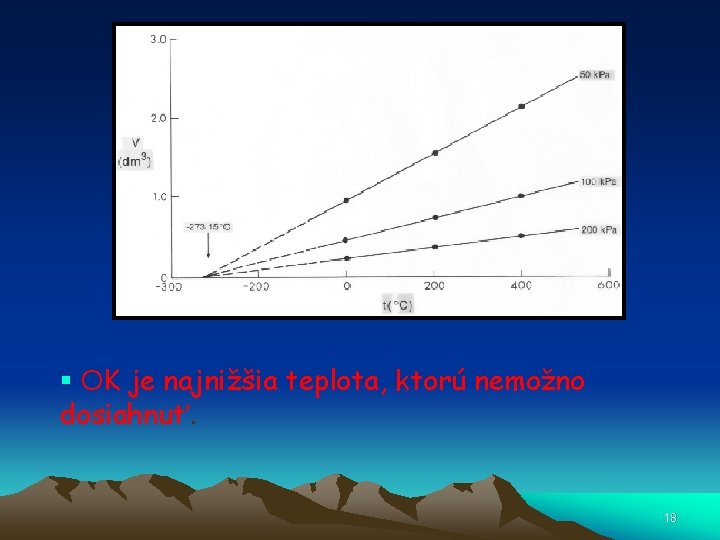
• Teplota 273 o. C je „nula Kelvinov (0 K)” • Pri prechode z C na Kelvin pripočítajte 273. • Pri všetkých termodynamických výpočtoch používajte • Kelvinovú stupnicu !!!! 17

§ OK je najnižšia teplota, ktorú nemožno dosiahnuť. 18

Gay-Lussacov zákon • Pri konštantnom množstve látky a pri konštantnom objeme je tlak priamo úmerný teplote. • So zvyšovaním teploty rastie tlak plynu. 19

Gay-Lussacov zákon: p 1 = k T 1 p 2 = k T 2 Preto, p 1 = p 2 T 1 T 2 *V= konštanta 20

Spojený zákon • Pri spojení Boylovho, Charlesovho a Gay. Lussacovho zákona dostaneme spojený zákon. • Spojený zákon udáva vzťah medzi P, V a T. 21

Mólový objem plynov • Avogadro • V 273 K = 22, 4 litra = 0, 022 m³ 22

23

Stavová rovnica ideálneho plynu pv = n. RT v = objem (m³) p = tlak (Pa) T = teplota (K) n = látkové množstvo (mol) R = plynová konštanta (8. 314 J/mol. K) 24

1. Zákon termodynamiky • Uvažujme valec s piestom, v ktorom sa nachádza plyn charkterizovaný P, V, T & n. 25

1. Zákon termodynamiky • Čo sa stane s plynom keď sa piest posunie smerom do vnútra valca? 26

1. Zákon termodynamiky • Ak je valec izolovaný, zvýši sa teplota, atómy sa budú pohybovať rýchlejšie a tlak sa zvýši. • Má plyn vyššiu vnútornú energiu? 27

1. Zákon termodynamiky • Niekto zvonku stlačil piest smerom dovnútra. Vykonal prácu. • W´ = F x • =(PA) x x • w´ =P V 28

1. Zákon termodynamiky • Práca, ktorá bola vykonaná na plyne sa rovná zmene jeho vnútornej energie, x w´ = U 29

1. Zákon termodynamiky • Zmeňme teraz situáciu: • Upevnime piest v jeho pôvodnej polohe. • Položme valec na varič. • Čo sa stane s plynom? 30

Do plynu sa prenáša teplo. Atómy sa rýchlejšie pohybujú, ich vnútorná energia rastie. q = teplo v Jouloch U = zmena vnútornej energie v Jouloch. q = U 31

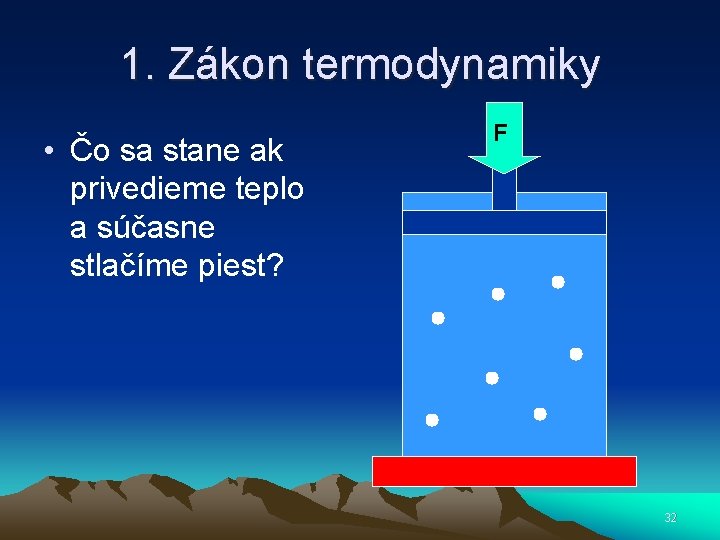
1. Zákon termodynamiky • Čo sa stane ak privedieme teplo a súčasne stlačíme piest? F 32

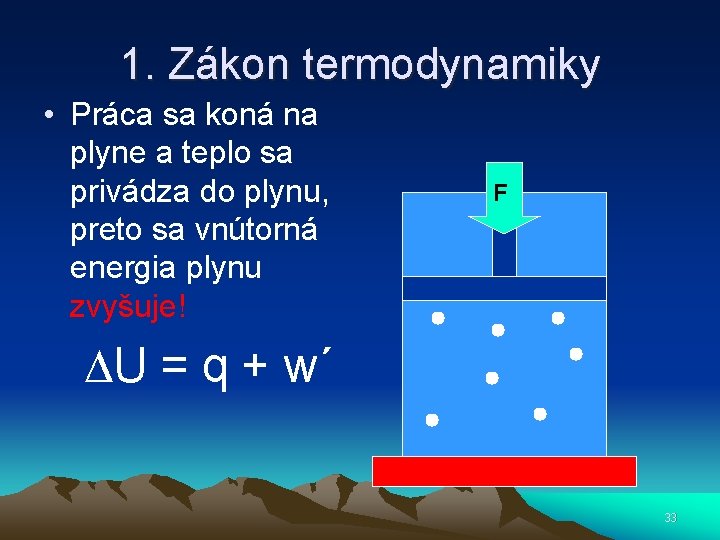
1. Zákon termodynamiky • Práca sa koná na plyne a teplo sa privádza do plynu, preto sa vnútorná energia plynu zvyšuje! F U = q + w´ 33

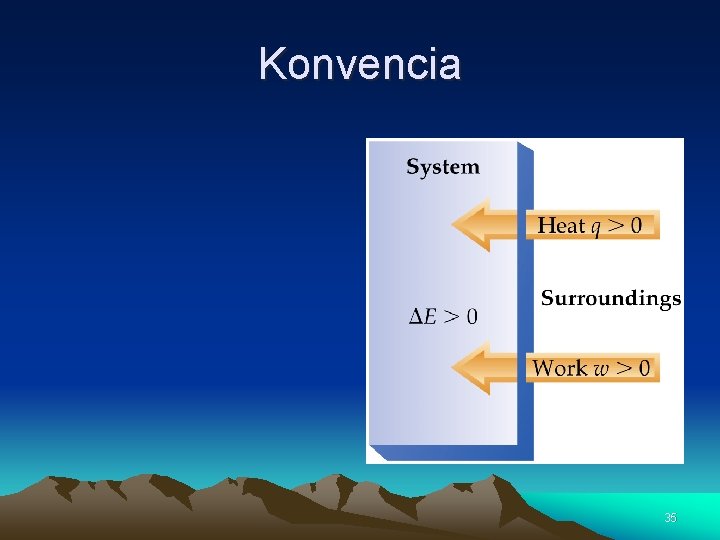
1. Zákon termodynamiky Konvencie o znamienkach: • Teplo privádzané do sústavy má kladné znamienko, odvádzané teplo má záporné znamienko • Práca, ktorá sa koná na sústave má kladné znamienko, práca, ktorú koná sústava (plyn) má záporné znamienko • Zvýšenie teploty spôsobuje zvýšenie vnútornej energie. 34

Konvencia 35

1. Zákon termodynamiky • Pre nekonečne malé zmeny: • d U = d q + d w´ • d. U= d q - d w • U je termodynamická funkcia • q a w nie sú ! 36

Objemová práca • Práca, ktorú vykonáva plyn pri pohybe piestu smerom hore • Práca, ktorú vykonáva okolie pri pohybe piestu dolu • δw = d(PV) • Izobarický: δw = Pd. V • Izochorický: V = konšt. , d. V=0; δw = 0 37

Izochorický proces • Proces, pri ktorom je objem konštantný • Keď je objem konštantný nekoná sa práca • Preto pre izochorickú sústavu : U= q. V 38

Izobarický proces • • • d. U = δq. P – Pd. V U 2 -U 1 = q. P – P(V 2 -V 1) (U 2+PV 2)- (U 2+PV 2) = q. P H 2 -H 2 = q. P d. H = δq. P H = U + PV MÓLOVÁ ENTALPIA (J/mol) 39

Tepelná kapacita Pri konštantnom objeme Izochorická mólová tepelná kapacita J/mol. K d. U = CV d. T Pri konštantnom tlaku Izobarická mólová tepelná kapacita J/mol. K d. H=CPd. T 40

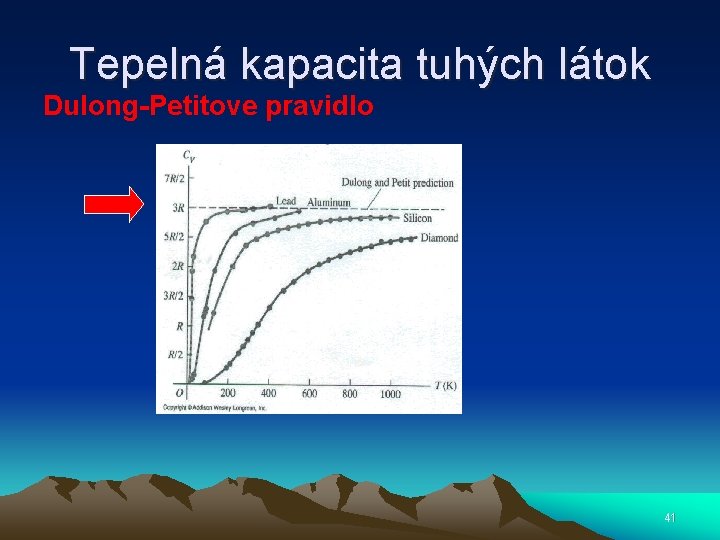
Tepelná kapacita tuhých látok Dulong-Petitove pravidlo 41

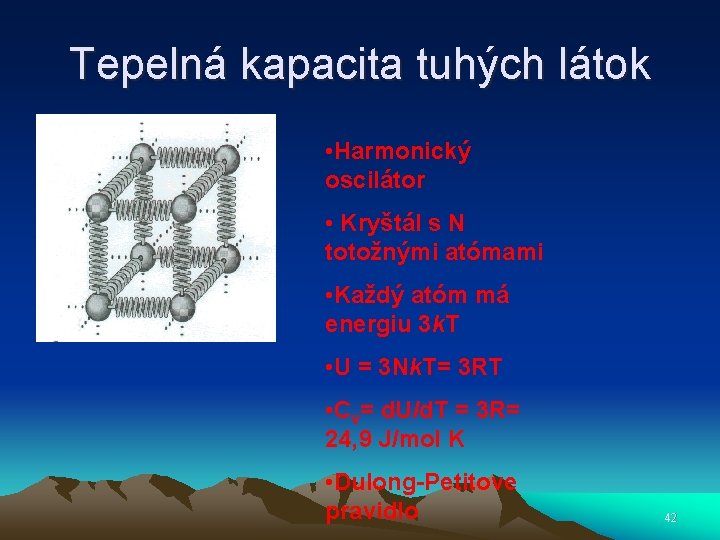
Tepelná kapacita tuhých látok • Harmonický oscilátor • Kryštál s N totožnými atómami • Každý atóm má energiu 3 k. T • U = 3 Nk. T= 3 RT • Cv= d. U/d. T = 3 R= 24, 9 J/mol K • Dulong-Petitove pravidlo 42

Tepelná kapacita-závislosť od teploty • Cp = a +b. T + c. T² reálne tuhé látky • Pri každej fázovej premen sa tepelná kapacita zmení skokom • Tuhé látky : Cp ~ Cv • V ideálnych plynoch: Cp= 5/2 R a Cv= 3/2 R • Mayerova rovnica Cp-Cv = R • Cp/Cv = κ 43

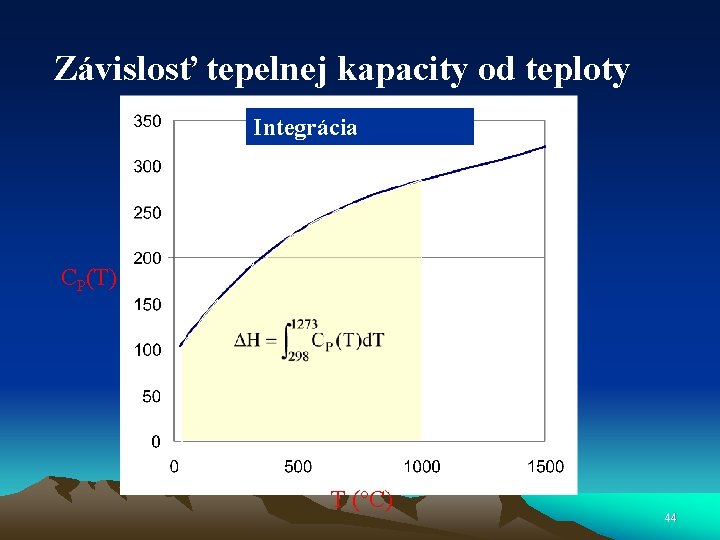
Závislosť tepelnej kapacity od teploty Integrácia CP(T) T (°C) 44

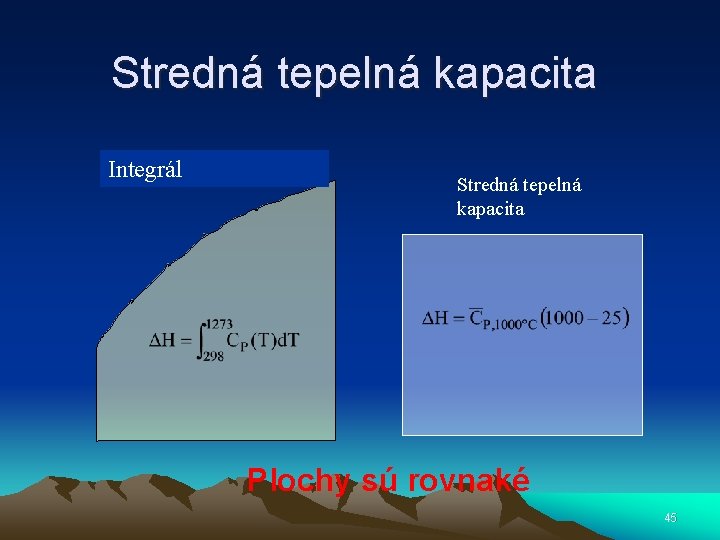
Stredná tepelná kapacita Integrál Stredná tepelná kapacita Plochy sú rovnaké 45

Izotermický proces • Sústava má konštantnú teplotu, preto d. T=0 • d. U = δq. T – Pd. V • CV d. T = δq. T - RT (d. V/V) • δq. T = δ w =RT (d. V/V) • q. T = w=RT ln( V 2 / V 1) 46

Adiabatický proces • Sústava neprijíma teplo z okolia ani ho neodovzdáva do okolia. • Pretože nejestvuje prenos tepla: U = - w • Cv d. T = - Pd. V 47

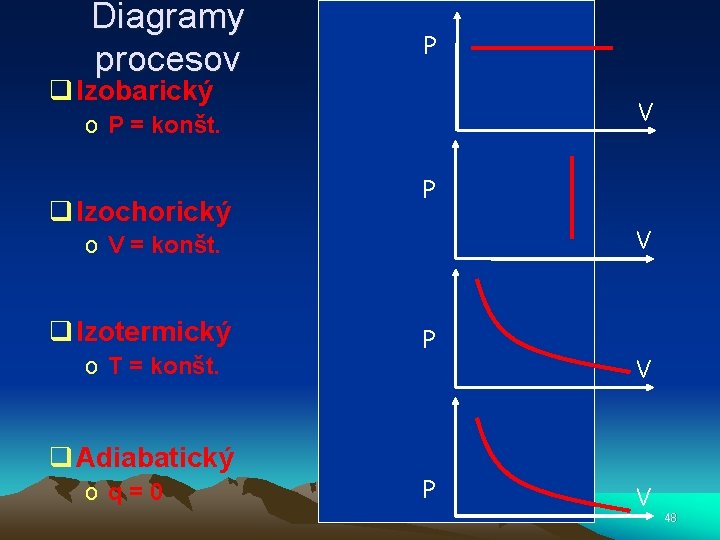
Diagramy procesov P q Izobarický V o P = konšt. q Izochorický P V o V = konšt. q Izotermický o T = konšt. q Adiabatický o q=0 P P V V 48
 Zákon zachovania hmotnosti
Zákon zachovania hmotnosti Potentielle energie in elektrische energie
Potentielle energie in elektrische energie Prv jarny den
Prv jarny den Prv3
Prv3 Prv jarny den
Prv jarny den Scentsy fundraiser
Scentsy fundraiser Unidirectional variable displacement pump symbol
Unidirectional variable displacement pump symbol Snellov zakon lomu
Snellov zakon lomu Noikov
Noikov Zkon
Zkon Kazda akcia vyvolava reakciu
Kazda akcia vyvolava reakciu Zkon
Zkon Zkon
Zkon Zkon
Zkon Zkon
Zkon Zkon
Zkon O ped
O ped Mechanická energie
Mechanická energie Wta gesuch
Wta gesuch énergie rayonnante exemple
énergie rayonnante exemple énergie renouvelables et non renouvelables
énergie renouvelables et non renouvelables Case independente energetic
Case independente energetic Kinetická energie
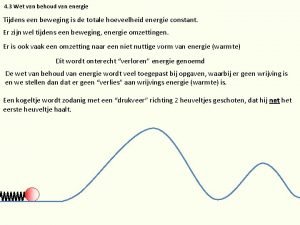
Kinetická energie Wet van behoud van energie
Wet van behoud van energie Hladiny potenciálnej energie
Hladiny potenciálnej energie Erste kosmische geschwindigkeit
Erste kosmische geschwindigkeit Rijn en ijssel energie
Rijn en ijssel energie énergie de liaison d'un noyau
énergie de liaison d'un noyau Heinrich hertz 1887
Heinrich hertz 1887 Mechanická energie
Mechanická energie Vzájemná přeměna polohové a pohybové energie tělesa
Vzájemná přeměna polohové a pohybové energie tělesa Wet van energiebehoud
Wet van energiebehoud Reactiewarmte berekenen scheikunde
Reactiewarmte berekenen scheikunde Instalatie folosita pentru producerea vaporilor
Instalatie folosita pentru producerea vaporilor Vakuumenergie dunkle energie
Vakuumenergie dunkle energie Newton se 2de wet
Newton se 2de wet Energie potentielle ressort
Energie potentielle ressort Energie
Energie Innere energie teilchenmodell
Innere energie teilchenmodell Sodexo energie et maintenance
Sodexo energie et maintenance Principiul minimului de energie
Principiul minimului de energie Chaine d'information et d'énergie portail automatique
Chaine d'information et d'énergie portail automatique Ren energie
Ren energie Bande d'énergie
Bande d'énergie Les sources d'énergie non renouvelable
Les sources d'énergie non renouvelable Tok energie
Tok energie Mechanická energie
Mechanická energie Výpočet tlakové síly
Výpočet tlakové síly Biomasa definitie
Biomasa definitie