PROPIEDADES DE LA MATERIA QU ES LA MATERIA





































- Slides: 53

PROPIEDADES DE LA MATERIA.

QUÉ ES LA MATERIA Denominamos materia a todo aquello que podemos percibir con nuestros sentidos, es decir, todo lo que podemos ver, oler, tocar, oír o saborear es materia.

PROPIEDADES GENERALES. ¢ Materia es todo aquello que tiene masa y volumen (es decir todo aquello que ocupa un lugar en el espacio). ¢ Por lo que diremos que la masa y el volumen son propiedades generales de la materia.

ESTAS SON LAS PROPIEDADES GENERALES DE LA MATERIA O EXTENSIVAS. Son aquellas propiedades de un cuerpo cuyo valor medible depende de la cantidad de masa, ejemplos: volumen, peso, número de moles, inercia, porosidad. Estas propiedades las presentan todos los cuerpos, por lo que no se emplean para diferenciar una sustancia de otra y ellas son: Volumen, peso, inercia, porosidad, y número de moles

Masa La masa, es la magnitud que cuantifica la cantidad de materia de un cuerpo. ¢ La unidad de masa, en el Sistema Internacional de Unidades es el kilogramo (kg). ¢ Es una cantidad escalar y no debe confundirse con el peso, que es una fuerza. ¢

MASA ¢ Los múltiplos y submúltiplos del kilogramo son los indicados en la siguiente tabla: Nombre Abreviatura Equivalente en kg Equivalente en g Tonelada Tm 1. 000 kg 1. 000 g kilogramo kg 1. 000 g gramo g 0'001 kg 1 g decigramo dg 0'0001 kg 0'1 g centigramo cg 0'00001 kg 0'01 g miligramo mg 0'000001 kg 0'001 g

La masa Hemos definido como materia todo aquello que tiene masa y ocupa un lugar en el espacio. En el sistema métrico, las unidades utilizadas para medir la masa son, normalmente, los gramos, kilogramos o miligramos. Aunque la unidad fundamental de masa es el kilogramo, el sistema de múltiplos y submúltiplos se estableció a partir del gramo: 1 Kilogramo (Kg) = 1000 gramos (103 g) y 1 miligramo (mg) = una milésima de gramo (10 -3 g)

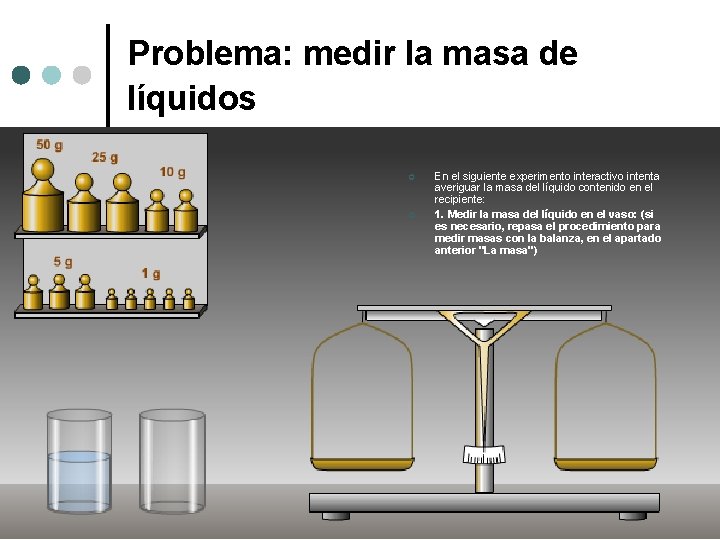
Problema: medir la masa de líquidos ¢ ¢ En el siguiente experimento interactivo intenta averiguar la masa del líquido contenido en el recipiente: 1. Medir la masa del líquido en el vaso: (si es necesario, repasa el procedimiento para medir masas con la balanza, en el apartado anterior "La masa")

El volumen ¢ Es una propiedad general de la materia que se define como el lugar que ocupa un cuerpo en el espacio y que no puede ser ocupado por otro cuerpo.

VOLUMEN ¢ El volumen puede medirse en muchas unidades: pintas, galones, arrobas, etc. pero las medidas más usadas son el litro (l) y la unidad del S. I. el metro cúbico (m 3) Nombre Abreviatura Equivalente en m 3 Equivalente en l Hectómetro cúbico Hm 3 10. 000 l metro cúbico m 3 1. 000 l Hectolitro hl 0'1 m 3 100 l decímetro cúbico dm 3 0'001 m 3 1 l centímetro cúbico c. c. o cm 3 0'000001 m 3 0'001 l decilitro dl 0'0001 m 3 0'1 l centilitro cl 0'00001 m 3 0'01 l mililitro ml 0'000001 m 3 0'001 l

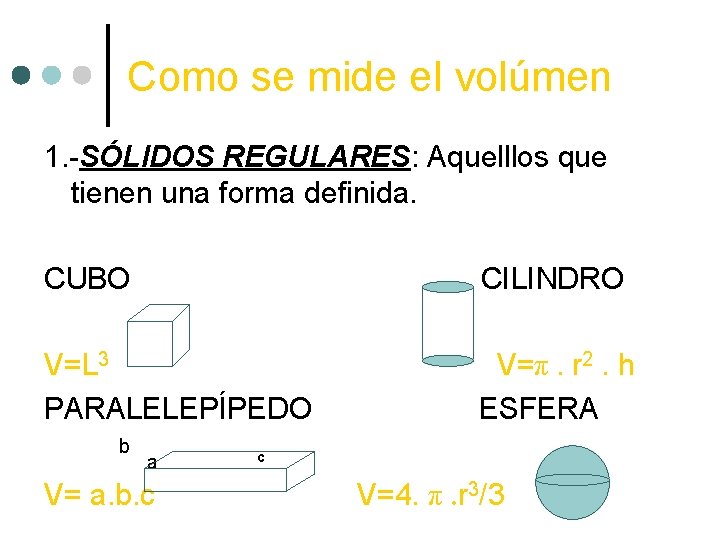
Como se mide el volúmen 1. -SÓLIDOS REGULARES: Aquelllos que tienen una forma definida. CUBO CILINDRO V=L 3 PARALELEPÍPEDO V=π. r 2. h ESFERA b a V= a. b. c c V=4. π. r 3/3

El volumen ¢ ¢ ¢ Medir el volumen de la corona: Añade la corona a la probeta (arrastrándola con el ratón) y observa y anota el volumen alcanzado por el agua. El volumen de la corona corresponde a la diferencia entre volumen que alcanza el agua con ella sumergida y el volumen de agua inicial.

La temperatura ¢ ¢ La Temperatura es una propiedad de la materia que está relacionada con la sensación de calor o frío que se siente en contacto con ella. Cuando tocamos un cuerpo que está a menos temperatura que el nuestro sentimos una sensación de frío, y al revés de calor. Sin embargo, aunque tengan una estrecha relación, no debemos confundir la temperatura con el calor. Cuando dos cuerpos, que se encuentran a distinta temperatura, se ponen en contacto, se produce una transferencia de energía, en forma de calor, desde el cuerpo caliente al frío, esto ocurre hasta que las temperaturas de ambos cuerpos se igualan. En este sentido, la temperatura es un indicador de la dirección que toma la energía en su tránsito de unos cuerpos a otros. l La medida • El instrumento utilizado habitualmente para medir la temperatura es el termómetro. Los termómetros de líquido encerrado en vidrio son los más populares; se basan en la propiedad que tiene el mercurio, y otras sustancias (alcohol coloreado, etc. ), de dilatarse cuando aumenta la temperatura. El líquido se aloja en una burbuja -bulboconectada a un capilar (tubo muy fino). Cuando la temperatura aumenta, el líquido se expande por el capilar, así, pequeñas variaciones de su volumen resultan claramente visibles. l Escalas • Actualmente se utilizan tres escalas para medir al temperatura, la escala Celsius es la que todos estamos acostumbrados a usar, la Fahrenheit se usa en los países anglosajones y la escala Kelvin de uso científico.

Grados de temperatura

La temperatura ¢ ¢ ¢ Actividad: Medir las temperaturas de fusión y ebullición del agua en las distintas escalas. Enciende el mechero pulsando el botón "Encender", para hacer hervir el agua e introduce el termómetro en los vasos (arrastrándolo con el ratón) para medir las temperaturas. Elige la escala del termómetro arrastrando el deslizador.

Densidad ¢ ¢ En física, la densidad, simbolizada habitualmente por la letra griega d y denominada en ocasiones masa específica, es una magnitud referida a la cantidad de masa contenida en un determinado volumen, y puede utilizarse en términos absolutos o relativos. En términos sencillos, un objeto pequeño y pesado, como una piedra o un trozo de plomo, es más denso que un objeto grande y liviano, como un corcho o un poco de espuma.

La densidad ¢ La densidad de una sustancia es el cociente entre la masa y el volumen: ¢ Densidad = Masa/Volumen ¢ ¢ La masa y el volumen son propiedades generales o extensivas de la materia, es decir son comunes a todos los cuerpos materiales y además dependen de la cantidad o extensión del cuerpo. En cambio la densidad es una propiedad característica, ya que nos permite identificar distintas sustancias. l ¢ d = m/V Por ejemplo, muestras de cobre de diferentes pesos 1, 00 g, 10, 5 g, 264 g, . . . todas tienen la misma densidad, 8, 96 g/cm 3. La densidad se puede calcular de forma directa midiendo, independientemente, la masa y el volumen de una muestra:

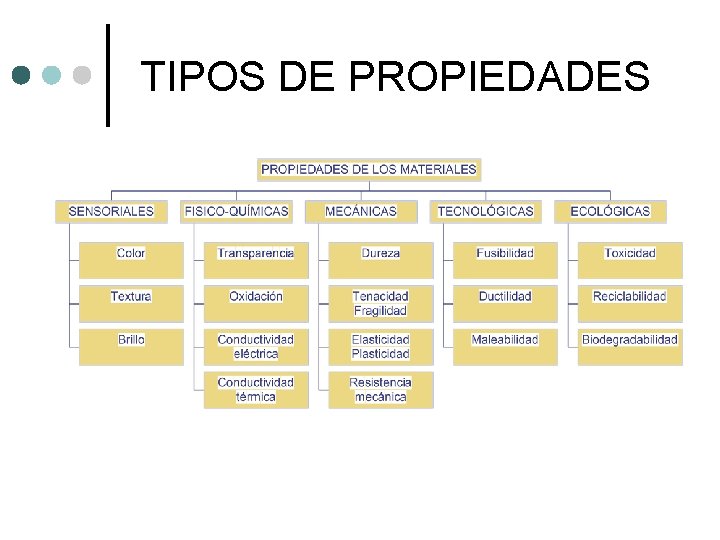
PROPIEDADES FÍSICAS INTENSIVAS O ESPECÍFICAS DE LA MATERIA. Estas propiedades no las que presentan todos los cuerpos, ya que no dependen de la cantidad de masa, son importantes porque permiten distinguir a un cuerpo de otro.

TIPOS DE PROPIEDADES

LA MATERIA ESTADOS DE LA MATERIA Se distinguen en la materia 3 estados fundamentales que son el sólido, el líquido y el gaseoso. Existe sin embargo un cuarto estado que se ha conseguido a temperaturas muy altas, en el cual todas la s moléculas se hallan disociadas en sus respectivos átomos y la mayoría de los átomos en forma iónica. Se denomina plasma. En este estado se hallan, además de los iones, muchas partículas elementales como protones, electrones y neutrones.

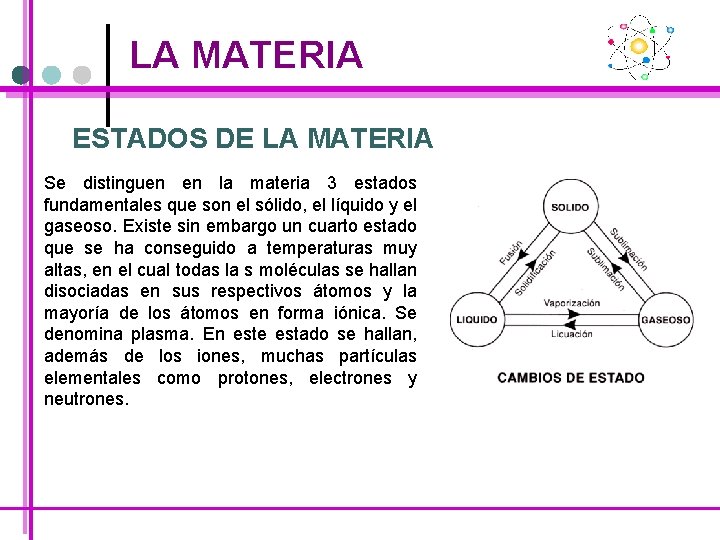
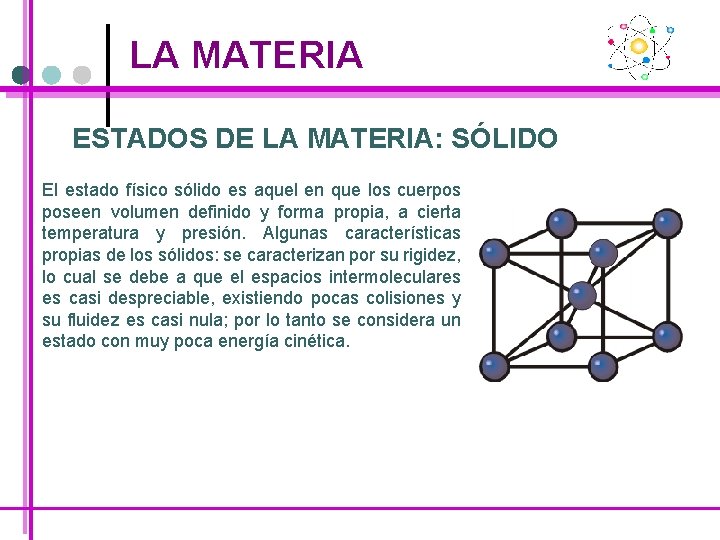
LA MATERIA ESTADOS DE LA MATERIA: SÓLIDO El estado físico sólido es aquel en que los cuerpos poseen volumen definido y forma propia, a cierta temperatura y presión. Algunas características propias de los sólidos: se caracterizan por su rigidez, lo cual se debe a que el espacios intermoleculares es casi despreciable, existiendo pocas colisiones y su fluidez es casi nula; por lo tanto se considera un estado con muy poca energía cinética.

LA MATERIA ESTADOS DE LA MATERIA: LÍQUIDO El estado físico Líquido es aquel que posee un volumen definido, pero no forma propia. Algunas características propias de los líquidos: son que sus partículas se encuentran algo separadas, ligeramente mayor al de los sólidos, existen considerables colisiones provocando una fluidez con mayor o menor resistencia en algunos casos. Posee una energía cinética intermedia entre los estados sólidos y gaseosos. Tomado del libro texto Freddy Suárez. Editorial Romor. Lic. Lisbeth Villarroel Garzaro

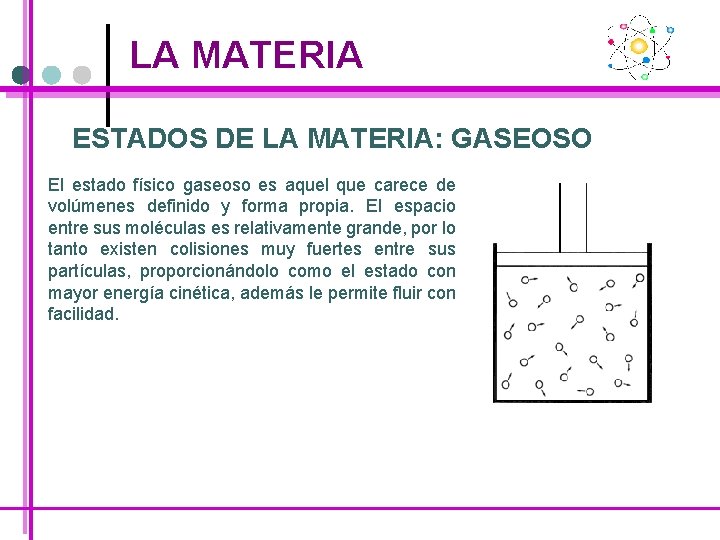
LA MATERIA ESTADOS DE LA MATERIA: GASEOSO El estado físico gaseoso es aquel que carece de volúmenes definido y forma propia. El espacio entre sus moléculas es relativamente grande, por lo tanto existen colisiones muy fuertes entre sus partículas, proporcionándolo como el estado con mayor energía cinética, además le permite fluir con facilidad.

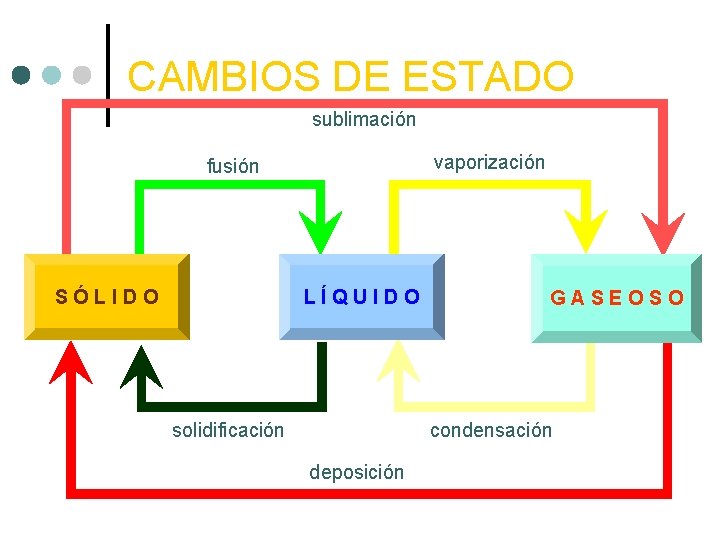
CAMBIOS DE ESTADO sublimación vaporización fusión SÓLIDO LÍQUIDO solidificación GASEOSO condensación deposición

CAMBIOS DE ESTADO. ¢ ¢ ¢ Al calentar suficientemente un sólido se convierte en líquido. Calentándolo más pasará a gas. Puede haber también paso de sólido a gas: es la sublimación.

PUNTO DE FUSIÓN Y PUNTO DE EBULLICIÓN. ¢ Cuando se ponen en contacto dos sustancias a distinta temperatura, evolucionan de forma que el cuerpo a mayor temperatura la disminuye y el que tenía menor temperatura la aumenta hasta que al final los dos tienen la misma temperatura. ¢ Decimos que la sustancia a mayor temperatura ha cedido calor a la sustancia que tenía menor temperatura. ¢ PUNTO DE FUSIÓN: Temperatura que permanece constante mientras el sistema cambia de estado SÓLIDO a estado LÍQUIDO. Depende de la presión del sistema. ¢ PUNTO DE EBULLICIÓN: Temperatura que permanece constante mientras el sistema cambia de estado LÍQUIDO a estado GASEOSO. Depende de la presión del sistema.

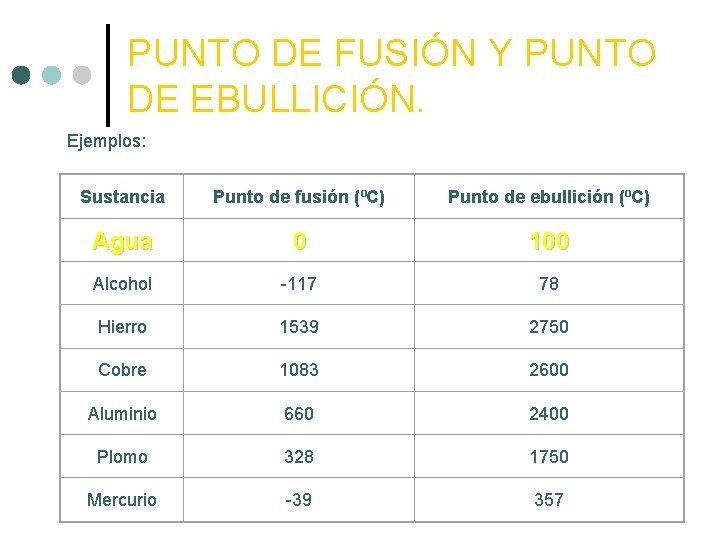
PUNTO DE FUSIÓN Y PUNTO DE EBULLICIÓN. Ejemplos: Sustancia Punto de fusión (ºC) Punto de ebullición (ºC) Agua 0 100 Alcohol -117 78 Hierro 1539 2750 Cobre 1083 2600 Aluminio 660 2400 Plomo 328 1750 Mercurio -39 357

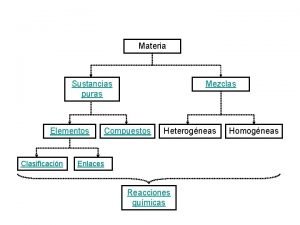
CLASIFICACIÓN DE LA MATERIA

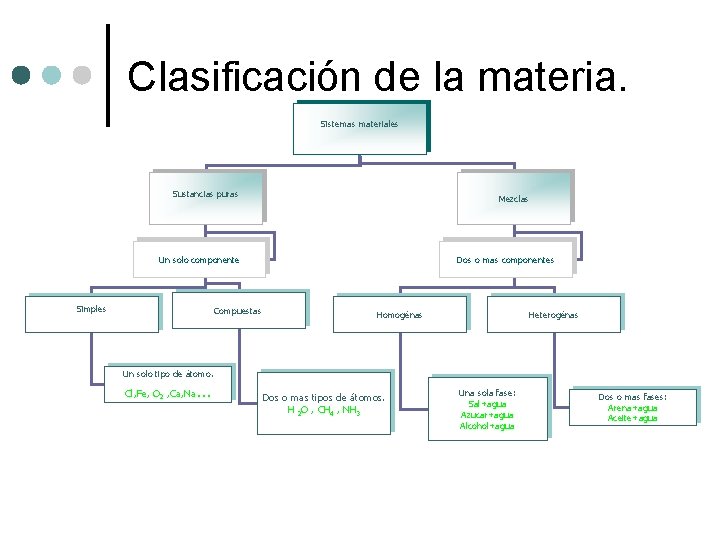
Clasificación de la materia. Sistemas materiales Sustancias puras Mezclas Un solo componente Simples Compuestas Dos o mas componentes Homogénas Heterogénas Un solo tipo de átomo. … Cl, Fe, O 2 , Ca, Na Dos o mas tipos de átomos. H 2 O , CH 4 , NH 3 Una sola fase: Sal+agua Azucar+agua Alcohol+agua Dos o mas fases: Arena+agua Aceite+agua

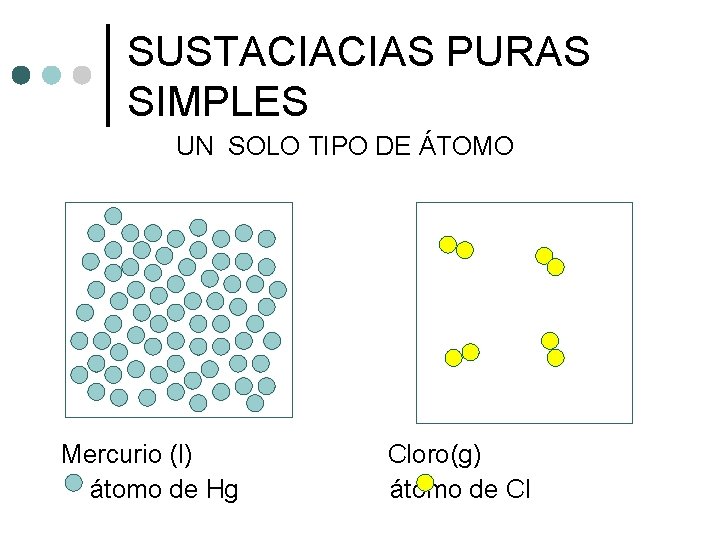
SUSTACIACIAS PURAS SIMPLES UN SOLO TIPO DE ÁTOMO Mercurio (l) átomo de Hg Cloro(g) átomo de Cl

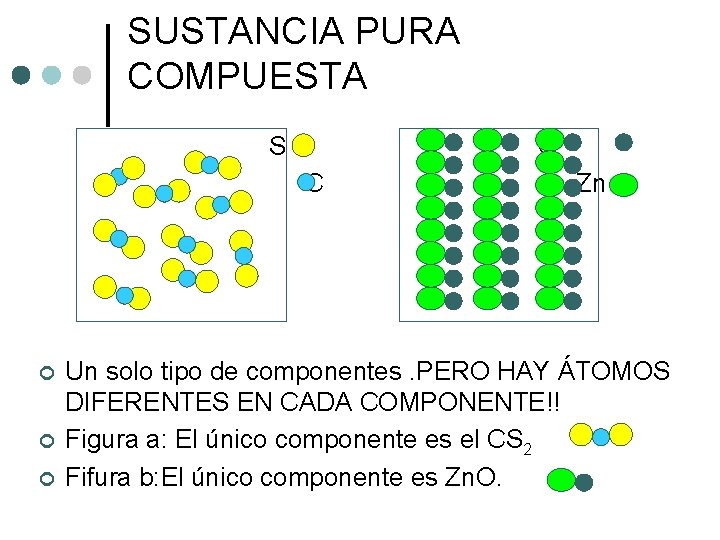
SUSTANCIA PURA COMPUESTA S O C ¢ ¢ ¢ Zn Un solo tipo de componentes. PERO HAY ÁTOMOS DIFERENTES EN CADA COMPONENTE!! Figura a: El único componente es el CS 2 Fifura b: El único componente es Zn. O.

MEZCLAS ¢ ¢ Formada por dos o mas componentes. En este caso formada por moléculas de hidrógeno y oxígeno.

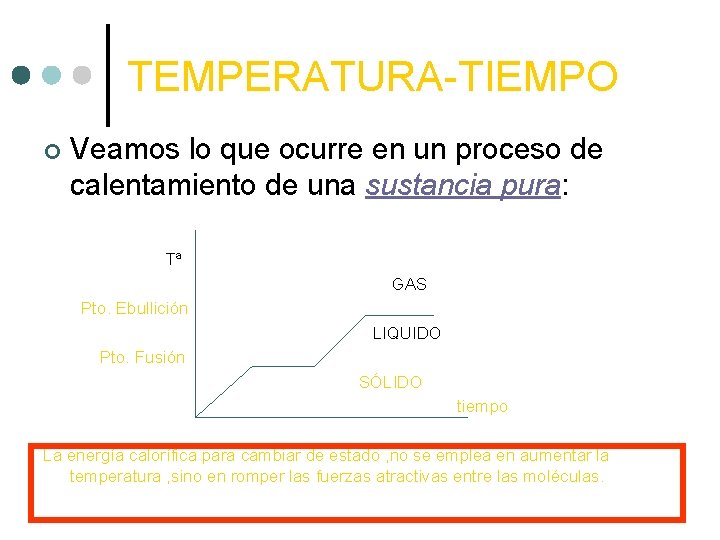
TEMPERATURA-TIEMPO ¢ Veamos lo que ocurre en un proceso de calentamiento de una sustancia pura: Tª GAS Pto. Ebullición LIQUIDO Pto. Fusión SÓLIDO tiempo La energía calorífica para cambiar de estado , no se emplea en aumentar la temperatura , sino en romper las fuerzas atractivas entre las moléculas.

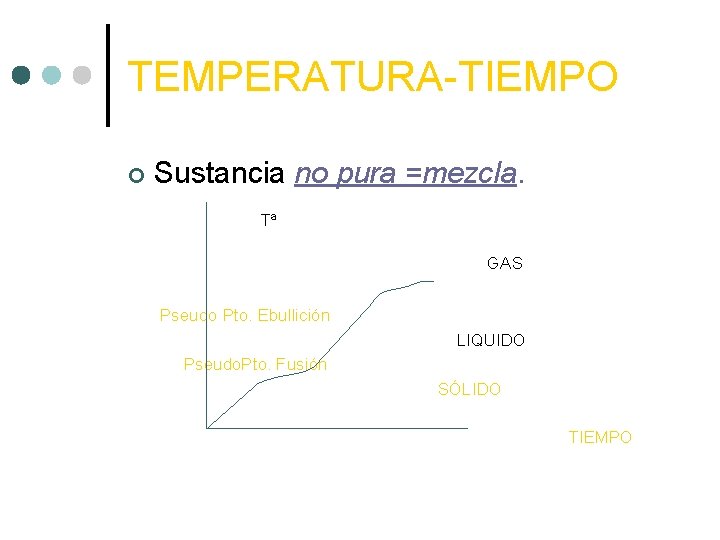
TEMPERATURA-TIEMPO ¢ Sustancia no pura =mezcla. Tª GAS Pseudo Pto. Ebullición LIQUIDO Pseudo. Pto. Fusión SÓLIDO TIEMPO

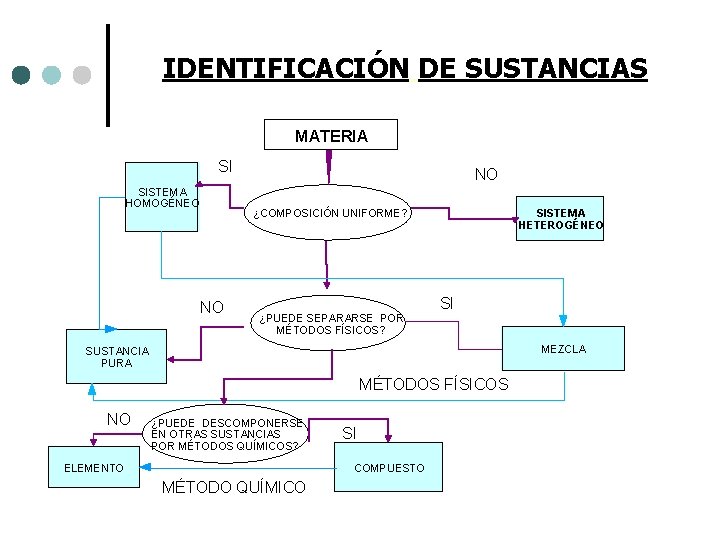
IDENTIFICACIÓN DE SUSTANCIAS MATERIA SI SISTEMA HOMOGÉNEO NO NO ¿COMPOSICIÓN UNIFORME? SISTEMA HETEROGÉNEO SI ¿PUEDE SEPARARSE POR MÉTODOS FÍSICOS? MEZCLA SUSTANCIA PURA MÉTODOS FÍSICOS NO ¿PUEDE DESCOMPONERSE EN OTRAS SUSTANCIAS POR MÉTODOS QUÍMICOS? ELEMENTO SI COMPUESTO MÉTODO QUÍMICO

METODOS DE SEPARACIÓN DE MEZCLAS ¢ MEZCLAS HETEROGÉNEAS 1. -MEZCLAS SOLIDO-LÍQUIDO: Filtración. Sedimentación. Centrifugación. 2. -MEZCLAS SÓLIDO-SÓLIDO: Separación magnética. 3. -MEZCLAS LÍQUIDO-LIQUIDO Decantación.

METODOS DE SEPARACIÓN DE MEZCLAS ¢ MEZCLAS HOMOGÉNEAS: 1. -MEZCLAS SÓLIDO-LÍQUIDO: Cristalización. Calentamiento a sequedad. 2. -MEZCLAS LIQUIDO-LIQUIDO Destilación.

MEZCLAS HOMOGENEAS. DISOLUCIONES ¢ Una disolución es una mezcla homogénea líquido -líquido, que la tratamos en base a dos componentes: 1. -DISOLVENTE o componente en mayor proporción. 2. -SOLUTO , componente en menor proporción en la mezcla.

Clasificación de las disoluciones Según el estado de agregación de sus com ponentes: Solido-líquido: sal+agua. Líquido-líquido: vino(alcohol+agua). Líquido-gas: gaseosa(agua +CO 2). Sólido-sólido: aleaciones. Gas-gas: aire. ¢

CONCENTRACIÓN DE UNA DISOLUCIÓN. Es La proporción en la que se encuentran el soluto en una disolución. Matemáticamente: -gramos de soluto por cada litro de disolución: (g/l). -gramos de soluto en cada 100 g de disolución(% en peso).

Formas de expresar la concentración. C(g/l)= gramos de soluto/Volumen disolución(l) C(%)=(masa soluto/masadisolución)x 100. Ejemplos, casos prácticos.

SOLUBILIDAD. Se denomina solubilidad al valor de la concentración máxima. ¢ Máxima cantidad de soluto que se puede disolver en 100 gramos de disolvente, a una temperatura dada. ¢ S(Tª)=máxima cantidad de soluto/100 g. dte.

Factores que afectan a la SOLUBILIDAD. Temperatura: -En disoluciones solido-líquido y líquido, la solubilidad aumenta con la temperatura. (simil colacao caliente y frio) -En disoluciones gas-liquido la solubilidad aumenta al disminuir la temperatura. (simil coca-cola fria y natural)

Factores que afectan a la SOLUBILIDAD. Pulverización del soluto: El soluto pulverizado muestra más superficie de contacto con el disolvente. Se facilita la difusión de moléculas de soluto a través del disolvente al aumentar la superficie de contacto. ¢ Agitación: La agitación hace aumentar el contacto entre moléculas de soluto con el disolvente. ¢

Tipos de disoluciones en función de la SOLUBILIDAD n n DILUIDAS: Baja proporción de soluto disuelto CONCENTRADAS: Alta proporción de soluto disuelto SATURADAS: Máxima cantidad de soluto disuelto. Este límite lo impone la solubilidad de la sustancia. Su concentración coincide con la solubilidad. SOBRESATURADA: Queda soluto sin disolver. Forma mezcla heterogénea. Al filtrarla obtenemos la disolución saturada.

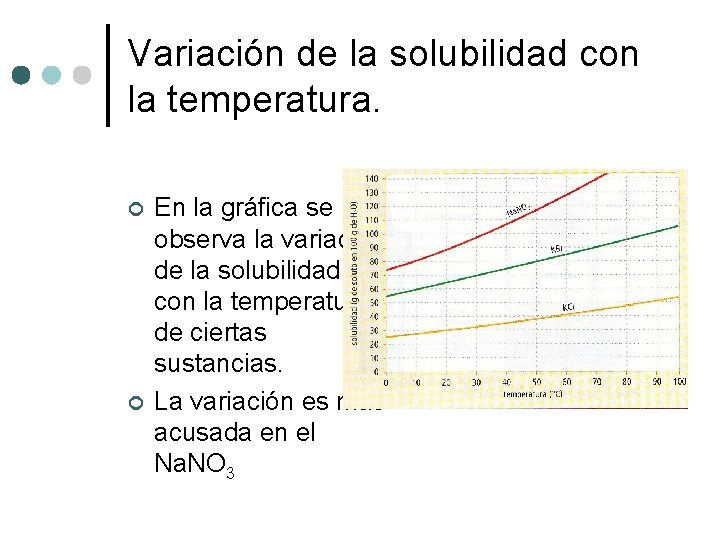
Variación de la solubilidad con la temperatura. ¢ ¢ En la gráfica se observa la variación de la solubilidad con la temperatura de ciertas sustancias. La variación es mas acusada en el Na. NO 3

Variación de la solubilidad con la temperatura.

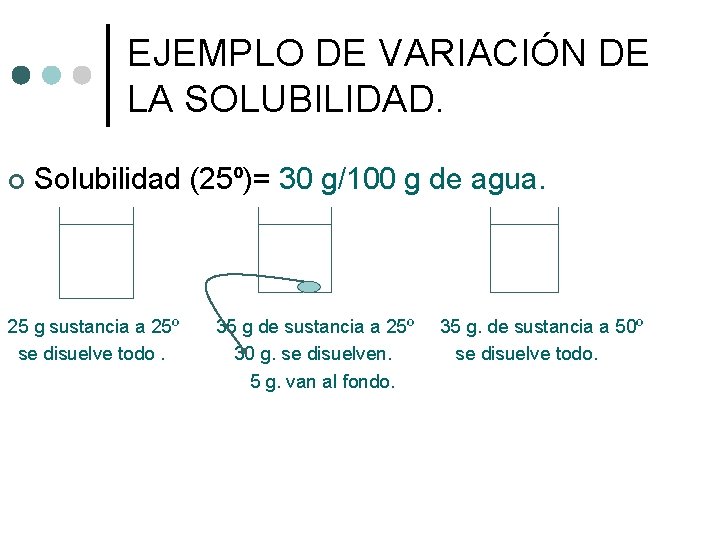
EJEMPLO DE VARIACIÓN DE LA SOLUBILIDAD. ¢ Solubilidad (25º)= 30 g/100 g de agua. 25 g sustancia a 25º se disuelve todo. 35 g de sustancia a 25º 30 g. se disuelven. 5 g. van al fondo. 35 g. de sustancia a 50º se disuelve todo.

COLOIDES ¢ ¢ ¢ Los coloides son sustancias intermedias entre las disoluciones y suspensiones, y constituidas por dos fases: la dispersa y la dispersante. Las partículas coloidales son tan pequeñas que no pueden observarse en el microscopio ordinario y representan una transición entre las disoluciones (homogéneas) y las suspensiones (heterogéneas). Ejemplo: Espuma de afeitar , sangre , arcilla en agua….

Teoría cinético molecular. La T. C. M. es un modelo que usan los científicos para explicar la naturaleza de la materia. La TCM se basa en las siguientes hipótesis: ¢ Las sustancias están formadas por moléculas. ¢ Entre molécula y molécula no hay nada, es decir existe vacío. ¢ Las moléculas están en continuo movimiento, aumentando la velocidad de estas cuando aumenta la temperatura.

Teoría cinético molecular. Modelo del sólido según la TCM: ¢ Aquel en el que las moléculas están juntas y ordenadas. ¢ En continuo movimiento de vibración. ¢ Como consecuencia de esto los sólidos tienen volumen y forma fijos. ¢ Se dilatan y se contraen al variar la temperatura. ¢ No se pueden comprimir.

Teoría cinético molecular. Modelo del LÍQUIDO según la TCM: ¢ Las moléculas están juntas , pero desordenadas en continuo movimiento de vibración y rotación. ¢ Todo esto es debido a que las fuerzas entre las moléculas son más débiles que en el estado sólido. ¢ Los líquidos tienen volumen propio (no varía), pero pueden fluir y adoptar la forma del recipiente. (puede variar) ¢ No Pueden contraerse y expandirse.

Teoría cinético molecular. ¢ ¢ ¢ ¢ Modelo del estado gaseoso: Las moléculas están muy separadas, en continuo movimiento, por lo que chocan unas contra otras, y con las paredes del recipiente que contiene al gas. Por lo cual decimos que los gases ejercen presión. Las partículas se mueven en línea recta. Cambiando su dirección cuando se producen choques. El tiempo que dura un choque en mucho menor que el espacio de tiempo que transcurre entre dos choques sucesivos en una molécula. Los gases posen forma y volúmen variables Se comprimen con facilidad y se expanden continuamente.
 Diversidad de la materia
Diversidad de la materia Propiedades de la materia
Propiedades de la materia Propiedades de lo materiales
Propiedades de lo materiales Propiedades de la materia
Propiedades de la materia Propiedades específicas
Propiedades específicas Objetivos de las propiedades de la materia
Objetivos de las propiedades de la materia Solidificación dibujo
Solidificación dibujo Quimica aplicada que estudia
Quimica aplicada que estudia Ejemplo de muestreo estratificado
Ejemplo de muestreo estratificado Propiedades de la materia 3 eso
Propiedades de la materia 3 eso Propiedades generales de la materia divisibilidad
Propiedades generales de la materia divisibilidad Propiedades organolepticas de la materia
Propiedades organolepticas de la materia Estado liquido densidad
Estado liquido densidad Propiedades físicas de la materia
Propiedades físicas de la materia Site:slidetodoc.com
Site:slidetodoc.com Agroindustrial
Agroindustrial Qu es la materia
Qu es la materia Estados de la materia intro
Estados de la materia intro Velocità quadratica media formula
Velocità quadratica media formula Medios de defensa en materia aduanera
Medios de defensa en materia aduanera Conceptos basicos de fisica
Conceptos basicos de fisica Que es la masa de un cuerpo
Que es la masa de un cuerpo Desequilibrio procesal en materia laboral
Desequilibrio procesal en materia laboral Mezclas
Mezclas Materia prima del cemento
Materia prima del cemento Volumen
Volumen Impenetrabilidad
Impenetrabilidad Impernetrabilidade
Impernetrabilidade Los seres vivos como sistemas
Los seres vivos como sistemas Complemento indirecto
Complemento indirecto Estados fisicos da materia
Estados fisicos da materia Materia inorgánica
Materia inorgánica La teoria cinetico-molecolare della materia zanichelli
La teoria cinetico-molecolare della materia zanichelli Peso de la materia
Peso de la materia Graphites materia medica
Graphites materia medica Encuadre de la materia
Encuadre de la materia Qu es la materia
Qu es la materia Potencia aristoteles
Potencia aristoteles Materia prima de la leche
Materia prima de la leche Phet estados da materia
Phet estados da materia Energía química
Energía química Materia assignment #3 - accounting equation normal balances
Materia assignment #3 - accounting equation normal balances Aud materia plangand
Aud materia plangand Ntics materia
Ntics materia La materia contiene calor
La materia contiene calor La biósfera es el conjunto de seres vivos de la tierra
La biósfera es el conjunto de seres vivos de la tierra Simbol pengurapan orang sakit
Simbol pengurapan orang sakit 5 ejemplos de cambios físicos
5 ejemplos de cambios físicos Ejemplo de materia
Ejemplo de materia Como se clasifica la materia
Como se clasifica la materia Cicli della materia
Cicli della materia Propriedades gerais exemplos
Propriedades gerais exemplos Definicion de valor monetario
Definicion de valor monetario Ant tart materia medica
Ant tart materia medica