Propiedades de la materia 4 Generales No tienen



























- Slides: 33

Propiedades de la materia 4 Generales No tienen relación con la clase de materia de la que este formado un cuerpo. § Masa: Indica la cantidad de materia de un cuerpo. Su unidad en el S. I. es Kg. Se mide con la balanza. § Volumen: Es el espacio que ocupa un cuerpo. Se mide en el S. I. en m 3. El volumen de sólidos y líquidos puede medirse con la probeta. La capacidad de un recipiente es su volumen interior. 4 Características Sirven para identificar y diferenciar los distintos tipos de materia o de sustancias. § Densidad: Es la relación entre la masa y el volumen; d= Sus unidades en el S. I. son kg/m 3 La densidad de un líquido puede medirse con el densímetro. § Dureza: resistencia al rayado. § Puntos de fusión y ebullición: Temperaturas fijas a las que se verifican esos cambios de estado. § Solubilidad en agua y en otros disolventes § ….

DEFINICIÓN DE LA MATERIA La materia se puede definir como todo aquello que ocupa un lugar en el espacio y que tiene masa. Las propiedades que no permiten identificar clases de materia reciben el nombre de propiedades generales Las propiedades que permiten identificar clases de sustancias reciben el nombre de propiedades específicas o características.

PROPIEDADES GENERALES O EXTRÍNSECAS Son comunes a toda clase de materia. Las propiedades generales más importantes son: • Masa • Volumen • Peso • Inercia • Impenetrabilidad • Divisibilidad • Porosidad

MASA Cantidad de materia contenida en un cuerpo. Unidad de medida: kg, g, mg. Se mide con la balanza.

VOLUMEN Espacio o lugar que ocupa un cuerpo. Unidad de medida: m 3, dm 3, cm 3, litro (L) Para medir volumen se debe tener en cuenta si éste es sólido, líquido o gaseoso. Medida por diferencia: para sólidos irregulares

PESO Es el resultado de la fuerza de atracción o gravedad que ejerce la Tierra sobre los cuerpos. Proporcional a la masa. Se mide con dinamómetro.

INERCIA Es la tendencia de un cuerpo a permanecer en estado de reposo o de movimiento. IMPENETRABILIDAD Es la propiedad por la cual un cuerpo no puede ocupar el espacio que ocupa otro cuerpo al mismo tiempo.

DIVISIBILIDAD Es la propiedad que tienen los cuerpos para fraccionarse en pedazos cada vez más pequeños. POROSIDAD Es la característica de la materia que consiste en presentar poros o espacio vacíos.

PROPIEDADES ESPECÍFICAS O INTRÍNSECAS Dependen de la naturaleza de la materia y no de la cantidad. Ejm: un tubo de cobre siempre tienen el mismo color y brillo. Son características de cada sustancia y permiten diferenciar un cuerpo de otro. Las propiedades específicas se clasifican en propiedades físicas y propiedades químicas.

PROPIEDADES FÍSICAS Se pueden determinar sin que los cuerpos varíen su naturaleza. Entre las propiedades físicas específicas se encuentran: • Estado físico • Punto de ebullición • Punto de fusión • Solubilidad • Densidad

PUNTO DE EBULLICIÓN Es la temperatura a la cual un líquido hierve. Ejm: el agua hierve a 100ºC a nivel del mar y el alcohol hierve a 78, 4ºC. PUNTO DE FUSIÓN Es la temperatura a la cual una sustancia se funde.

Es la propiedad que tienen algunas sustancias de disolverse a una temperatura determinada, en un líquido. A la sustancia líquida la llamamos solvente y a la que se disuelve soluto. El solvente mas usado es el agua. No todas las sustancias se disuelven en un mismo disolvente.

DENSIDAD Es la masa en gramos que tiene un centímetro cúbico de sustancia. Se puede calcular la densidad de cualquier muestra, dividiendo el valor de la masa por el valor de su volumen. Esta operación matemática se representa así: _m_ d = v Donde: d es la densidad, m es la masa y v el volumen.

OTRA PROPIEDADES FÍSICAS ORGANOLÉPTICAS ELASTICIDAD (bandas de caucho) MALEABILIDAD (la plata) DUCTIBILIDAD (oro) TENACIDAD (acero) FRAGILIDAD (vidrio) DUREZA (diamante)

PROPIEDADES QUÍMICAS Son las que determinan el comportamiento de las sustancias cuando se ponen en contacto con otras. Cuando se determina, la sustancia se altera o cambia su naturaleza. Ejm: oxidación del hierro.

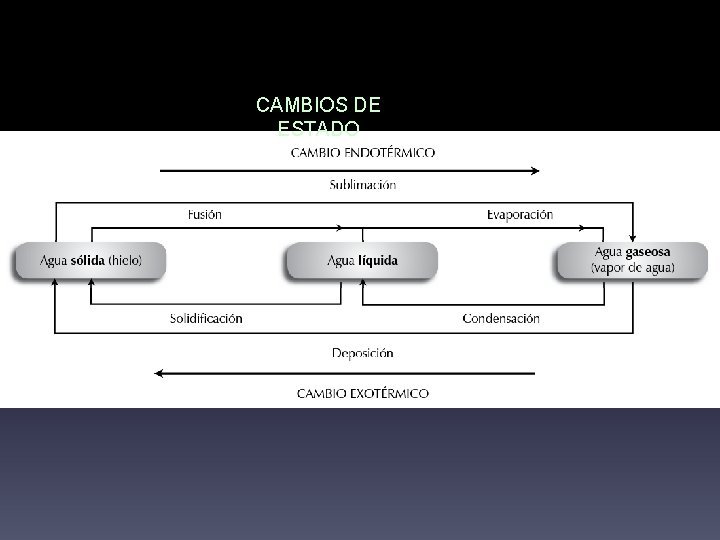
Procesos físicos y químicos En la naturaleza se producen gran variedad de cambios, como la dilatación de un metal, los cambios de estado del agua, la oxidación de algunos metales, el movimiento de los coches, . . . 4 Procesos o cambios físicos Las sustancias mantienen su naturaleza y sus propiedades esenciales, es decir, siguen siendo las mismas sustancias. El balón de fútbol en movimiento sigue siendo un balón. 4 Procesos o cambios químicos Reacciones químicas Las sustancias cambian su naturaleza, se transforman en otras distintas, que tienen propiedades diferentes. La mantequilla, al derretirse, sigue siendo mantequilla. La botella rota sigue siendo de vidrio. Ebullición de nitrógeno Cuando se vierte nitrógeno líquido, este hierve vivamente al adquirir la temperatura ambiente. En la la fotosíntesis, las plantas La herrumbre que se forma en producen oxígeno y nutrientes a partir viga es una sustancia distinta al de dióxido de carbono y agua. hierro. La ceniza que se crea en la hoguera es una sustancia distinta a la madera. Reacción entre la sacarosa y el clorato potásico La sacarosa (azúcar de mesa) reacciona con clorato de potasio formando nuevas sustancias, como esta extraña masa de carbono.

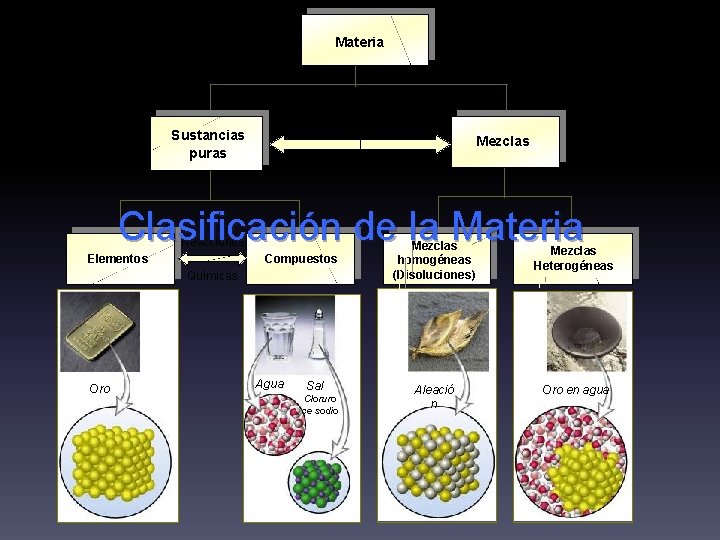
La materia v Definición v Clasificación § Sustancias puras • Elementos • Compuestos § Mezclas • Homogéneas • Heterogéneas v Propiedades de la materia v Procesos o transformaciones físicas y químicas

Materia Procesos Físicos Sustancias puras Mezclas Clasificación de la Materia Reacciones Elementos Compuestos Químicas Oro Agua Sal Cloruro ce sodio Mezclas homogéneas (Disoluciones) Mezclas Heterogéneas Aleació n Oro en agua

Sustancias puras 4 Composición uniforme y totalmente invariable 4 Propiedades constantes y características 4 No pueden separarse en otras sustancias más simples mediante procesos físicos Elementos Compuestos Oro Au Grafito Siderita Oxido de hierro Fe. O Carbono C Diamante Bromo Br 2 Sal común Cloruro de sodio Na. Cl

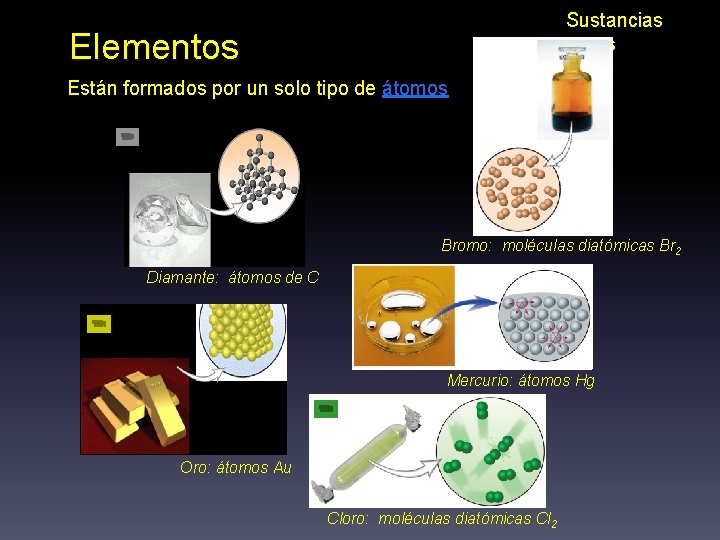
Elementos Formados por un sólo tipo de átomos Compuestos Formados por la unión de átomos de diferentes elementos

Sustancias puras Elementos Sustancias que no se pueden descomponer en otras más simples Azufre S 8 Mercurio Hg Nitrógeno N 2 Actualmente se conocen 112 elementos diferentes. En la naturaleza existen algunos elementos aislados, como oxígeno, cobre o oro, pero la mayor parte suele estar formando parte de compuestos. Sistema Periódico de los elementos

Sustancias puras Elementos Están formados por un solo tipo de átomos Bromo: moléculas diatómicas Br 2 Diamante: átomos de C Mercurio: átomos Hg Oro: átomos Au Cloro: moléculas diatómicas Cl 2

Sustancias • Los elementos químicos se representan mediante símbolos puras químicos. • Símbolo: Símbolo representación de un elemento

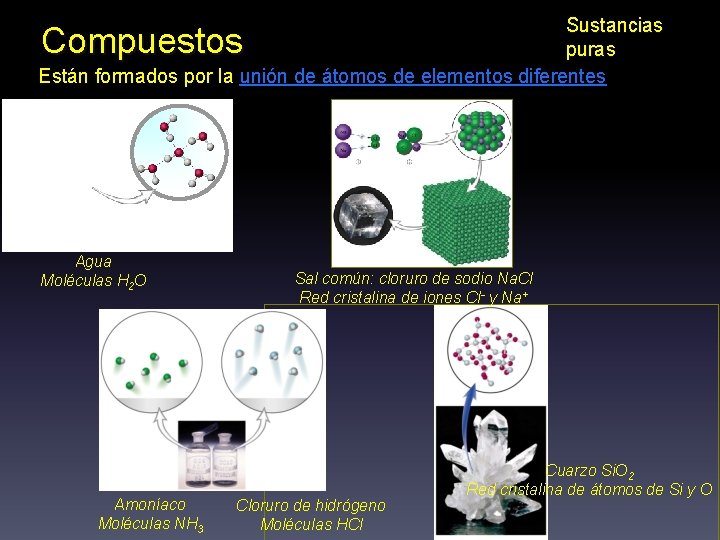
Sustancias puras Compuestos Sustancias que pueden descomponerse en otras más simples. En ellos se combinan dos o más elementos Cinabrio Hg. S Sulfuro de mercurio Azufre + Mercurio Agua H 2 O Hidrógeno + Oxígeno Cuarzo Si. O 2 Dióxido de Silicio + Oxígeno El número de compuestos químicos supera los dos millones. Los elementos que forman un compuesto no pueden separarse mediante procesos físicos, solamente pueden separarse mediante procesos químicos

Sustancias puras Están formados por la unión de átomos de elementos diferentes Compuestos Agua Moléculas H 2 O Amoníaco Moléculas NH 3 Sal común: cloruro de sodio Na. Cl Red cristalina de iones Cl- y Na+ Cloruro de hidrógeno Moléculas HCl Cuarzo Si. O 2 Red cristalina de átomos de Si y O

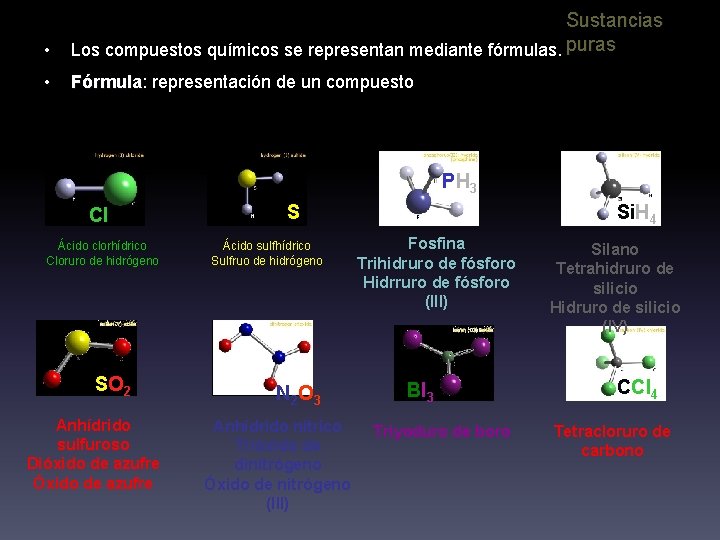
• Sustancias Los compuestos químicos se representan mediante fórmulas. puras • Fórmula: Fórmula representación de un compuesto PH 3 HCl Ácido clorhídrico Cloruro de hidrógeno SO 2 Anhídrido sulfuroso Dióxido de azufre Óxido de azufre H 2 S Ácido sulfhídrico Sulfruo de hidrógeno N 2 O 3 Anhídrido nítrico Trióxido de dinitrógeno Óxido de nitrógeno (III) Si. H 4 Fosfina Trihidruro de fósforo Hidrruro de fósforo (III) BI 3 Triyoduro de boro Silano Tetrahidruro de silicio Hidruro de silicio (IV) CCl 4 Tetracloruro de carbono

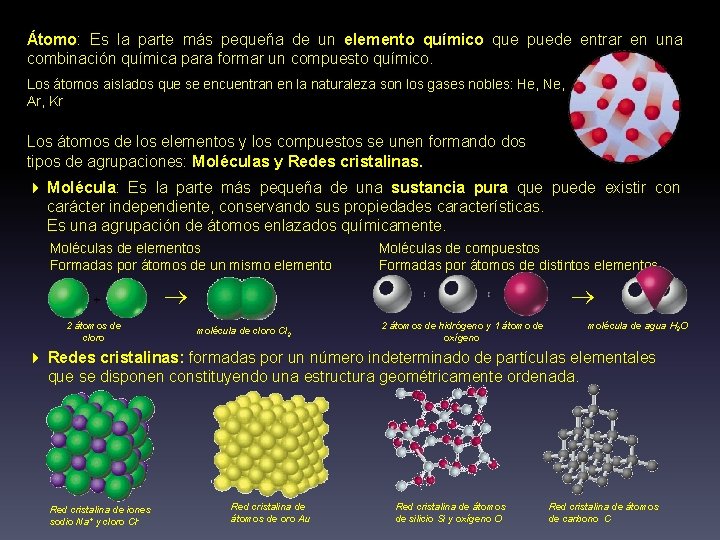
Átomo: Átomo Es la parte más pequeña de un elemento químico que puede entrar en una combinación química para formar un compuesto químico. Los átomos aislados que se encuentran en la naturaleza son los gases nobles: He, Ne, Ar, Kr Los átomos de los elementos y los compuestos se unen formando dos tipos de agrupaciones: Moléculas y Redes cristalinas 4 Molécula: Molécula Es la parte más pequeña de una sustancia pura que puede existir con carácter independiente, conservando sus propiedades características. Es una agrupación de átomos enlazados químicamente. Moléculas de elementos Formadas por átomos de un mismo elemento Moléculas de compuestos Formadas por átomos de distintos elementos 2 átomos de cloro molécula de cloro Cl 2 2 átomos de hidrógeno y 1 átomo de oxígeno molécula de agua H 2 O 4 Redes cristalinas: formadas por un número indeterminado de partículas elementales que se disponen constituyendo una estructura geométricamente ordenada. Red cristalina de iones sodio Na+ y cloro Cl- Red cristalina de átomos de oro Au Red cristalina de átomos de silicio Si y oxígeno O Red cristalina de átomos de carbono C

Mezclas 4 Formadas por varias sustancias puras (elementos o compuestos) que siguen conservando sus propiedades características 4 Composición variable 4 Propiedades variables dependiendo de la proporción de sus componentes 4 Pueden separarse en otras sustancias más simples mediante procesos físicos Homogéneas Heterogéneas La mayor parte de las rocas, los animales, las plantas, el carbón, el petróleo, el aire, los ríos, los lagos y los mares son ejemplos de mezclas.

Mezclas homogéneas o Disoluciones Propiedades y composición iguales en todos sus puntos. Aspecto uniforme, sus componentes no se distinguen a simple vista. Aire, mezcla homogénea de varios gases: nitrógeno N 2, oxigeno O 2 y argón Ar Sal disuelta en agua, mezcla homogénea que contiene: iones sodio Na+ y cloro Cl - entre moléculas de agua H 2 O Latón, mezcla homogénea sólida de cobre Cu y cinc Zn

Mezclas heterogéneas Propiedades y composición varían de un punto a otro. Aspecto no uniforme, sus componentes se distinguen a simple vista Granito: Cuarzo, Feldespato y Mica negra Agua y Yoduro potásico Obsidiana nevada: Obsidiana y Cristobalita

Elementos Sustancias puras que no pueden descomponerse en otras más sencillas. Compuestos Sustancias puras que pueden descomponerse en otras más simples por métodos químicos. Electrolisis del agua

Mezclas y Compuestos Mezclas § Sus componentes (elementos o compuestos) se pueden separar por procedimientos físicos. . § Composición variable. § Propiedades ligadas a las de sus componente, ya que estos conservan sus propiedades. Compuestos § Sus componentes (elementos) no se pueden separar por procedimientos físicos, sólo mediante procedimientos químicos. . § Composición fija. § Propiedades diferentes a las de sus componentes Mezcla y Combinación de Azufre S y Hierro Fe En la mezcla cada elemento, azufre S y hierro Fe, conserva sus propiedades. Estos elementos se pueden separar por procedimientos físicos. Cuando el azufre reacciona con el hierro se forma un nuevo compuesto, sulfuro de hierro, Fe. S, El sulfuro de hierro tiene propiedades diferentes a las que tenían el azufre y el hierro por separado.

CAMBIOS DE ESTADO
 Propiedades generales de la materia divisibilidad
Propiedades generales de la materia divisibilidad Imagenes de masa peso y volumen
Imagenes de masa peso y volumen Propiedades generales
Propiedades generales Propiedades generales de la ciencia
Propiedades generales de la ciencia Propiedades del logaritmo natural
Propiedades del logaritmo natural Halogenes
Halogenes Propiedades generales de los compuestos orgánicos
Propiedades generales de los compuestos orgánicos Propiedades que tienen los materiales
Propiedades que tienen los materiales G=h-ts
G=h-ts Imagen de la materia y sus propiedades
Imagen de la materia y sus propiedades Propiedades de la materia 3 eso
Propiedades de la materia 3 eso Objetivo de las propiedades de la materia
Objetivo de las propiedades de la materia Propiedades organolepticas de la materia
Propiedades organolepticas de la materia Tipos de muestreo estratificado
Tipos de muestreo estratificado Propiedades físicas de la materia
Propiedades físicas de la materia Ejemplos de compuestos químicos
Ejemplos de compuestos químicos Densidad
Densidad Propiedades de la materia
Propiedades de la materia El papel fluye en un recipiente
El papel fluye en un recipiente Propiedades de la materia
Propiedades de la materia Materia extensiva
Materia extensiva Estructura del objetivo
Estructura del objetivo Niveles de carrera magisterial
Niveles de carrera magisterial Nagas
Nagas Características generales de hades
Características generales de hades Ejemplo de objetivos especificos
Ejemplo de objetivos especificos Humanismo características
Humanismo características Objetivos generales para niños de 3 a 4 años
Objetivos generales para niños de 3 a 4 años Objetivos especificos de un laboratorio clinico
Objetivos especificos de un laboratorio clinico Partes del templo griego
Partes del templo griego Principios generales del derecho laboral
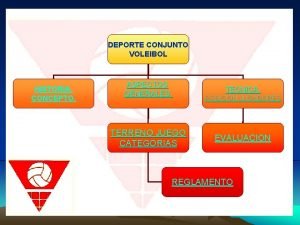
Principios generales del derecho laboral Aspectos generales del voleibol
Aspectos generales del voleibol Normas de acotado
Normas de acotado Principios generales del derecho laboral
Principios generales del derecho laboral