NDICE ESTADOS DE AGREGACIN DE LA MATERIA Nela
















- Slides: 28

ÍNDICE ESTADOS DE AGREGACIÓN DE LA MATERIA Nela Álamos Colegio Alcaste

ÍNDICE ESTADOS DE AGREGACIÓN DE LA MATERIA v. Características generales v. Teoría cinética de la materia § Estructura interna de los estados de agregación § Estado sólido § Estado líquido § Estado gaseoso v. Cambios de estado § Temperatura y teoría cinética § Fusión y solidificación § Vaporización y condensación § Sublimación v Apéndice: Teoría cinética de la materia v Apéndice: Solids, liquids and gases (Primary Education)

ÍNDICE CARACTERÍSTICAS GENERALES Tradicionalmente, se suele decir que la materia se presenta en los estados de agregación: sólido, líquido y gaseoso. Las características diferenciales de estos tres estados son: Aparte de estos tres estados de agregación es interesante considerar un cuarto estado, llamado plasma, en el que la materia está formada por una mezcla de núcleos atómicos y electrones. El plasma constituye el 99% de la materia del universo, pues en él se encuentra toda la materia que forma el Sol y las demás estrellas, a temperaturas de miles y millones de grados.

ÍNDICE TEORÍA CINÉTICA DE LA MATERIA Estructura interna de los estados de agregación La teoría cinética establece que la materia está constituida por pequeñas partículas (átomos, moléculas o iones) que están en continuo movimiento y entre ellas existen espacios vacíos. En cada uno de los tres estados de agregación las partículas mínimas (átomos, moléculas o iones) se disponen de manera diferente § La distancia entre las partículas es mayor en el estado gaseoso que en el líquido, y en éste mayor que en el sólido. § Las fuerzas de atracción entre estas partículas mínimas (fuerzas de cohesión) son mayores en los sólidos que en los líquidos y en éstos mayores que en los gases. Gaseoso Sólido Líquido

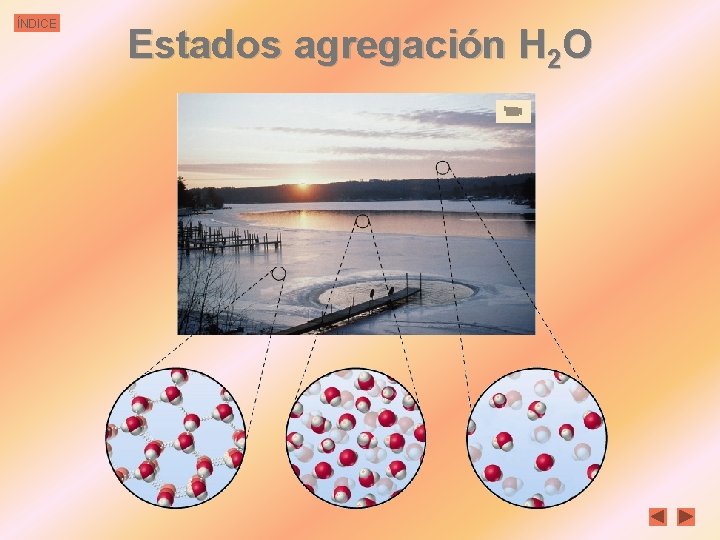
ÍNDICE Estados agregación H 2 O

ÍNDICE Estados de agregación Br 2

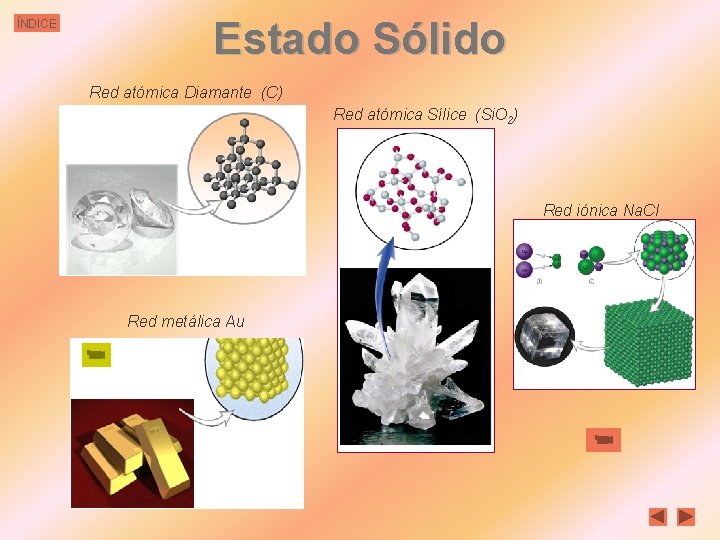
ÍNDICE Estado Sólido En estado sólido las partículas últimas (ya sean moléculas, átomos o iones), se encuentran en contacto unas con otras y dispuestas en posiciones fijas. Las partículas pueden vibrar alrededor de sus posiciones fijas, pero no pueden cambiar de posición. De ahí la forma y el volumen invariables y la débil compresibilidad de los sólidos. § En los sólidos cristalinos, las partículas obedecen aun orden geométrico, que se repite a través de todo el sólido, Celdilla unidad del Na. Cl. constituyendo la red o retículo cristalino. De éste puede Red simetría cúbica considerarse sólo una parte representativa que se llama celdilla unidad. Las diversas formas de cristales no son más que la traducción externa de la simetría interna de la red. Lo usual es que en los sólidos no se aprecie, a simple vista la ordenación cristalina. Esto se debe a que cualquier porción de materia no es un retículo cristalino gigante, sino un conjunto de pequeños cristales interpenetrados estrechamente. § En los sólidos amorfos, como el vidrio o las resinas sintéticas, la distribución de las partículas carece del orden mencionado. El Si. O 2 se presenta en dos formas: a) el cuarzo cristalino, b) el vidrio de cuarzo, amorfo. (Las estructuras se han representado en dos dimensiones, por esto, parece como si él Si tuviese valencia 3)

ÍNDICE Estado Sólido Red atómica Diamante (C) Red atómica Sílice (Si. O 2) Red iónica Na. Cl Red metálica Au

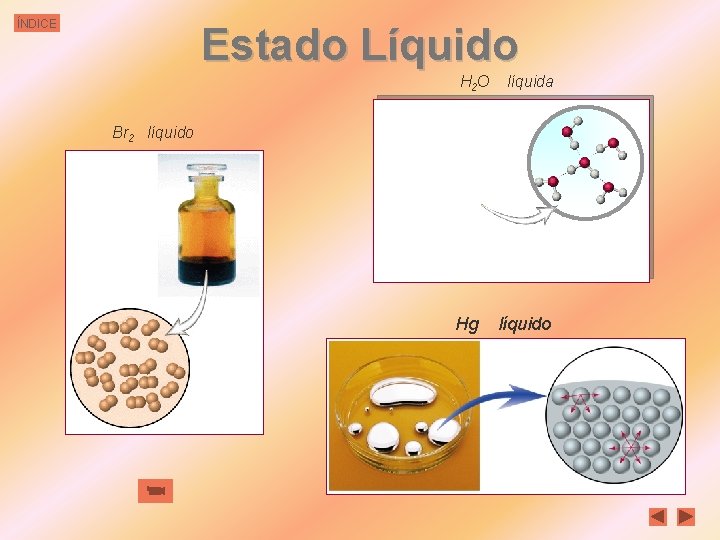
ÍNDICE Estado Líquido En los líquidos las partículas constituyentes están en contacto unas con otras. De ahí que los líquidos posean volumen constante y débil compresibilidad, También por esto, las densidades de los líquidos son, en general, algo inferiores a las de los sólidos, aunque del mismo orden. Las partículas que constituyen el líquido no se encuentran fijas, sino que pueden moverse unas en relación a otras. Por esto los líquidos fluyen y no tienen forma propia, adoptan la forma del recipiente que los contiene.

ÍNDICE Estado Líquido H 2 O líquida Br 2 líquido Hg líquido

ÍNDICE Estado Gaseoso En estado gaseoso las partículas son independientes unas de otras, están separadas por enormes distancias con relación a su tamaño. Tal es así, que en las mismas condiciones de presión y temperatura, el volumen de un gas no depende más que del número de partículas (ley de Avogadro) y no del tamaño de éstas, despreciable frente a sus distancias. De ahí, la gran compresibilidad y los valores extremadamente pequeños de las densidades de los gases Las partículas de un gas se mueven con total libertad y tienden a separarse, aumentando la distancia entre ellas hasta ocupar todo el espacio disponible. Por esto los gases tienden a ocupar todo el volumen del recipiente que los contiene. Las partículas de un gas se encuentran en constante movimiento en línea recta y cambian de dirección cuando chocan entre ellas y con las paredes del recipiente. Estos choques de las partículas del gas con las paredes del recipiente que lo contiene son los responsables de la presión del gas. Las colisiones son rápidas y elásticas (la energía total del gas permanece constante).

ÍNDICE Estado Gaseoso Cl 2 gaseoso HCl y NH 3 gaseosos

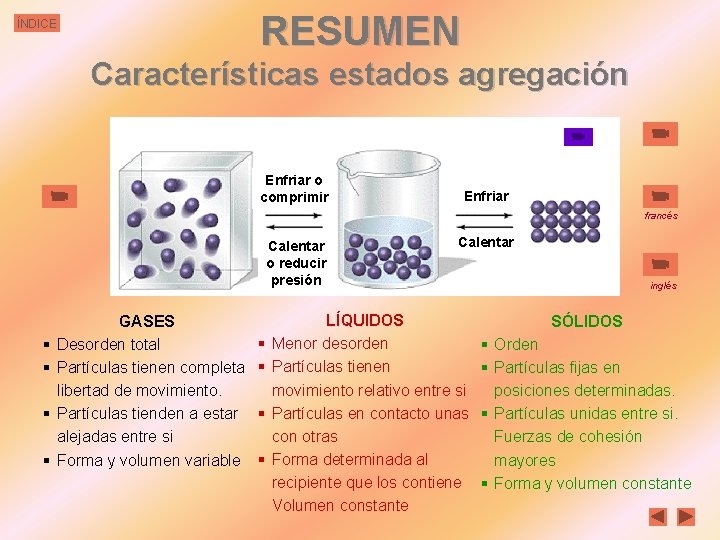
RESUMEN ÍNDICE Características estados agregación Enfriar o comprimir Enfriar francés Calentar o reducir presión § § GASES Desorden total Partículas tienen completa libertad de movimiento. Partículas tienden a estar alejadas entre si Forma y volumen variable § § Calentar LÍQUIDOS Menor desorden Partículas tienen movimiento relativo entre si Partículas en contacto unas con otras Forma determinada al recipiente que los contiene Volumen constante inglés SÓLIDOS § Orden § Partículas fijas en posiciones determinadas. § Partículas unidas entre si. Fuerzas de cohesión mayores § Forma y volumen constante

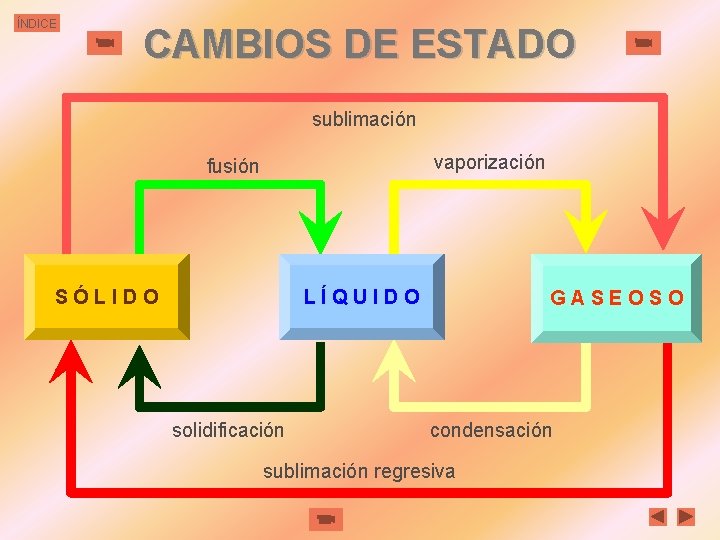
ÍNDICE CAMBIOS DE ESTADO sublimación vaporización fusión SÓLIDO LÍQUIDO solidificación GASEOSO condensación sublimación regresiva

ÍNDICE Temperatura y Teoría cinética de la materia Cuando se calienta un cuerpo, las partículas que lo constituyen adquieren más energía y esto les permite moverse aún más rápidamente. La energía relacionada con el movimiento (velocidad) de las partículas, se denomina energía cinética. No todas las partículas de un cuerpo tienen la misma energía cinética; algunas la pierden al chocar con sus vecinas y otras, por el contrario, la ganan. La temperatura mide la energía cinética media (promedio) de las partículas de un cuerpo La temperatura de un cuerpo es proporcional al movimiento de agitación de sus partículas. Los cambios de estado pueden explicarse convenientemente según la teoría cinética de la materia:

ÍNDICE Fusión y Solidificación La fusión es el paso de sólido a líquido. Para conseguirla hay que aumentar la temperatura del sólido. § Al calentar un cuerpo sólido, aumenta la energía de las partículas y, con ella, la amplitud de las vibraciones, esto hace que el sólido se dilate. § Llega un momento en que esta energía es suficiente para vencer las fuerzas de cohesión entre las partículas y éstas comienzan a resbalar unas sobre otras. Entonces se produce la fusión La forma de fusión de un cuerpo depende de su naturaleza. Así, distinguiremos entre cuerpos cristalinos y amorfos. § En los sólidos cristalinos, la fusión se produce a una temperatura constante, denominada temperatura de fusión que puede variar según la presión. Una vez alcanzada la temperatura o punto de fusión (que es característica para cada sustancia pura), aunque se siga calentando, la temperatura no se eleva y se mantiene constante hasta que la totalidad del sólido se ha fundido. § En los sólidos amorfos, la fusión se produce dentro de un intervalo amplio de temperaturas, durante el cual el cuerpo pasa por un estado pastoso intermedio.

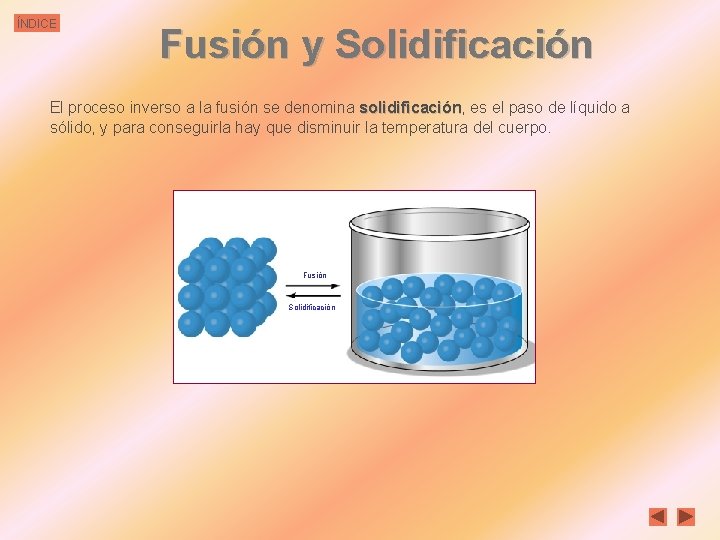
ÍNDICE Fusión y Solidificación El proceso inverso a la fusión se denomina solidificación, solidificación es el paso de líquido a sólido, y para conseguirla hay que disminuir la temperatura del cuerpo. Fusión Solidificación

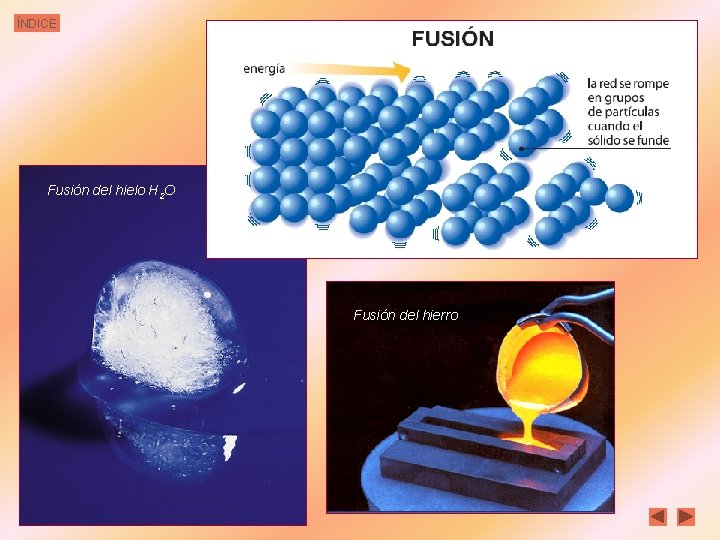
ÍNDICE Fusión del hielo H 2 O Fusión del hierro

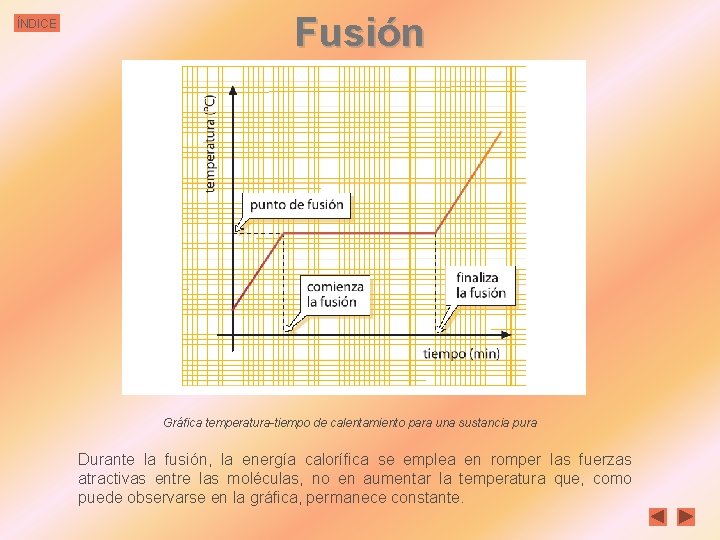
ÍNDICE Fusión Gráfica temperatura-tiempo de calentamiento para una sustancia pura Durante la fusión, la energía calorífica se emplea en romper las fuerzas atractivas entre las moléculas, no en aumentar la temperatura que, como puede observarse en la gráfica, permanece constante.

ÍNDICE Vaporización y Condensación La vaporización es el paso del estado líquido al gaseoso. Puede conseguirse aumentando la temperatura del líquido o bien disminuyendo la presión sobre él. § Al calentar un líquido, aumenta la velocidad de desplazamiento de las partículas y, con ella, su energía. § Esta energía es suficiente para que las partículas próximas a la superficie del líquido puedan vencer las fuerzas de cohesión que las demás les ejercen y escapar a su atracción. Entonces se produce la vaporización. § Al elevarse la temperatura del líquido, la velocidad media de las partículas aumenta y cada vez es mayor el número de ellas que pueden escapar y pasar al estado gaseoso, grupos grandes de partículas se mueven en todas las direcciones y dejan espacios vacíos entre ellos (burbujas); dichos espacios, contienen unas pocas partículas en movimiento muy rápido. El proceso de vaporización tiene lugar de dos formas: § La evaporación es un fenómeno que se produce exclusivamente en la superficie del líquido y a cualquier temperatura. La evaporación aumenta al aumentar la temperatura y disminuir la presión sobre el líquido. § La ebullición es un fenómeno que afecta a toda la masa del líquido. Tiene lugar a una temperatura determinada constante, llamada temperatura o punto de ebullición de la sustancia que también depende de la presión.

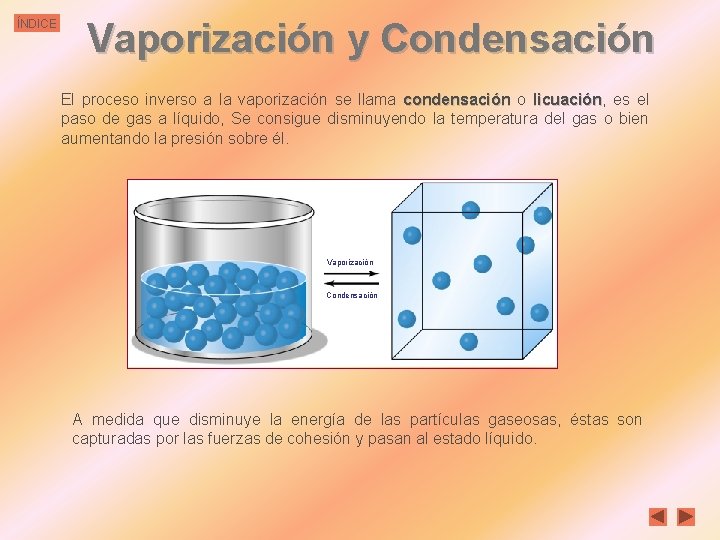
ÍNDICE Vaporización y Condensación El proceso inverso a la vaporización se llama condensación o licuación, licuación es el paso de gas a líquido, Se consigue disminuyendo la temperatura del gas o bien aumentando la presión sobre él. Vaporización Condensación A medida que disminuye la energía de las partículas gaseosas, éstas son capturadas por las fuerzas de cohesión y pasan al estado líquido.

ÍNDICE Vaporización de nitrógeno N 2 Vaporización de bromo

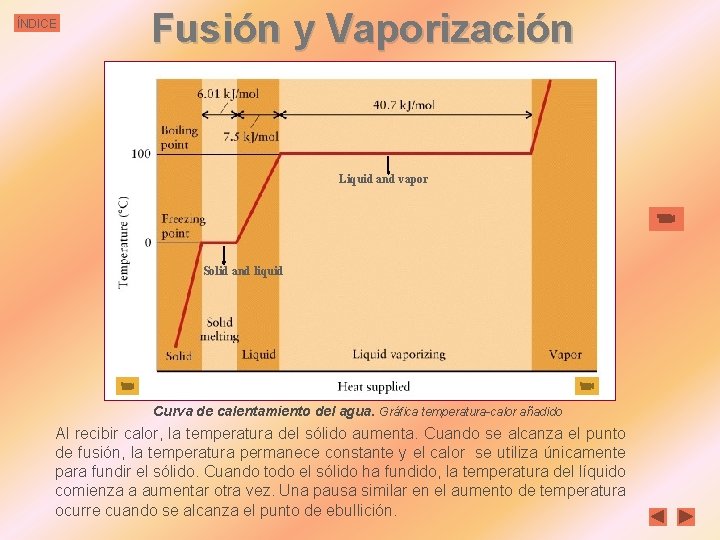
ÍNDICE Fusión y Vaporización Liquid and vapor Solid and liquid Curva de calentamiento del agua. Gráfica temperatura-calor añadido Al recibir calor, la temperatura del sólido aumenta. Cuando se alcanza el punto de fusión, la temperatura permanece constante y el calor se utiliza únicamente para fundir el sólido. Cuando todo el sólido ha fundido, la temperatura del líquido comienza a aumentar otra vez. Una pausa similar en el aumento de temperatura ocurre cuando se alcanza el punto de ebullición.

ÍNDICE Sublimación de un cometa La sublimación es el paso directo del estado sólido al gaseoso. La sublimación regresiva es el proceso inverso Para que se produzca es necesario que los cuerpos se encuentren en unas determinadas condiciones de presión y temperatura, que varían según la sustancia de que se trate. Sublimación de yodo

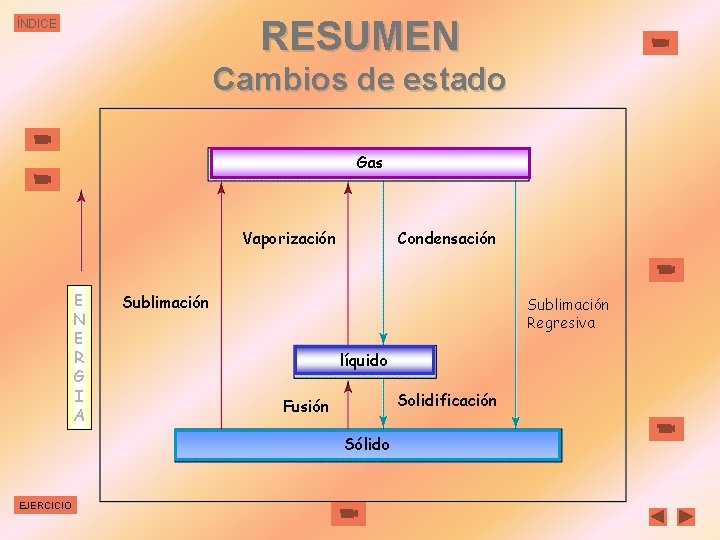
RESUMEN ÍNDICE Cambios de estado Gas Vaporización E N E R G I A Condensación Sublimación Regresiva líquido Solidificación Fusión Sólido EJERCICIO

ÍNDICE APÉNDICE fin

ÍNDICE Teoría Cinética de la Materia INTRO

ÍNDICE Solids, Liquids and Gases INTRO
 Vasos comunicantes ejercicios resueltos
Vasos comunicantes ejercicios resueltos Estado de la materia
Estado de la materia Phet estados da materia
Phet estados da materia Estados fisicos da materia e suas transformações
Estados fisicos da materia e suas transformações Cnice estados de la materia
Cnice estados de la materia Estados fisicos da materia
Estados fisicos da materia Estados de la materia intro
Estados de la materia intro Condensado fermionico
Condensado fermionico Ndice
Ndice Ndice
Ndice Higroscopicidad
Higroscopicidad Ndice
Ndice Surgistain precio
Surgistain precio Ndice
Ndice Ndice
Ndice Colimador
Colimador Ndice
Ndice Ipc laspeyres
Ipc laspeyres Nela gvoždiaková
Nela gvoždiaková Ivona gudelj
Ivona gudelj Nela kordiakova
Nela kordiakova Nela data
Nela data Estados financieros preliminares
Estados financieros preliminares Estados financieros consolidados y separados
Estados financieros consolidados y separados Ptrios
Ptrios Características de la edad antigua
Características de la edad antigua 19 estados y 5 territorios de méxico en 1824
19 estados y 5 territorios de méxico en 1824 Representação espaço de estados
Representação espaço de estados Estado de necesidad ines astorquiza
Estado de necesidad ines astorquiza