Predmet Neorganska hemija 2 Studijski program Master akademske










- Slides: 12

Predmet: Neorganska hemija 2 Studijski program: Master akademske studije Status predmeta: Obavezni Predmetni Profesor: Prof. dr Dragan M. Đorđević

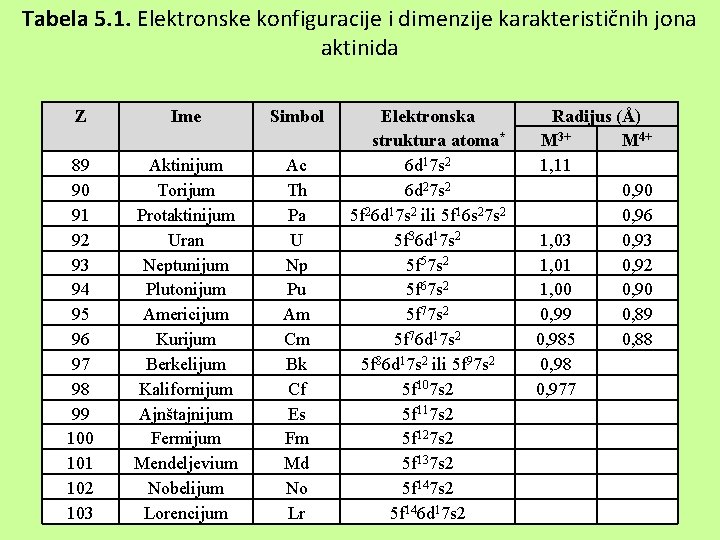
Aktinoidi ØAktinoidi obuhvataju seriju elemenata sa atomskim brojem većim od 89. Serija započinje sa aktinijumom 89 Ac: [ ] 6 d 17 s 2, a po analogiji sa lantanom, posle ovog elementa sledi serija elemenata kod kojih su valentni elektroni u 6 d- i 6 f-podnivoima koji su bliski po energijama. ØNajverovatnije elektronske konfiguracije ovih elemenata date su u tabeli koja sledi. 5 f-orbitale su prostranije u poređenju sa 4 f-orbitalama, pa tako i manje zaklonjene elektronima iz 6 s i 6 p-orbitala i u znatnoj meri učestvuju u stvaranju kovalentnih veza u metaloorganskim jedinjenjima ovih elemenata

Tabela 5. 1. Elektronske konfiguracije i dimenzije karakterističnih jona aktinida Z Ime Simbol 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 Aktinijum Torijum Protaktinijum Uran Neptunijum Plutonijum Americijum Kurijum Berkelijum Kalifornijum Ajnštajnijum Fermijum Mendeljevium Nobelijum Lorencijum Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Elektronska struktura atoma* 6 d 17 s 2 6 d 27 s 2 5 f 26 d 17 s 2 ili 5 f 16 s 27 s 2 5 f 36 d 17 s 2 5 f 57 s 2 5 f 67 s 2 5 f 76 d 17 s 2 5 f 86 d 17 s 2 ili 5 f 97 s 2 5 f 107 s 2 5 f 117 s 2 5 f 127 s 2 5 f 137 s 2 5 f 146 d 17 s 2 Radijus (Å) M 3+ M 4+ 1, 11 0, 90 0, 96 1, 03 0, 93 1, 01 0, 92 1, 00 0, 99 0, 89 0, 985 0, 88 0, 977

Grafički prikaz oksidacionih stanja aktinida

ØU strukturi atoma, a i prema nekim reakcijama, ima dosta sličnosti između lantanida i aktinida, ali i razlika. Iz podataka o elektronskim konfiguracijama, vidi se da prvi član niza torijum, ima konfiguraciju prelaznog elementa (nema elektrone u f- podnivoima). ØTo je zbog toga što su 5 f- orbitale prostranije i manje osetljive na porast naelektrisanja jezgra u poređenju sa 4 f- orbitalama. ØZato su u slučaju ovog elementa 6 d- podnivoi stabilniji u poređenju sa 5 f- podnivoima. Elektroni iz 5 f- podnivoa su slabije zaklonjeni elektronima iz 6 s- i 6 p- podnivoa pa u znatnoj meri mogu biti angažovani u stvaranju veza, što je posebno izraženo pri građenju metaloorganskih jedinjenja tj. prilikom nastajanja kovalentne veze.

ØU nizu aktinida od U do Am, 5 f-, 6 d-, 7 s- i 7 p- energetski podnivoi su bliskih energija i svi elektroni iz tih podnivoa sa podjednakom verovatnoćom mogu biti angažovani u stvaranju veza, pa ovi elementi imaju veću sklonost da grade kompleksna jedinjenja, a daleko ređe grade jedinjenja sa jonskom vezom. ØZbog bliskih energija odgovarajućih energetskih podnivoa, elektronska konfiguracija elemenata u datom oksidacionom stanju nije ista u svim jedinjenjima nekog elementa i u rastvoru zavisi od prirode liganada.

ØU izvesnoj meri i kod ovih elemenata se uočava, slično lantanoidnom sažimanju, tzv. ''aktinoidno sažimanje'', a manifestuje se u veličini atomskih i jonskih M+ i M 3+-poluprečnika. ØU jedinjenjima ovih elemenata postoje brojni joni, jer je energetska razlika između 5 f, 6 d i 7 s podnivoa relativno mala. Svi aktinidi grade jedinjenja sa oksidacionim brojem +3, mada je ono manje bitno za torijum (Th), protaktinijum (Pa), uran (U) i neptunijum (Np) i uglavnom je prisutno u trihalogenidima, opšte formule MX 3. Plutonijum ima i stabilan oksid M 2 O 3, a neki od ovih elemenata grade hidrokside tipa M(OH)3.

ØU nizu aktinida od torijuma (Th) do berkilijuma (Bk) postoje jedinjenja sa oksidacionim brojem metala +4 u nekim tetrahalogenidima, a u vodenim rastvorima Th, U, Np i Pu postoje slobodni M 4+ joni. Samo nekoliko od ovih elemenata ima M 6+-jon a Np i Pu jon M 7+. Osim katjona, aktinoidi grade i oksokatjone tipa MO 2+ i MO 22+. ØVeza metal - kiseonik u ovim jonima je vrlo jaka, pa su ti joni i strukturna jedinica nekih kristala. U vodenim rastvorima UO 22+-uranil i Pu. O 22+-plutonil su stabilni joni. Na primer, jedinjenje molibdena Mo. O 2 F 2 je molekulski halogenid, a uranil fluorid UO 2 F 2 je izgrađen iz O - U - O subjedinica koje su povezane fluoridnim mostovima.

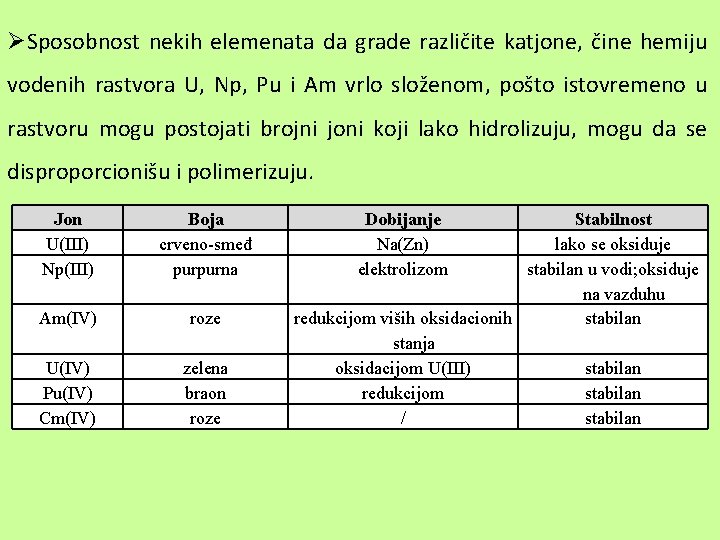
ØSposobnost nekih elemenata da grade različite katjone, čine hemiju vodenih rastvora U, Np, Pu i Am vrlo složenom, pošto istovremeno u rastvoru mogu postojati brojni joni koji lako hidrolizuju, mogu da se disproporcionišu i polimerizuju. Jon U(III) Np(III) Boja crveno-smeđ purpurna Am(IV) roze U(IV) Pu(IV) Cm(IV) zelena braon roze Dobijanje Na(Zn) elektrolizom Stabilnost lako se oksiduje stabilan u vodi; oksiduje na vazduhu redukcijom viših oksidacionih stabilan stanja oksidacijom U(III) stabilan redukcijom stabilan / stabilan

ØMagnetne osobine jedinjenja ovih elemenata se teško mogu predvideti, a njihova interpretacija je vrlo složena. ØElektronski apsorpcioni spektri jona aktinoida se sastoje od uskih apsorpcionih traka u vidljivoj i bliskoj UV i bližoj IR oblasti spektra, koje su rezultati f--f prelaza, slično kao i kod lantanida. U odnosu na lantanide, intenzitet ovih prelaza je oko 10 puta veći. ØZa ove metale je karakteristično da grade kompleksna jedinjenja sa halogenima i oksoanjonima (nitratom, sulfatom, oksalatom, karbonatom, fosfatima) i o njima se mogu naći brojni literaturni podaci jer su to uglavnom važni intermedijeri u procesima dobijanja aktinida složenim postupcima ekstrakcije različitim rastvaračima.

ØOpšta tendencija građenja kompleksa opada u nizu: M 4+ > Mo 22+ > M 3+ > Mo 2+ i zavisi od dimenzija jona. Koordinacioni broj metala u tim jedinjenjima je visok i raste sa porastom oksidacionog stanja metala: za M 3+ iznosi 5, a dalje može biti 6, 8, 9, 10. Nagrađene hemijske vrste imaju uglavnom vrlo složenu geometrijsku strukturu.
