Ontleding en industrie Hoofdstuk 5 Ontleding en industrie





















- Slides: 22

Ontleding en industrie Hoofdstuk 5

Ontleding en industrie n n Verbrandingsreactie Vormingsreactie n n Oxidatiereactie n n H 2 O (l) H 2 O (g) Ontledingsreactie n n n 2 Fe + O 2 2 Fe. O Faseveranderingen n n N 2 +3 H 2 2 NH 3 Een reactie waarbij uit 1 stof, 2 of meer verschillende reactieprodukten worden gevormd Demo ammoniumdichromaat Ammoniumdichromaat(s) chroomoxide(s) + stikstof(g) + water (l)

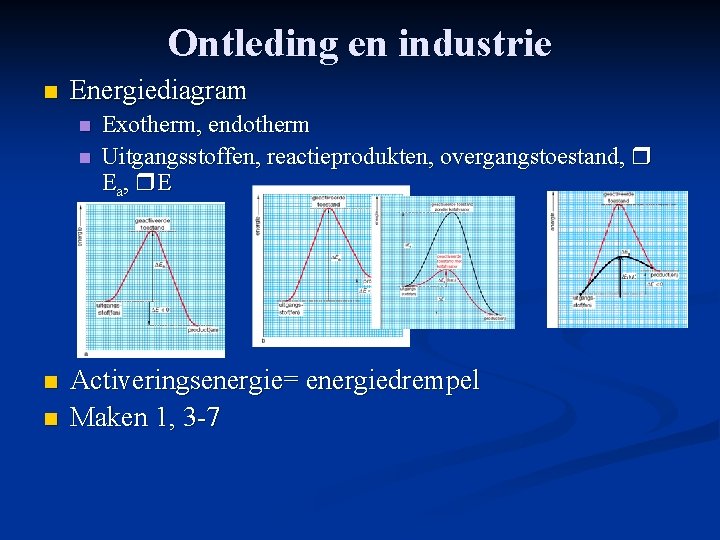
Ontleding en industrie n Energiediagram n n Exotherm, endotherm Uitgangsstoffen, reactieprodukten, overgangstoestand, E a , E Activeringsenergie= energiedrempel Maken 1, 3 -7

n Ontledingsreactie n n Calciumcarbonaat (s) Calciumoxide (s) (ongebluste kalk) en koolstofdioxide (g) n n n Een reactie waarbij uit 1 stof, 2 of meer verschillende reactieprodukten worden gevormd Ca. CO 3 Ca. O + CO 2 Ca. O + H 2 O Ca(OH)2 (gebluste kalk) Bespreken practicum n Suiker water + koolstof + brandbaar gas n n Water waterstofgas en zuurstofgas n n fotolyse = ontleding met behulp van licht Ontleding dynamiet n n electrolyse = ontleding met behulp van electriciteit Zilverchloride zilver en chloorgas n n Thermolyse= ontleding met behulp van verhitten 4 C 3 H 5(NO 3)3 (l)→ 12 CO 2 (g) + 10 H 2 O (g) + 6 N 2 (g) + O 2 (g) Maken 14 -21. (17 niet)

Bespreken t/m 21 n Thermolyse = ontledingsreactie onder invloed van temperatuur n Suiker n IJzererts n n n n 2 Fe 2 O 3 (s) 4 Fe (s) + 3 O 2 (g) Fe 2 O 3 (s) + 3 CO (g) 2 Fe (s) + 3 CO 2 (g) T=3000°C T=2000°C Fe is door C, nog bros. C verwijderen door O 2 over vloeibare ijzer te leiden. Er ontstaat CO Vergelijking? Productie ijzer Maken 22 -26

n Bespreken t/m 26 n Elektrolyse = ontledingsreactie onder invloed van electriciteit n Water, toestel van Hofmann 2 H 2 O (l) 2 H 2 (g) + O 2 (g) n Nadelen: explosief gas, opslag, weinig rendement brandstofcel, stroom nodig om H 2 te maken. n Voordeel: water is afval, H 2 is te maken n

IJsland n Brandstofcel n

Aluminium productie n Bauxiet n Al 2 O 3 n 2 Al 2 O 3 (s) 4 Al (l) + 3 O 2 (g) n Mengen met koper legering n Veel energie. Waar? IJsland n Huiswerk maken t/m 34, 29 niet n

Bespreken t/m 30 n Lezen 5. 6 n Maken 36 t/m 38 n Bespreken n

Elementen Kunnen niet ontleed worden ! Veel gebruikte indeling: metalen en niet-metalen Zie blz 56 voor periodiek systeem

Metalen Algemene kenmerken • Glimmend oppervlak • Geleiden warmte en elektriciteit • Kunnen vervormd worden • Kunnen in gesmolten toestand gemengd worden met andere metalen

Edelheid van metalen • Indeling metalen op basis van edelheid • Wat is corrosie? • Hoe edeler een metaal hoe minder corrosiegevoelig Het oppervlak van metalen is toch glimmend?

Edelheid • Edele metalen worden niet aangetast door water en lucht • Halfedele metalen worden niet aangetast door water en lucht maar wel door sommige zuren • Onedele metalen worden aangetast door water en lucht • Zeer onedele metalen reageren zelfs snel met vochtige lucht en water en moeten onder paraffineolie bewaard worden Filmpje natrium in water

Andere indeling: Lichte en zware metalen Lichte metalen hebben een lage dichtheid Voorbeelden: natrium, magnesium, aluminium, titaan Zware metalen hebben een grote dichtheid Voorbeelden: lood, cadmium, kwik Bij zware metalen denken we aan vergif

Legeringen • Een afgekoeld mengsel van samengesmolten metalen • Heef andere eigenschappen dan de afzonderlijke metalen • Bijv. Staal wordt roestvast (niet roestvrij!) gemaakt door legering met nikkel en chroom (Corus) Huiswerk Maken 42 t/m 47, behalve 46 Let op! Opgave 47 a: bij antwoord 3 moet staan Calcium is een zeer onedel metaal.

Niet-metalen Alle elementen die niet behoren tot de metalen zijn de niet-metalen Zie blz 56 voor periodiek systeem

Groep: edelgassen • Helium, Neon, Argon, Krypton en Xenon • Helemaal rechts in periodiek systeem • Reageren haast niet = inerte gassen • Helium: b. v. ballonvulling • Neon: b. v. neonverlichting! • Argon: zit bijvoorbeeld in gloeilampen zodat de gloeidraad niet verbrand Neonverlichting

Groep: halogenen • tweede groep van rechts in periodiek systeem • fluor, chloor, broom, jood • fluor is bij kamertemperatuur een geelgroen giftig gas • chloor is ook een giftig gas: gifgas in WO 1, chloortreinen • broom is bij kamertemperatuur een agressieve bruine vloeistof • jood is een zwartgrijze vaste stof: in water en alcohol als ontsmettingsmiddel gebruikt chloorgas in een fles

Element: fosfor • twee kristalvormen • witte fosfor: P 4 , is zeer licht ontvlambaar => fosfor brandbommen • rode fosfor: P, minder goed ontvlambaar => hulpstof in lucifers Element: koolstof • verschillende verschijningsvormen • grafiet en diamant: kristallijn koolstof • roet, cokes en Norit: amorf koolstof • grafiet kan elektriciteit geleiden : elektrodemateriaal • grafiet ook in potloden en als smeermiddel • diamant is zeer hard: b. v. diamantboren

Element: zwavel • geel • komt veel voor in vulkanische streken • gebruikt bij vulkaniseren van rubber Elementen: zuurstof en stikstof • hoofdcomponenten van lucht • zuurstof nodig voor verbranding • hoge temp. kunnen stikstof en zuurstof met elkaar reageren => NOx, zure regen

Element: waterstof • kleinste dichtheid • erg brandbaar! • gebruikt voor maken ammoniak, kunstmest en margarine • energiebron van de toekomst? Maken 48 -53 voor volgende keer af

Huiswerk
 Noughts and crosses chapter 4
Noughts and crosses chapter 4 Hoofdstuk 3
Hoofdstuk 3 Samenvatting bespiegeling hoofdstuk 9 massacultuur
Samenvatting bespiegeling hoofdstuk 9 massacultuur Wiskunde havo 4 handig tellen
Wiskunde havo 4 handig tellen Aardrijkskunde hoofdstuk 2 havo 4
Aardrijkskunde hoofdstuk 2 havo 4 Hoofdstuk in een opera
Hoofdstuk in een opera Exploitatiebegroting betekenis
Exploitatiebegroting betekenis Wiskunde a havo 4 hoofdstuk 3
Wiskunde a havo 4 hoofdstuk 3 Voltage
Voltage Belofte van pisa samenvatting
Belofte van pisa samenvatting Wat is n pryslied
Wat is n pryslied Antjie krog ma ontleding
Antjie krog ma ontleding Bitterbessie dagbreek ingrid jonker
Bitterbessie dagbreek ingrid jonker Kontant ontvangste joernaal
Kontant ontvangste joernaal Sonvanger gedig pdf
Sonvanger gedig pdf Wie is hy gedig
Wie is hy gedig Vroegherfs
Vroegherfs Suid afrika my hartsland gedig
Suid afrika my hartsland gedig Eerste worp gedig
Eerste worp gedig L'uso dell'acqua nelle industrie
L'uso dell'acqua nelle industrie Liceul de industrie alimentara sibiu
Liceul de industrie alimentara sibiu Kalkulation in handelsbetrieben
Kalkulation in handelsbetrieben Digitalizare industrie
Digitalizare industrie