ODJEL ZA FIZIKU Sveuilita Josipa Jurja Strossmayera u















































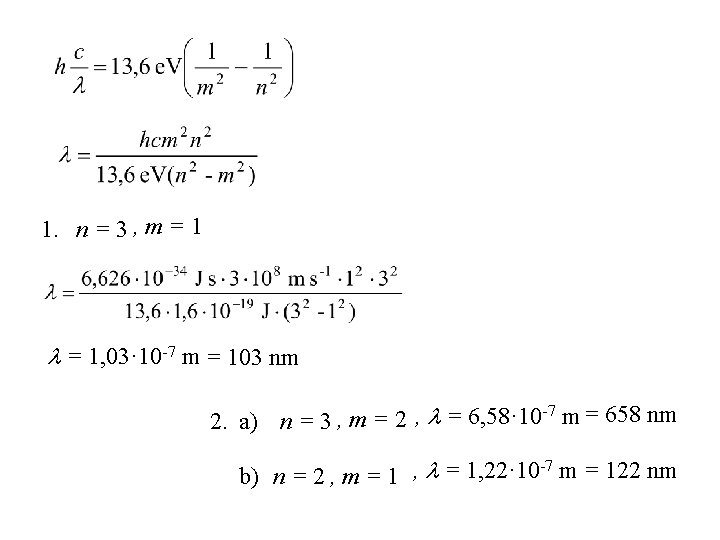







































- Slides: 100

ODJEL ZA FIZIKU Sveučilišta Josipa Jurja Strossmayera u Osijeku 2015. /2016. Elementarna fizika 2 Atomska fizika nastavnik: izv. prof. dr. sc. Branko Vuković asistentica: Ivana Ivković, prof. konzultacije: ponedjeljak, 10 -11 sati, ured pročelnika e-mail: branko@fizika. unios. hr http: //gama. fizika. unios. hr/~branko/ef 2. htm http: //gama. fizika. unios. hr/~branko/feedback. htm

Uvod u atomsku fiziku Do kraja 20. stoljeća – Različiti modeli o građi materije (atoma). J. J. Thomson –Atom je pozitivno nabijena kuglica u kojoj su vrlo sitni elektroni ravnomjerno raspoređeni. Atom kao cjelina je neutralan. Slikovito: a) Takav model sličio je ovalnom pudingu ili kolaču s grožđicama (kao elektronima). b) Tvar je bila građena od gusto pakiranih atoma koji su bili međusobno vrlo blizu nanizani i ispunjavali su tvar. vodik ugljik

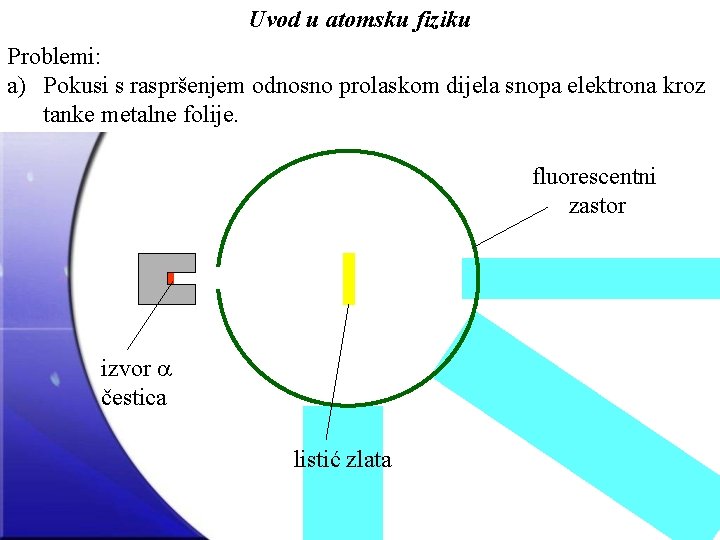
Uvod u atomsku fiziku Problemi: a) Pokusi s raspršenjem odnosno prolaskom dijela snopa elektrona kroz tanke metalne folije. fluorescentni zastor izvor čestica listić zlata

Uvod u atomsku fiziku Problemi: b) Nije se mogao objasniti diskretni spektar svjetlosti vodika pri električnom izboju. Linijski spektri vodik litij živa Spektralna analiza Kontinuirani spektri

Linijski atomski spektri Užareno tijelo kao izvor svjetlosti. Spektar je kontinuiran tj. sadrži raspodjelu intenziteta svjetlosti po svim valnim duljinama. (Sunčeva svjetlost pokazuje također kontinuirani spektar. ) Kontinuirani spektri Apsorpcijski spektar Sunca

Linijski atomski spektri Električni izboj (Nastaje pri prolasku snopa elektrona kroz neki plin u staklenoj cijevi gdje se elektroni ubrzavaju razlikom potencijala između dviju elektroda). Nakon sudara elektrona s atomima plina nastaje svjetlost. Svjetlost usmjerimo na spektrometar (ili rešetku). Neočekivan rezultat! U spektru nastaje samo nekoliko boja, odnosno "linija" koje karakteriziraju atome plina. Linijski spektri vodik litij živa

Linijski atomski spektri Neočekivan rezultat! U spektru nastaje samo nekoliko boja, odnosno "linija" koje karakteriziraju atome plina. Pripadnu raspodjelu intenziteta svjetlosti po diskretnim valnim duljinama ili linijama nazivamo linijskim spektrom. Valne duljine linija spektra određene su vrstom plina! Vodik daje uvijek niz linija s istim valnim duljinama, natrij ima svoj spektar, itd. vodik

Linijski atomski spektri 2 Linije spektra, osim područja vidljive svjetlosti, zalaze i u ultraljubičasto i infracrveno područje valnih duljina elektromagnetskih valova, koje oko ne vidi, ali se može detektirati npr. fotografski i dr. Linijski spektar vodika s pripadnim valnim duljinama: 656, 3 (H ); 486, 1 (H ); 434, 1 (H ); …; 364, 6 (H ) nm. 3 linije vodikova spektra su bile poznate nekoliko stotina godina. Za objašnjenje je trebalo nekoliko stoljeća.

Linijski atomski spektri 3 J. Balmer (1885. god. ) je pronašao pogodnu formulu u sljedećem obliku: = Valna duljina dane linije. R = Rydbergova konstanta (J. Rydberg, 19/20. st. ) R = 1, 097 107 m-1 n Cijeli broj, n = 3, 4, 5, 6, … n = 3 H n = 4 H n = 5 H … n = H = 364, 6 nm Najkraća valna duljina u danom spektru (nalazi se u ultraljubičastom području valnih duljina). Balmerova serija = Niz valnih duljina opisanih gornjom jednadžbom.

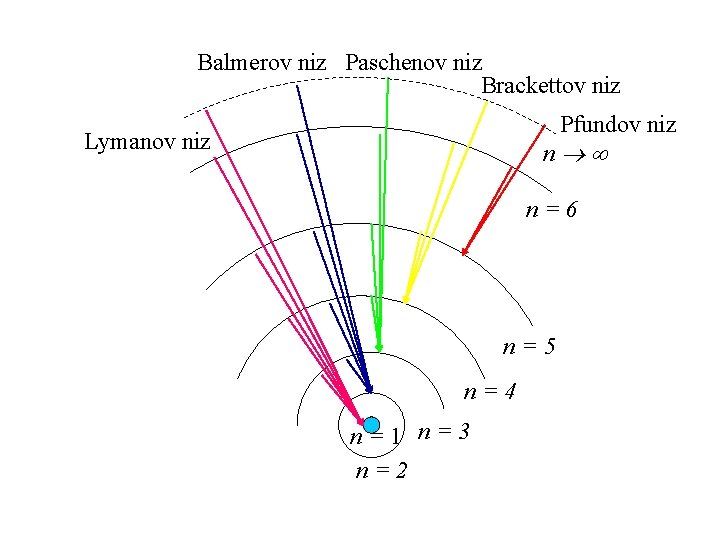
Linijski atomski spektri 4 Kasnije su otkrivene i druge spektralne serije vodika. Poznate su po prezimenima njihovih pronalazača. Opći oblik jednadžbe za tzv. valni broj (1/ ) za sve serije vodika možemo pisati slično Balmerovoj formuli: n = m+1, m+2, …, Cjelobrojni m pripada pojedinim serijama: m serija područje valnih duljina (nm) 1 Lymanova 91 - 122 ultraljubičasto 2 Balmerova 365 - 656 vidljiva (veći dio) 3 Paschenova 821 - 1876 4 Brackettova 1459 - 4053 5 Pfundova 2280 - 17462 infracrveno

Linijski atomski spektri 5 Izraz se ponekad piše kao izraz za frekvencije svjetlosti ( = c/ ). Balmerova serija: n = 3, 4, 5, … Frekvencija svjetlosti, koju emitira atom, može se pisati kao razlika dva člana, takozvana terma. Osim vodika, još nekoliko elemenata (koji daju linijske spektre pri električnom izboju u plinu) kao He+ (jedanput ionizirani helij), Li ++, i sl. , mogu se opisati sličnom formulom, Balmerovog oblika.

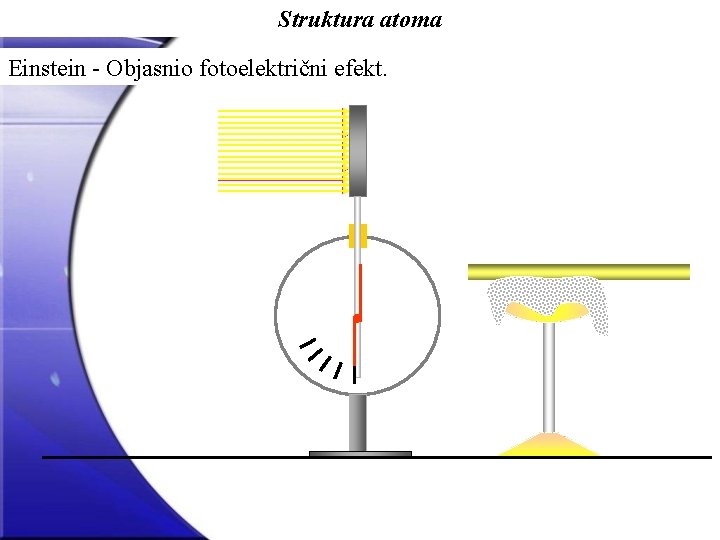
Struktura atoma Kraj 19. st. i početak 20. st. Niz vrlo važnih otkrića! Diskretna struktura linijskih atomskih spektara. Planck (1901. god. ) - Uvodi pojam kvanta energije, E = h (gdje je Planckova konstanta, h = 6, 62 10 -34 Js) Einstein - Objasnio fotoelektrični efekt. Fotoelektrični efekt - Metal obasjan svjetlošću oslobađa negativno nabijene čestice, elektrone. Pojava u kojoj snop svjetlosti poput mnoštva čestica, kvanta energije ili fotona, pada na metal i svoju energiju predaje elektronima, koji izvode tzv. rad izlaza (W) i napuštaju metal kao slobodni elektroni s kinetičkom energijom (K = mv 2/2); kinetička energija elektrona jednaka je razlici energije upadnog fotona (h ) i rada izlaza metala, ili: K = h - W

Struktura atoma Einstein - Objasnio fotoelektrični efekt.

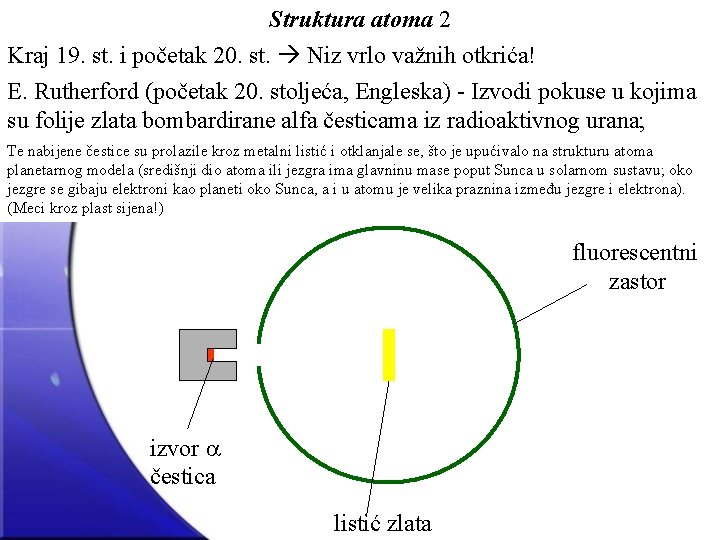
Struktura atoma 2 Kraj 19. st. i početak 20. st. Niz vrlo važnih otkrića! E. Rutherford (početak 20. stoljeća, Engleska) - Izvodi pokuse u kojima su folije zlata bombardirane alfa česticama iz radioaktivnog urana; Te nabijene čestice su prolazile kroz metalni listić i otklanjale se, što je upućivalo na strukturu atoma planetarnog modela (središnji dio atoma ili jezgra ima glavninu mase poput Sunca u solarnom sustavu; oko jezgre se gibaju elektroni kao planeti oko Sunca, a i u atomu je velika praznina između jezgre i elektrona). (Meci kroz plast sijena!) fluorescentni zastor izvor čestica listić zlata

Rutherfordov (planetarni) model. Jezgra atoma, oko 10 -15 m

Struktura atoma 2 Kraj 19. st. i početak 20. st. Niz vrlo važnih otkrića! Sav pozitivni naboj atoma skoncentriran je u jezgri, vrlo malog volumena (s promjerom jezgre oko 10 -14 m). U preostalom dijelu atoma (promjera blizu 10 -10 m), ili atomskom omotaču, nalazi se oblak negativnih elektronskih naboja. Ukupno je u atomu jednaka količina + i – naboja, pa je atom električki neutralan.

Struktura atoma 3 Jezgra atoma - Protoni, nositelji pozitivnog naboja, i neutroni koji su električki neutralni, i s masom približno jednakom masi protona. U atomu je broj protona jednak broju elektrona (redni broj atoma (Z) ili kemijskog elementa u periodnom sustavu elemenata). Masa elektrona je puno manja (1836 puta) od mase protona, pa je praktički sva masa atoma (oko 99, 9 %) sadržana u jezgri. Elektron se giba oko jezgre po putanji, koja je u najjednostavnijem slučaju kružnica (npr. kod atoma vodika), a pri takvom gibanju ulogu centripetalne sile igra privlačna Coulombova sila između elektrona i protona te vrijedi jednadžba: r = radijus putanje, v = brzina elektrona, 0 (dielektrična konstanta za vakuum) = 8, 85 10 -12 C 2/Nm 2), masa elektrona m = 9, 11 10 -31 kg i naboj e = 1, 6 10 -19 C.

Struktura atoma 4 Elektron u atomu Centripetalno ubrzanje v 2/r. v (obodna brzina) = oko 106 m/s. Zakoni klasične elektrodinamike Elektron bi zbog ubrzanja (promjene vektora brzine na kružnoj putanji) trebao emitirati EM valove s frekvencijom koju ima elektron kao kružnu frekvenciju na putanji oko jezgre. jezgra elektron Zbog emisije elektromagnetskog zračenja energija elektrona bi se trebala smanjivati, te bi elektron trebao smanjiti radijus putanje i na kraju pasti u jezgru. To se ne događa u prirodi! Zaključujemo: Na atom se ne mogu primijeniti zakoni klasične fizike.

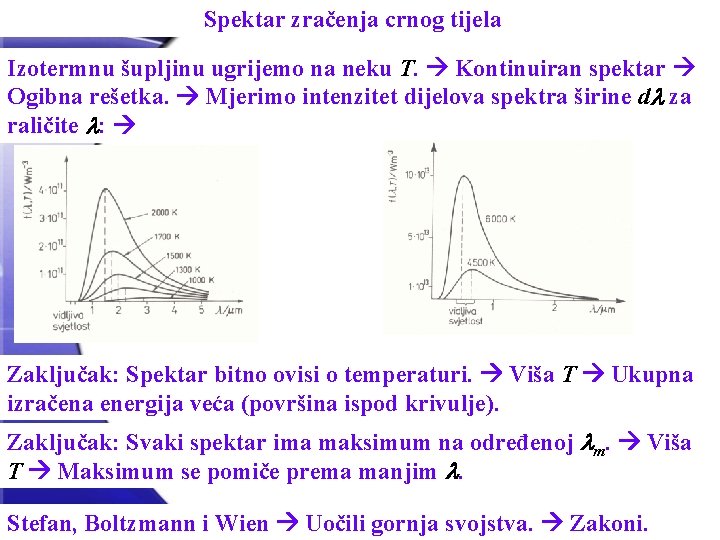
Spektar zračenja crnog tijela Izotermnu šupljinu ugrijemo na neku T. Kontinuiran spektar Ogibna rešetka. Mjerimo intenzitet dijelova spektra širine d za raličite : Zaključak: Spektar bitno ovisi o temperaturi. Viša T Ukupna izračena energija veća (površina ispod krivulje). Zaključak: Svaki spektar ima maksimum na određenoj m. Viša T Maksimum se pomiče prema manjim . Stefan, Boltzmann i Wien Uočili gornja svojstva. Zakoni.

Stefan - Boltzmannov zakon Jožef Stefan – Iz eksperimentalnih spektara zračenja uočio zakonitost: Ukupni intenzitet zračenja (energija koju zrači 1 m 2 površine tijela u sekundi) razmjeran je s četvrtom potencijom apsolutne temperature crnog tijela. L. Boltzmann (neovisno o Stefanu) teorijskim razmatranjima (zakonima termodinamike) došao do istog rezultata: Ukupna snaga P zračenja crnoga tijela površine S: Za realna tijela (siva), koristimo faktor emisije.

Stefan - Boltzmannov zakon 2 Primjer: Koliku snagu emitira 1 cm 2 površine crnoga tijela pri temperaturi 1000 K, odnosno 2000 K? 2 puta veća temperatura. 16 puta veća snaga!

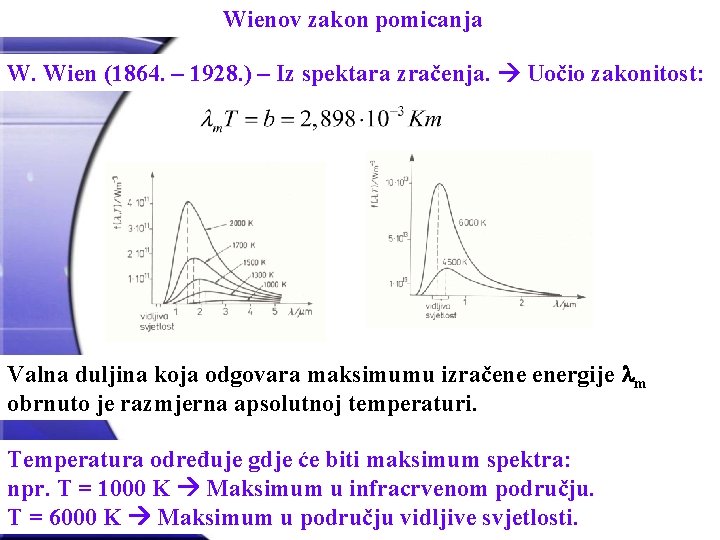
Wienov zakon pomicanja W. Wien (1864. – 1928. ) – Iz spektara zračenja. Uočio zakonitost: Valna duljina koja odgovara maksimumu izračene energije m obrnuto je razmjerna apsolutnoj temperaturi. Temperatura određuje gdje će biti maksimum spektra: npr. T = 1000 K Maksimum u infracrvenom području. T = 6000 K Maksimum u području vidljive svjetlosti.

Wienov zakon pomicanja 2 Primjer: Odredite temperaturu površine Sunca i snagu koju zrači 1 m 2 njegove površine pod pretpostavkom da Sunce zrači kao crno tijelo. Maksimum Sunčeva zračenja je za m = 480 nm. SVAKE SEKUNDE, SVAKI KVADRATNI METAR SUNČEVE POVRŠINE IZRAČI 7, 5. 107 W ENERGIJE!!!

Ultraljubičasta katastrofa Kraj 19. st. Izmjeren spektar zračenja crnog tijela. Pokušava se (metode statističke fizike, valna teorija svjetlosti) objasniti oblik krivulje spektra za pojedine temperature. Atomi – Shvaćeni kao harmonički oscilatori koji kada se pobude. Emitiraju kontinuirani spektar. Jeans i Rayleigh (engleski fizičari) – "Zračenje unutar izotermne šupljine se sastoji od stojnih valova. " Našli ukupan broj valova unutar frekventnog područja + Našli srednju energiju jednog vala (k. T). Dobili zakonitost za spektralnu gustoću zračenja: Poređenje s eksperimentom?

Ultraljubičasta katastrofa 2 Poređenje s eksperimentom? Formula je dobra za velike valne duljine (male frekvencije). Potpuno neslaganje za male valne duljine, tj. u ultraljubičastom području. Rayleigh–Jeansova funkcija nema maksimum. (Eksperimentalna ima. ) Rayleigh–Jeansova funkcija U ultraljubičastom području bi zračenje crnog tijela imalo beskonačno veliki intenzitet. Tzv. ULTRALJUBIČASTA KATASTROFA.

Početak kvantne fizike Rayleigh–Jeansova funkcija se ne slaže s eksperimentalnim spektrima! Mnogi fizičari su godinama pokušavali naći pogrešku u izvodu! Nisu je našli! Da li to znači da fizikalna teorija nije točna? Ali mnoge druge pojave se jako dobro opisuju s tom istom teorijom! Rješenje: Klasična fizika svojim zakonima ne može objasniti sve pojave u prirodi, pogotovo u mikrosvijetu atoma i molekula. Za objašnjenje zakona zračenja crnog tijela trebaju neke nove ideje. Max Planck, 14. prosinca 1900. Uveo pojam kvantiziranosti energije. = Rođendan kvantne fizike.

Planckov zakon zračenja Klasična fizika (prije Plancka). Atome i molekule u čvrstom tijelu aproksimira harmoničkim oscilatorima koji titraju. Atomi mogu kontinuirano mijenjati svoju energiju. Metode statističke fizike daju srednju energiju koju ima atom (molekula) na temperaturi T: Esr =k. T. Energija zračenja će biti proporcionalna srednjoj energiji molekule. Krivi rezultat, tj. ne slaže s s eksperimentom. M. Planck 1900. Smiona hipoteza o kvantiziranosti energije atoma. Drugim riječima: Atom ne može primiti ili emitirati bilo kako malu količinu energije, nego samo određenu količinu (KVANT) energije ili višekratnike toga kvanta. M. Planck Atom zrači EM zračenje u obliku kvanata energije čija je energija proporcionalna frekvenciji zračenja: E = h. h = 6, 626. 10 -34 Js Planckova konstanta

Planckov zakon zračenja 2 Klasična fizika Energija je neprekinuta varijabla i klasični harmonički oscilator može imati bilo koju vrijednost energije, od nule do maksimalne. Kvantni harmonički oscilator (atomi, molekule) Mogu imati samo određene diskretne vrijednosti energije; 0, h , 2 h , 3 h , . . .

Planckov zakon zračenja 3 Kolika je srednja vrijednost energije Planckova oscilatora? Za razliku od klasičnih oscilatora, svako stanje kvantnog oscilatora ima svoju vjerojatnost. Neka stanja su vjerojatnija od drugih: n=0 n=1 n=2 n=n Srednja energija = Ukupna energija/ukupan broj oscilatora

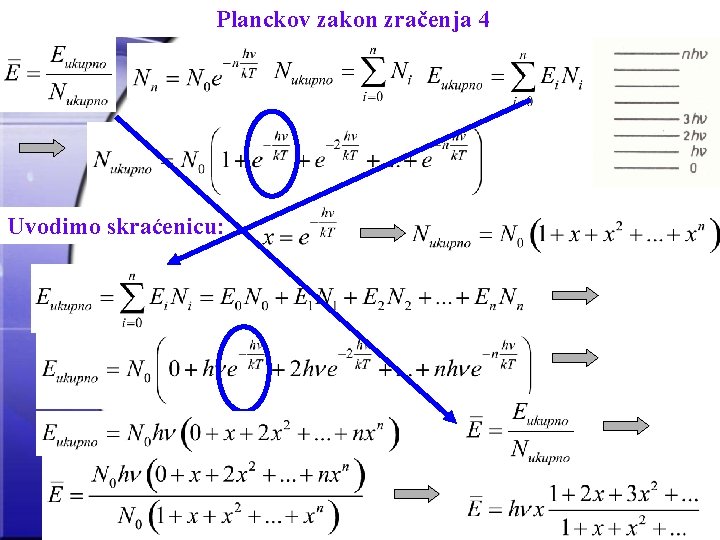
Planckov zakon zračenja 4 Uvodimo skraćenicu:

Planckov zakon zračenja 5 Uočimo: U nazivniku je geometrijski red. Uočimo: DERIVACIJA NAZIVNIKA JE BROJNIK!!! Za logaritamsku funkciju vrijedi: Prisjećanje: Suma geometrijskog reda:

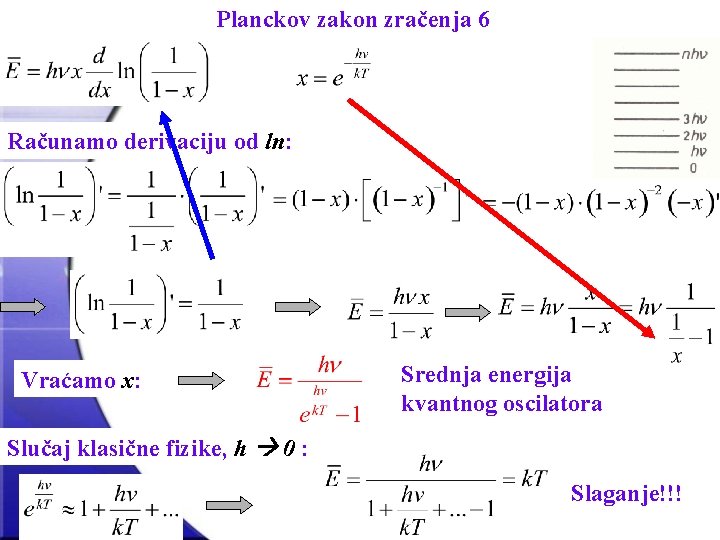
Planckov zakon zračenja 6 Računamo derivaciju od ln: Vraćamo x: Srednja energija kvantnog oscilatora Slučaj klasične fizike, h 0 : Slaganje!!!

Planckov zakon zračenja 7 Spektralna gustoća zračenja crnog tijela? Sjetimo se Rayleigh–Jeansova funkcije: U klasičnoj fizici je k. T bila srednja energija oscilatora. Umjesto nje, treba uvrstiti srednju energiju oscilatora za Planckov oscil. Koristimo relaciju: = c/ Planckova formula za spektralnu gustoću zračenja crnog tijela. Eksperiment? JAKO DOBRO SLAGANJE S PLANCKOVOM FORMULOM! Opravdanje za kvantiziranost energije? Nema je. To je svojstvo prirode, fundamentalna činjenica u prirodi!

Planckov zakon zračenja 8 Veza formula za spektralnu gustoća zračenja crnog tijela (klasična fizika i Planckova formula? Bila dobra samo za visoke temperature! h <<k. T Zaključak: Na visokim temperaturama, Planckova formula prelazi u Rayleigh– Jeansova funkciju. Nije bilo pogreške u klasičnoj fizici, ako promatramo visoke temperature!

Planckov zakon i Stefan-Boltzmannov zakon Iz Planckove formule izračunajmo ukupan intenzitet zračenja za sve valne duljine: Koristimo zamjenu: Tablični integral: Stefan-Boltzmannov zakon

Planckov zakon i Wienov zakon pomicanja Wienov zakon povezuje valnu duljinu u spektru na kojoj imamo maksimum zračenja. Krećemo od Planckova zakona, tražimo extrem: Zamjena:

Planckov zakon i Wienov zakon pomicanja Transedentna jednadžba čiji je korijen x = 4, 9652: Wienov zakon pomicanja

Neke primjene zakona zračenja crnog tijela Efekt staklenika: Prozirna tijela (kvarc, kalcit, saharoza, prozirna stakla, prozirne plastične mase, …). Prozirni su za vidljivu Sunčevu svjetlost. Npr. , prozorsko staklo debljine 2 mm. Za valne duljine 400 – 2500 nm. Apsorpcija skoro jednaka nuli, tj. staklo potpuno propušta te valne duljine. Npr. , prozorsko staklo debljine 2 mm. Za valne duljine veće od 5000 nm. Apsorpcija skoro jednaka jedinici, tj. staklo je neprozirno za te valne duljine. Efekt staklenika: Sunce emitira vidljivu svjetlost. Ona prolazi kroz staklo, grije biljke i tlo. Biljke i tlo isijavaju termičko zračenje (uglavnom infracrveno). Za te valne duljine staklo je neprozirno. Infracrveno zračenje se zadržava u stakleniku i povisuje temperaturu u njemu.

Neke primjene zakona zračenja crnog tijela 2 Tijela crne boje: Crna tijela za vidljivu Sunčevu svjetlost: čađa, ugljena prašina, … Crna tijela Gotovo potpuno apsorbira vidljivu Sunčevu svjetlost. Crna tijela Infracrveno zračenje? Za infracrveno zračenje čađa ima koeficijent apsorpcije manji od 1 Čađa je u infracrvenom području propusna.

Neke primjene zakona zračenja crnog tijela 3 Tijela bijele boje: Bijela tijela za vidljivu Sunčevu svjetlost: bijeli papir, snijeg, … Bijela tijela Difuzno reflektiraju vidljivu Sunčevu svjetlost. Bijela tijela Infracrveno zračenje? Za infracrveno zračenje snijeg ima koeficijent apsorpcije 1! "Snijeg je u infracrvenom području crn kao čađa. " Zašto se snijeg brže topi u gradovima nego u prirodi? "Čisti" snijeg Slabo se zagrijava (skoro sve reflektira). "Prljav" snijeg (npr. čađa) Čađa apsorbira Sunčevo zračenje (zagrijava se). Čađa emitira toplinsko zračenje (infracrveno). Snijeg upija infracrvene zrake. Zagrijavanje. Topljenje.

STRUKTURA ATOMA Prisjećanje: Bohrov model atoma 1913. g. Poopćio Planckovu hipotezu diskontinuiranosti (zračenje crnog tijela) na građu atoma. Bohrovi postulati: Osnove Bohrove teorije građe atoma: 1. Elektroni se oko jezgre u atomu kreću samo u strogo određenim putanjama. 2. Prijelaz iz jedne putanje u drugu moguć je samo kvantnim skokovima; prijelazu iz jedne putanje u drugu elektroni emitiraju ili apsorbiraju kvant elektromagnetskog zračenja čija je energija jednaka razlici između energija elektrona u krajnjoj i početnoj putanji.

Pri spontanom povratku u niže energijsko stanje elektron odašilje kvant energije elektromagnetskog zračenja, h , ili foton; energija je fotona jednaka razlici energija dviju staza, ili dviju energijskih razina, tj. m, n = cijeli brojevi; označuju redni broj kvantne staze. m > n Emisija kvanta energije Em - En m < n Apsorpcija kvanta energije Em - En Frekvencija emitiranog svijetla iz atoma određena je razlikom energijskih razina pripadnog "skoka" elektrona; emitirane frekvencije imaju diskretan spektar. m n

STRUKTURA ATOMA 2 1. Bohrov postulat Od svih mogućih klasičnih staza elektrona ostvarene su samo neke, tj. dopušteni su samo neki polumjeri staza elektrona. To su staze koje zadovoljavaju Bohrov kvantni uvjet da im je moment impulsa L jednak cjelobrojnom višekratniku Planckove konstante h podijeljene sa 2 p: n = glavni kvantni broj Određuje dopuštenu putanju oko jezgre. Polumjer dopuštene n-te staze? Iz kvantnog uvjeta i jednadžbe gibanja elektrona:

STRUKTURA ATOMA 3 Za vodik, Z = 1: Zaključak: Elektron se može gibati samo u određenim kružnicama. Radijusi tih kružnica rastu kao kvadrati cijelih brojeva: Radijus prve Bohrove kružnice (najkraća staza elektrona): Uvrstimo li poznate vrijednosti za Planckovu konstantu, masu i naboj elektrona. Radijus 1. elektronske staze jednak je 0, 52 · 10 -10 m. Eksperiment? Potpuno slaganje!

STRUKTURA ATOMA 4 Energija? Ukupna energija elektrona jednaka je zbroju kinetičke i potencijalne energije: Kvantni uvjet : Uvrstimo polumjer rn Energije diskretnih staza elektrona odnose se kao brojevi 1/n 2!

Jezgra atoma, oko 10 -15 m

STRUKTURA ATOMA 5 Bohr: "Vodikov je atom u stabilnom stanju kad se elektron giba u najmanjoj kružnici. " Vanjskim utjecajima možemo elektron prebaciti u neko više stacionarno stanje. Dok se elektron giba u nekoj od diskretnih kružnica, on ne zrači elektromagnetske valove. Atom emitira ili apsorbira svjetlost samo onda kad prelazi iz jednog stacionarnog stanja u drugo, a prema drugom Bohrovu postulatu frekvencija emitirane spektralne linije jednaka je: m, n = glavni kvantni brojevi početnog i konačnog stanja

STRUKTURA ATOMA 6 Uvrstimo li numeričke vrijednosti za masu i naboj elektrona, za vodikov atom (Z=1), dobivamo R=1, 09737· 107 m-1. Dobro slaganje s empirijskom Rydbergovom konstantom R'=1, 09678· 107 m-1 Proračun vrijednosti Rydbergove konstante, te objašnjenje vodikovih nizova. Golemi uspjesi Bohrove teorije. Preko noći preokrenuli shvaćanje o građi atoma. Bohrovim modelom je stvorena osnova suvremene atomske fizike. Franck-Hertzov pokus: Prva eksperimentalna potvrda nivoa! Promatrali raspršenje kolimiranog snopa elektrona na živinim parama pri niskom tlaku. Prvo pobuđeno stanje u atomima žive nalazi se na 4, 86 e. V iznad osnovnog stanja.

STRUKTURA ATOMA 7 Postupno povećavajući energiju upadnog elektronskog snopa, Franck i Hertz su u spektroskopu promatrali spektralne linije nastale sudarom elektrona sa živinim parama. Za energije elektrona manje od 4, 86 e. V, živina para nije zračila elektromagnetske valove. Čim je energija porasla preko te vrijednosti, živa je zračila u području karakteristične linije valne duljine =0, 256 m. Ta je linija nastala tako da su elektroni iz snopa pobudili atome žive u prvo pobuđeno stanje na 4, 86 e. V; povratkom na osnovno stanje, atomi žive su dobivenu energiju ( razliku u energiji između prvog pobuđenog i osnovnog stanja) emitirali kao kvant elektromagnetskog zračenja. Ovisnost struje o naponu ubrzanja.

STRUKTURA ATOMA 8 Kad se energija elektrona povećavala još više, i to iznad 6, 67 e. V, u spektroskopu se pojavila vidljiva linija zelene boje. Ta linija odgovara prijelazu između pobuđenog stanja na 6, 67 e. V i nižeg pobuđenog stanja na 4, 86 e. V. Zaključak: Diskretna kvantna stanja u atomu stvarno postoje!!! Postojanje energijskih razina Bit kvantnog opisa atoma. (I danas prihvaćamo od Bohrova modela. ) Povijesno značenje Bohrova modela; Planckovu diskontinuiranost energije prebacio u sam izvor zračenja, u atom i nju objasnio postojanjem energijskih razina u atomu. Razvoj znanosti. Mnoge teškoće na koje teorija nije mogla odgovoriti (atomi s više elektrona, tumačenje anomalnog Zeemanovog efekta, . . ). Nužni popravci!

Balmerov niz Paschenov niz Brackettov niz Pfundov niz Lymanov niz n n=6 n=5 n=4 n=1 n=3 n=2

Primjer: Koje valne duljine može zračiti vodikov atom kada se elektron nađe u trećoj stazi? Rješenje: n=3 1. n = 3 , m = 1, 03· 10 -7 m -7 2. a) n = 3 , m = 2 , = 6, 58· 10 m -7 b) n = 2 , m = 1 , = 1, 22· 10 m

Zadatak 1: Izračunajte najmanju i najveću valnu duljinu linija ( m i M ) u Lymanovu nizu. U kojem se dijelu elektromagnetskog spektra nalazi taj niz? Rješenje: m = 9, 1 10 -8 m = 91 nm M = 1, 22 10 -7 m = 122 nm

Zadatak 2: Elektron se u vodikovu atomu giba po stazi s rednim brojem 7. Prelazeći u nižu stazu, atom emitira valnu duljinu 397 nm. Kojem nizu pripada ta valna duljina? Rješenje: n=7 = 397 nm = 397 10 -9 m m=? m=2 Valna duljina pripada Balmerov nizu.

DZ 1: Izračunajte najmanji iznos energije što je može apsorbirati vodikov atom u osnovnom stanju. Rješenje: m=1 n=2 E=? E = 1, 632 10 -18 J = 10, 2 e. V

DZ 2: Foton valne duljine 83 nm ionizira vodikov atom koji se nalazi u osnovnom stanju. Kolika je brzina izbačenog elektrona? Masa je elektrona 9, 1 10 -31 kg. Rješenje: = 83 nm = 83 10 -9 m m = 9, 1 10 -31 kg v=? v = 6, 9 105 m s-1 Ek = Ef – 13, 6 e. V Ek = 2, 19 10 -19 J

DZ 3: Vodikovi atomi u osnovnom stanju pobuđuju se elektronima ubrzanim naponom 12, 5 V. Izračunajte valne duljine spektralnih linija koje će emitirati vodikovi atomi. Rješenje: m=1 U = 12, 5 V n=3
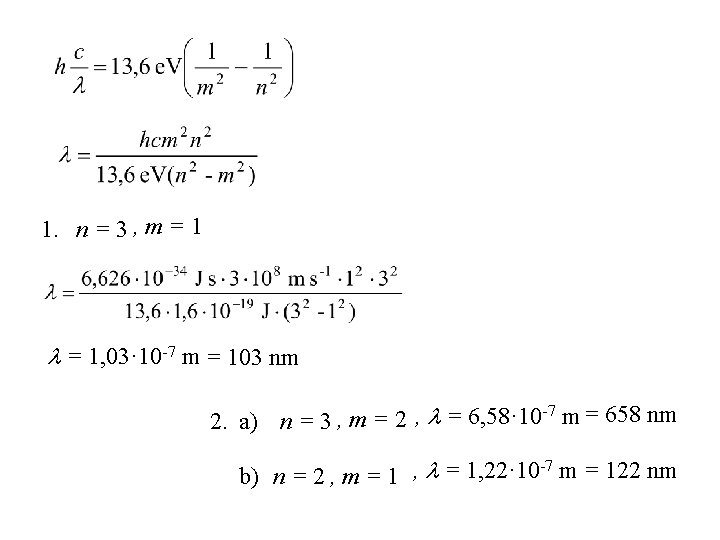
1. n = 3 , m = 1, 03· 10 -7 m = 103 nm -7 2. a) n = 3 , m = 2 , = 6, 58· 10 m = 658 nm -7 b) n = 2 , m = 1 , = 1, 22· 10 m = 122 nm

DZ 4: Monokromatsko zračenje nepoznate valne duljine pobuđuje atome vodika koji se nalaze u osnovnom stanju. U emisijskom spektru vodika koji se dobije nakon međudjelovanja javlja se ukupno šest spektralnih linija. Odredite energiju fotona upadnog zračenja i njegovu valnu duljinu. Rješenje: m=1 n=4 E, = ? E = 2, 04 10 -18 J = 12, 75 e. V = 9, 7 10 -8 m = 97 nm

STRUKTURA ATOMA (kvantnomehanički pristup) Bohrov model atoma. Energija kvantnog stanja je u potpunosti određena kvantnim brojem n koji daje slijed stanja. Stark je 1913. godine opazio da se linije Balmerova niza u vodikovom spektru cijepaju svaka u više linija, ako se ti atomi vodika nalaze u jakom električnom polju, tzv. Starkov efekt. Sommerfeld (1917. godine) Uvodi kvantizaciju momenta impulsa u atomu do koje dolazi uvođenjem eliptičkih staza umjesto kružnica. Dok nema vanjskog električnog polja. Sve elektronske putanje nekog kvantnog broja n imaju jednaku energiju pa skokovi s bilo koje od njih ili na bilo koju od njih, u okviru dane energijske ljuske (kvantni broj n), daju fotone jednake energije. Atom vodika u električno polje. Različito djelovanje na energiju elektrona u različitim putanjama (elektronima u svakoj elipsi dodaje različitu energiju) Svaki skok elektrona na različitu elipsu odgovarat će zračenju različite energije. Cijepanje spektralnih linija (Starkov efekt).

STRUKTURA ATOMA (kvantnomehanički pristup) 2 Sommerfeld Uvodi novi kvantni broj. Dopuštene vrijednosti novog kvantnog broja (označimo ga s l) su: Sommerfeldov model: Energijske razine atoma karakterizirane s dva kvantna broja: n (glavni kvantni broj) l (kvantni broj momenta impulsa) Bez djelovanja vanjskog polja: Sva stanja određenog kvantnog broja n a različitog l imaju istu energiju (degenerirana stanja). Vanjsko el. polje. Ukida degeneraciju i stanja se razlikuju po svojim vlastitim energijama. Magnetsko polje? Djeluje li ono na spektralne linije i ujedno na energijske razine atoma?

STRUKTURA ATOMA (kvantnomehanički pristup) 3 Magnetsko polje? Djeluje li ono na spektralne linije i ujedno na energijske razine atoma? Zeeman (1896. ) Promatrao spektralne linije svjetlosti koju emitiraju atomi u jakom homogenom magnetskom polju. Poznato: Svaki naboj u kretanju stvara električnu struju. Elektronskoj struji pripada određeni magnetski moment , povezan s momentom impulsa sljedećom relacijom: Atom u magnetskom polju B. Atom se ponaša kao i svaki drugi magnet u magnetskom polju. Povećanje potencijalne energija za:

STRUKTURA ATOMA (kvantnomehanički pristup) 4 Potencijalna energija atoma ovisi o orijentaciji njegovog magnetskog momenta prema smjeru magnetskog polja! Prema klasičnoj teoriji, ta se orijentacija može postaviti bilo kako, pa tako i potencijalna energija atoma može poprimiti sve vrijednosti od – B do + B. Linije emisije u atomskim spektrima trebale bi biti razmazane za iznos DE = 2 B. Eksperiment? Zeeman 1896. godine. Sasvim drukčiji rezultat. Zeeman je opazio da su se u spektroskopu linije podijelile, i to svaka od njih na tri oštre linije. Novi kvantni broj m (magnetski kvantni broj). Određuje moguće smjerove koje moment impulsa elektrona (odnosno magnetski moment atoma) može zauzimati prema smjeru vanjskog magnetskog polja.

STRUKTURA ATOMA (kvantnomehanički pristup) 5 Eksperimenti: Magnetski kvantni broj može imati samo vrijednosti: Dok nema vanjskoga magnetskog polja. Ravnina gibanja elektrona može ležati slobodno u prostoru. Atom stavimo u magnetsko polje. Ravnina gibanja mora se postaviti tako da je projekcija momenta impulsa u smjeru polja jednaka cijelom broju od h/2. Pored momenta impulsa, kvantizirane su i njihove projekcije u smjeru magnetskog polja.

STRUKTURA ATOMA (kvantnomehanički pristup) 6 Primjer: Za l=1, moment impulsa može se postaviti paralelno, okomito i antiparalelno smjeru vanjskog polja. Magnetski kvantni broj m poprima vrijednosti +1, 0 i – 1. Za l=2 Moment impulsa može se postaviti u pet smjerova; kutovi s magnetskim poljem B određeni su izrazom: Za l=3 Moment impulsa može se postaviti u sedam mogućih vrijednosti.

STRUKTURA ATOMA (kvantnomehanički pristup) 7 Kvantna teorija: Pri kvantnim prijelazima elektrona u atomu, magnetski kvantni broj se može mijenjati samo za 1 ili 0. To su tzv. izborna pravila, a svi ostali prijelazi su zabranjeni. Eksperimenti na atomima mnogih kemijskih elemenata: Dopuštene vrijednosti kvantnih brojeva komponenata za moment impulsa jesu (Vrlo često se umjesto l piše j): Goudsmit i Uhlenbeck (1927. ) Uvode pojam vlastitog momenta impulsa elektrona, kratko nazvanog spin (vrtnja elektrona oko vlastite osi). Pretpostavili da spinski moment impulsa ima vrijednost: Kvantno stanje atoma. Potrebna četiri kvantna broja: n, l, m, s

STRUKTURA ATOMA (kvantnomehanički pristup) 8 Kvantno stanje atoma. Potrebna četiri kvantna broja: n, l, m, s n = glavni kvantni broj Određuje energiju elektronske staze. Taj kvantni broj određuje tzv. elektronsku ljusku. Oznake: n 1 2 3 4 5 6 ljuska K L M N O P n = 1 Stabilno stanje. n=2 Prvo pobuđeno stanje. K-ljuska predstavlja energijski najnižu, najstabilniju ljusku. L-ljuska prvu iznad najniže itd. Sommerfeldov eliptički model uvodi dodatni orbitalni kvantni broj l koji određuje vrijednost momenta impulsa poprimajući vrijednosti:

STRUKTURA ATOMA (kvantnomehanički pristup) 9 Kvantno stanje atoma. Potrebna četiri kvantna broja: n, l, m, s Sommerfeldov eliptički model uvodi dodatni orbitalni kvantni broj l koji određuje vrijednost momenta impulsa poprimajući vrijednosti: Moguće vrijednosti orbitalnog kvantnog broja l: n=1 n=2 n=3 n=4 n=5 l=0 l=0 l=0 l=1 l=1 l=2 l=2 l=3 Često se kaže da orbitalni kvantni broj l određuje elektronsku podljusku, koje se obilježavaju ovako: l=4 l 0 1 2 3 4 5 podljuske s p d f g h Manjim vrijednostima orbitalnog kvantnog broja l odgovaraju u pravilu niže vrijednosti energije, tj. energijski stabilnija stanja. Kvantnim brojevima n i l su iscrpljeni svi mogući tipovi staza.

STRUKTURA ATOMA (kvantnomehanički pristup) 9 a Često se kaže da orbitalni kvantni broj l određuje elektronsku podljusku, koje se obilježavaju ovako: l 0 1 2 3 4 5 podljuske s p d f g h Primjer orbitala:

STRUKTURA ATOMA (kvantnomehanički pristup) 10 Kvantno stanje atoma. Potrebna četiri kvantna broja: n, l, m, s Treći kvantni broj m: Određuje orijentaciju momenta impulsa, a time i orbitalnog magnetskog momenta atoma prema vanjskom polju. Magnetski kvantni broj može poprimiti sve cjelobrojne vrijednosti od –l do +l, tj. Kvantnom broju m pripada dakle 2 l+1 različitih vrijednosti: l=0 0 l=1 -1 0 1 l=2 -2 -1 0 1 2 l=3 -3 -2 -1 0 1 2 3 l=4 -4 -3 -2 -1 0 1 2 3 4 U Bohr-Sommerfeldovoj teoriji, tri kvantna broja n, l i m, potpuno određuju stazu elektrona, oblik elipse i njezin nagib prema određenom smjeru.

STRUKTURA ATOMA (kvantnomehanički pristup) 11 Kvantno stanje atoma. Potrebna četiri kvantna broja: n, l, m, s Četvrti kvantni broj je projekcija spinskog momenta impulsa ms koja može biti ½ h/2 ili -½ h/2. Odgovara paralelnoj i antiparalelnoj orijentaciji orbitalnog momenta impulsa (ukupno dvije vrijednosti). Kvantni brojevi n, l , m i ms točno određuju pojedino stacionarno stanje elektrona u atomu vodika. Iako je taj zaključak izveden samo za vodikove atome, on se može primijeniti i na atome svakog drugog elementa, ako zanemarimo sile među elektronima. Središnje je pitanje teorije atoma: Kako su smješteni elektroni na pojedina stacionarna stanja? Odgovor daje Paulijev princip isključenja!

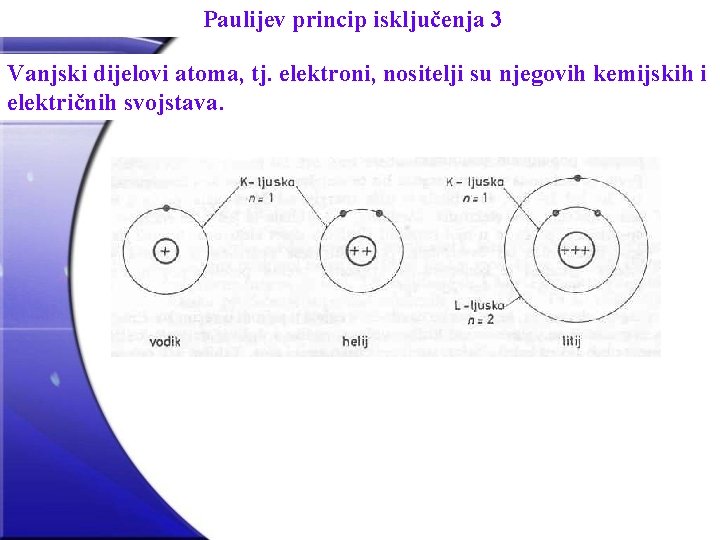
Paulijev princip isključenja U svom osnovnom stanju svaki se sustav u prirodi nalazi u najnižem mogućem energijskom stanju. Za atome to je stanje u kojem bi se svi elektroni nalazili u K-ljusci (n=1). Spektri karakterističnog rendgenskog zračenja su jasno pokazali da se elekroni u atomima težih elemenata nalaze i u višim ljuskama (L, M, N). Postoji ipak nešto sprječava da ti elektroni ne padnu na najnižu ljusku, odnosno najstabilnije stanje. Ključ po kojemu su elektroni raspoređeni na različita stacionarna stanja daje princip isključenja koji je 1925. godine iz proučavanja atomskih spektara postavio Pauli (Paulijev princip): U jednom kvantnom stanju, određenom četvorkom kvantnih brojeva n, l, m i ms može se nalaziti samo jedan elektron. Drugim riječima, zadamo li četvorku kvantnih brojeva n, l, m i ms, zadali smo kvantno stanje; u to kvantno stanje možemo smjestiti samo jedan elektron.

Paulijev princip isključenja 2 Paulijev princip isključenja je kvantnomehaničke prirode i nema mu sličnog u klasičnoj fizici. Paulijev princip dokazan je čitavim spektroskopskim iskustvom, a najspektakularnija primjena tog principa je bila u objašnjenju kemijskih svojstava elemenata i Mendeljejevog periodičkog sustava. Temelji: Kvantni brojevi i Paulijev princip. Daju ključ za poredak prema kojemu se pune elektronske ljuske u atomu. Svaka perioda u Mendeljejevljevoj tablici počinje alkalnim metalom, a završava plemenitim, inertnim plinom.

Paulijev princip isključenja 3 Vanjski dijelovi atoma, tj. elektroni, nositelji su njegovih kemijskih i električnih svojstava.

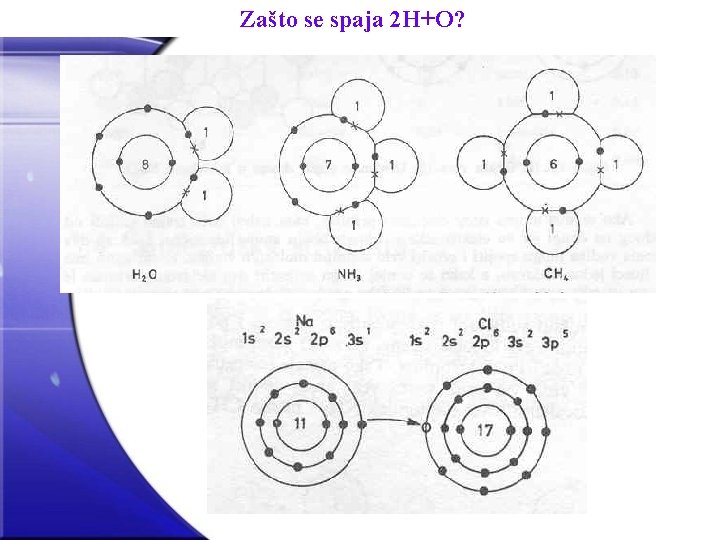
Zašto se spaja 2 H+O?

Broj elektrona po orbitalama n s p d 1 1 2 1 3 3 1 3 5 4 1 3 5 f 7 Ukupno: Total: 1 2 4 8 9 18 16 32 SPIN – udvostručuje broj elektrona Matematički - Maksimalan broj elektrona u ljusci:

De Broglievi valovi materije Prisjećanje: Newton (kasnije i Einstein) Korpuskularna teorija svjetlosti. Difrakcija i interferencija Svjetlost je valne prirode. Dualizam, val – korpuskula? Samo za svjetlost? De Broglie Iskreno vjerovao u jedinstvo prirode (vjerovali skoro svi veliki znanstvenici prije njega). Zašto bi svjetlost bila nešto posebno, različito od svega drugoga u prirodi? Louis de Broglie (1924. ) Pošao od stajališta da se atomi i svjetlost daju opisati istim zakonima! Kako atomima pripisati valne osobine? De Broglie Kako Bohrova stacionarna stanja protumačiti zornim slikama? Ima li u prirodi nešto slično stacionarnim stanjima u svijetu atoma? Odgovor? Pronađen kod valnih gibanja.

De Broglievi valovi materije 2 Odgovor? Pronađen kod valnih gibanja. Kad žica titra. Čujemo osnovni ton, onaj koji potječe od titranja žice kao cjeline. Postoje i druge vibracije koje se nazivaju višim harmonicima. Žica ima čvorove, tj. točke u kojima ostaje nepomična tijekom titranja. Koliko god složena bila vibracija, ona uvijek zadovoljava uvjet da se duljina žice može podijeliti samo na cijeli broj polovica valnih duljina, tj između oba kraja žice se mora nalaziti cijeli broj valnih brijegova i dolova. Valna duljina titranja žice je diskontinuirana!!! De Broglie. "Napravimo od naših žica prstenove i zamislimo da su to orbite elektrona u atomu!" De Broglie. U mislima zamijenimo gibanje elektrona po tim orbitama valom “koji odgovara elektronu”!

De Broglievi valovi materije 3 De Broglie. Zamislimo da će gibanje elektrona biti stabilno onda i samo onda ako u orbitu stane cijeli broj n “elektronskih valova” . De Broglie. Kada se na kružnici ne bi nalazio cijeli broj valnih duljina, tada bi u jednoj njezinoj točki morao titraj vala imati dva različita stanja faze, a to je nemoguće. Matematički (U opseg kruga treba staviti n valnih duljina): Uporedimo li ovu formulu s prvim Bohrovim postulatom: "valna duljina elektrona" Valna duljina elektrona obrnuto je proporcinalna momentu impulsa elektrona, a konstanta proporcionalnosti je Planckova konstanta h. De Broglie Gibanje elektrona (i drugih čestica), je valna pojava koja se podvrgava istim zakonima kao i valovi svjetlosti. Principijelna je razlika prema svjetlosti u tome što se de Broglievi valovi mogu kretati različitim brzinama.

De Broglievi valovi materije 4 Clinton J. Davisson i Lester H. Germer (1927. ) Eksperimentalna potvrda de Broglieve hipoteze da materija ima i valna svojstva. Pokus: Ogib elektrona. Proizveli katodne zrake – snopove elektrona- velike brzine čije su valne duljine bile u području rendgenskog zračenja. Njima bombardirali kristale nikla. Ako je de Broglieva hipoteza ispravna, moramo i kod refleksije elektrona na kristalu opaziti iste ogibne slike kao i kod refleksije rendgenskog zračenja. Davisson i Germer Mjerenjem ustanovili da između brzine elektrona katodnog zračenja i pridružene im valne duljine koja izaziva ogib postoji odnos: Interferentna slika elektrona. Egzaktno se slaže s de Broglievom relacijom!

De Broglievi valovi materije 5 Primjer: Izračunajte de Broglievu valnu duljinu kuglice mase 1 g koja se giba brzinom od 1 cm/s? Primjer: Izračunajte de Broglievu valnu duljinu čovjeka mase 70 kg koja trči brzinom od 7 m/s? Na 1 m puta stane 1036 valnih duljina!!!

Relacije neodređenosti Mjerenje u fizici. Više puta mjerimo. Javlja se pogreška. Rezultat mjerenja: f = f ±Df Precizan uređaj? Moguća vrlo mala pogreška! U svijetu atoma. Nešto potpuno novo! Postoji granica točnosti do koje se može poznavati stanje nekog fizikalnog sistema! Povećana točnost mjerenja jedne fizikalne veličine vodi nepoznavanju neke druge fizikalne veličine za taj sistem! To svojstvo izražavaju tzv. relacije neodređenosti. Za količinu gibanja p i za položaj x čestice vrijedi: Što točnije poznajemo položaj čestice, sve manje znamo o njezinoj brzini, i obrnuto. U svijetu atoma mjerenje utječe na stanje sistema!

Relacije neodređenosti 2 Primjer: Kroz pukotinu propuštamo snop elektrona i promatramo gdje elektroni udaraju na zastor. Točnost s kojom poznajemo položaj čestice koja je prošla kroz pukotinu jest: Dx = b Snop elektrona je val. Ogib na zastoru. Elektron je najvjerojatnije pao unutar glavnog maksimuma. Valna optika sin q = /b. Količina gibanja u smjeru okomito na upadni snop: px = p sinq Ukupna neodređenost količine gibanja u smjeru okomito na upadni snop: Dpx= 2 px De Broglie p = h/

Relacije neodređenosti 3 Zaključak: Uža pukotina. Točniji položaj. Ali zbog uže pukotine imamo jači ogib. Šira centralna pruga, tj. veća neodređenost količine gibanja. Eksperimenti: Relacije neodređenosti su posljedica de Broglieve valne teorije (čestica valni paket).

Schrödingerova kvantna mehanika Schrödinger Polazi od de Broglieve ideje. Valovi titranja žice su prikazani valnom jednadžbom. Schrödinger Slična jednadžba vrijedi i za "valove" u svijeta atoma. Pretpostavka da se oni šire brzinom svjetlosti (EM valovi): Rješenja gornje jednadžbe? Schrödinger Pretpostavlja rješenje u obliku: Gdje su operatori:

Schrödingerova kvantna mehanika 2 Stacionarni slučaj Schrödingerove jednadžbe. Kada je: Svako rješenje gornje jednadžbe zovemo materijalni val, a funkciju zovemo valna funkcija. Zahtjevi za valnu funkciju: jednoznačna, neprkidna, derivabilna, …

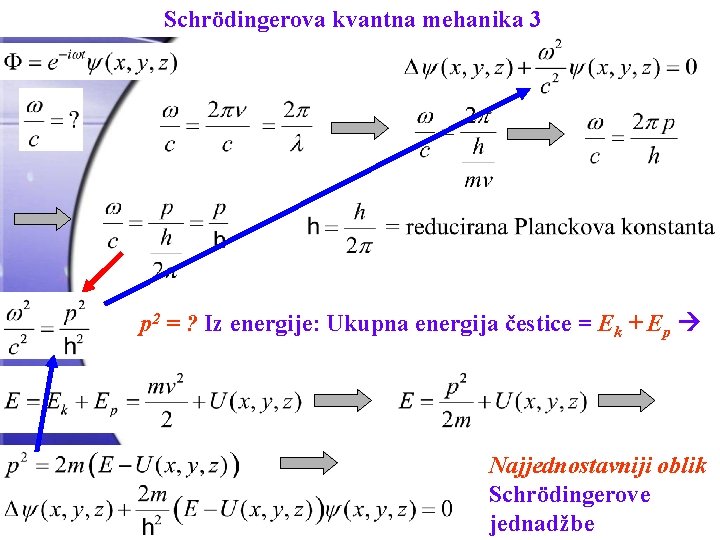
Schrödingerova kvantna mehanika 3 p 2 = ? Iz energije: Ukupna energija čestice = Ek + Ep Najjednostavniji oblik Schrödingerove jednadžbe

Schrödingerova kvantna mehanika 4 Složeno? Teško za pamtiti? Nema problema. Postoji i "ljepši" oblik. Erwin Schrödinger, Werner Heisenberg, Paul Dirac, Max Born, … Razvili tzv. KVANTNU MEHANIKU. (kolegij na 4. godini) Ideja: Pronaći vezu između fiz. veličina u klasičnoj fizici i fizikalnih veličina u kvantnoj mehanici! (Nešto slično kod jednolikog gibanja po kružnici: put kut; brzina kutna brzina, . . ) Koristimo nekoliko osnovnih načela kvantne mehanike: 1. Svakoj mjerivoj fizikalnoj veličini, koja ovisi o položaju i količini gibanja čestice, pripada neki operator. Operator? "Izraz koji djeluje na neku funkciju. "

Schrödingerova kvantna mehanika 5 Operator? "Izraz koji djeluje na neku funkciju. " Može sadržavati prvu ili drugu derivaciju, može značiti samo obično množenje, …. Primjeri operatora za jednodimenzionalno gibanje: Fiz. veličina Operator položaj x kol. gibanja p kinetička enegija ukupna energija x

Schrödingerova kvantna mehanika 6 Primjeri operatora za trodimenzionalno gibanje: Fiz. veličina položaj kol. gibanja moment kol. gibanja kinetička enegija ukupna energija Operator

Schrödingerova kvantna mehanika 7 2. načelo kvantne mehanike: Operatori fizikalnih veličina (A) su tzv. hermitski operatori: Za svako rješenje Sch. jednadžbe mora vrijediti: Za hermitske operatore vrijedi: Vlastite vrijednosti hermitskih operatora realni su brojevi. 3. načelo kvantne mehanike: Stanje nekog fizikalnog sistema može biti opisano valnom funkcijom svojstvene funkcije svojstvene vrijednosti

Schrödingerova kvantna mehanika 8 Za nas. Koristimo samo prvo načelo: Koristimo supstitucije: Polazimo od izraza za ukupnu energiju: E = K + U HAMILTONIJAN

Schrödingerova kvantna mehanika 9 Drugi oblik Schrödingerove jednadžbe Traženje funkcija koje zadovoljavaju Schrödingerovu jednadžbu. Traženje vlastitih funkcija operatora H (y 1, y 2, …, yn) Svaka od vlastitih funkcija operatora H ima vlastite vrijednosti (diskretne) tako da vrijedi:

Schrödingerova kvantna mehanika 10 Primjer: Naći svojstvene vrijednosti operatora A = -d/dx za funkcije y 1 = eikx i y 2 = e x.

Atom vodika u kvantnoj mehanici Za vodik je poznat izraz potencijalne energije: Teško za riješiti u kartezijevom sustavu. Koristi se sferni sustav: Laplasijan se tada može prikazati kao:

Atom vodika u kvantnoj mehanici 2 Sferni koordinatni sustav omogućava da se rješenje Sch. jednadžbe prikaže kao umnožak radijalne i kutne komponente: kuglina (sferna) funkcija radijalna funkcija Par kuglinih funkcija: Prva radijalna funkcija:

Atom vodika u kvantnoj mehanici 3 Traženjem svojstvenih vrijednosti energije, dobije se spektar: Isti rezultat kao u Bohrovom modelu atoma! U ovisnosti o glavnom kvantnom broju n. Imamo orbitalne kvantne brojeve l = 0, 1, 2, …, n-1. To znači da su energijska stanja degenerirana, tj. ako je n jednak. Energije svih stanja su identične, iako imaju različite valne funkcije (različiti l).

Atom vodika u kvantnoj mehanici 4 Glavni i orbitalni kvantni brojevi u vodikovu spektru: Uvođenje spina. Dodatak u valnoj funkciji: n, l, m, s – kvantni brojevi, isto značenje kao u Bohrovom modelu.

Fizikalno značenje valne funkcije Ima li valna funkcija fizikalno značenje? Ima kvadrat valne funkcije! To je vjerojatnost nalaženja čestice u nekom prostoru. Vjerojatnost da nađemo česticu unutar intervala a, b jednaka je: Budući da čestica mora biti negdje. P mora biti normirana, tj.

Fizikalno značenje valne funkcije 2 Primjer valne funkcije i njene gustoće vjerojatnosti:
 Odjel za fiziku osijek
Odjel za fiziku osijek Fakultet za fiziku rijeka
Fakultet za fiziku rijeka Josipa mokrovića 12
Josipa mokrovića 12 Josipa blagus
Josipa blagus Tjelesna i zdravstvena kultura 3 razred
Tjelesna i zdravstvena kultura 3 razred Oksonijev ion
Oksonijev ion Trg slobode pravopis
Trg slobode pravopis Josipa mrla
Josipa mrla Imena mjesta veliko slovo
Imena mjesta veliko slovo Josipa kern
Josipa kern Odjel za zdravstvene studije zadar
Odjel za zdravstvene studije zadar Odjel za kulturologiju osijek
Odjel za kulturologiju osijek Osobni dnevnik učenika na praktičnoj nastavi
Osobni dnevnik učenika na praktičnoj nastavi Sveučilište u zadru sestrinstvo
Sveučilište u zadru sestrinstvo Hotelijersko turistički tehničar praksa
Hotelijersko turistički tehničar praksa





































