norganik Maddeler ve levleri Hcredeki nemli inorganik maddeler




























- Slides: 28

İnorganik Maddeler ve İşlevleri Hücredeki önemli inorganik maddeler asitler, bazlar, tuzlar ve sudur. Şimdi kısaca bunları ele alalım. Su ve Biyolojik Önemi Dünyamızdaki hayatın okyanuslarda yani suda başladığı bir gerçektir. Her ne kadar bazı hayvanlar karasal ortama uyum göstermişlerse de bunlar da susuz yaşayamazlar. Neden susuz hayat olmaz? Bunu hücre ve organizma düzeyinde bazı örneklerle açıklamaya çalışalım. 1

Suyun canlılar aleminde başka önemli işlevleri de vardır. Bunlardan bazılarını şu şekilde özetleyebiliriz; 1 - Su hücredeki bazı kimyasal reaksiyonlarda reaksiyona giren veya reaksiyon sonunda oluşan maddedir. Bu reaksiyonlar canlılarda hayatın devamı için gereklidir. Örneğin çok hücreli hayvanların birçoğunda metabolik faaliyetler sonucu açığa çıkan karbondioksidin vücuttan atılması sırasında su, CO 2 ile tepkimeye girer. Böylelikle söz konusu artığın kolayca vücuttan atılacağı yere getirilmesi ve atılması sağlanır. Bazı hayvanlarda metabolik faaliyetler sonucu açığa çıkan su hayvanın su ihtiyacının tamamını veya önemli bir kısmını karşılar. 2

2 - Su, karbondioksit ile birlikte fotosentezin gerçekleşmesinde önemli rol oynar. Su olmadığı takdirde fotosentez gerçekleşemez, sonuçta fotosentez ürünleri oluşamaz. Fotosentez ürünlerinden birisi bitki tarafından çevreye verilen oksijendir. Bu oksijenin ana maddesi sudur. Su fotosenteze dahil olarak çevredeki yani su veya havadaki oksijenin bir kısmının kaynağını oluşturur. Bilindiği gibi oksijen aerobik canlılarda çok önemli bir maddedir. Bu önemli maddenin bir kısmının kaynağını oluşturan su canlılar açısından çok önemlidir. 3

3 - Su sahip olduğu yüksek özgül ısısı (bir maddenin bir gramının sıcaklığını bir derece santigrat yükseltmek için gerekli olan enerji miktarına özgül ısı denir, bu kalori veya joul ile ifade edilir. 1 kalori= 4, 185 joul’dür. ) sayesinde kendi ısısında büyük bir değişiklik olmadan fazla miktarda ısıyı absorbe ederek, biyolojik sistemi birdenbire ortaya çıkacak sıcaklık değişimlerinin yapacağı olumsuz etkilere karşı korur. Su molekülleri hidrojen bağlarıyla bir arada tutulduğundan yüksek özgül ısıya sahiptir. 4

Suyun sıcaklığını yükseltmek veya düşürmek için çok fazla miktarda ısı kazanması veya kaybetmesi gerektiğinden, okyanuslar veya diğer büyük sular nispeten sabit sıcaklıklardadır. Bu nedenle okyanuslarda yaşayan birçok canlı oldukça sabit bir çevre sıcaklığına sahiptir. Karada yaşayan bitki ve hayvanlardaki yüksek su içeriği, onların nispeten sabit iç sıcaklığı devam ettirmelerinde yardımcı olur. 5

Bunu bir örnekle şu şekilde açıklayabiliriz: 65 Kg ağırlığındaki bir insanın metabolik faaliyetleri sonucu günde yaklaşık olarak 2000 kilokalorilik ısı meydana gelir. Bu değerdeki bir ısı 65 kilogram ağırlığındaki insanın vücudunda bulunan sıvıya eşdeğer hacimdeki bir sıvının sıcaklığını laboratuvar şartlarında 50 o. C’dan 100 o. C’ta yükseltmeye yeter. Fakat insan vücudunun yaklaşık olarak %70’ni oluşturan su sayesinde vücut sıcaklığının normal sınırın (36 o. C) üstüne çıkması önlenir. 6

Biyolojik öneme sahip reaksiyonlar nispeten dar sıcaklık aralıklarında meydana gelebildiğinden, canlıda bulunan su sıcaklık dalgalanmalarını en alt düzeye indirdiği için canlılar açısından önemlidir. 7

4 - Su molekülleri hidrojen bağları ile bir arada tutulduğundan, su yüksek bir buharlaşma ısısına (bir sıvının bir gram gaz haline dönüşebilmesi için gerekli olan enerji miktarına buharlaşma ısısı denir) sahiptir. Suyun bir gramını bir gram buhar haline getirmek için 500 kaloriden fazla kalori gerekir. Suyun bu özelliği insanlarda ve bazı hayvanlarda vücut sıcaklığını düzenlemede önemli rol oynar, bu nedenle su önemlidir. İnsanlar terleme ile vücut yüzeylerine çıkardıkları az miktardaki suyun buharlaşması ile vücutlarından fazla miktarda ısıyı uzaklaştırırlar. 8

Yaz aylarının sıcak günlerindeki terlememizin ana nedenlerinden birisi vücuttan fazla ısıyı uzaklaştırmaktır. Köpeklerde ter bezleri yoktur. Köpekler aşırı faaliyetleri sonucu vücut sıcaklığında meydana gelen artışı, ağızlarını açıp dillerini uzatarak ve kesik hızlı bir şekilde nefes alıp vererek, dilleri üzerinden suyun buharlaşması ile önlemeye çalışırlar. 9

Su bir fazdan diğerine geçerken çevreden ısı alır veya verir. Su sıvı halden katı hale geçerken çevreye ısı verirken, sıvı halden gaz haline geçerken çevreden ısı alır. Su bu özelliği ile dünyadaki sıcaklığı stabilize etmede önemli rol oynar. Dünya yüzeyindeki su miktarı çok fazladır, bu büyük su kütlesi düşük sıcaklıkların dondurucu etkisine, aşırı yüksek sıcaklıkların yakıcı etkisine karşı koruyucu kalkan gibi iş görür. Belirtilen nedenlerden dolayı su canlılar için önemlidir. 10

5 - Su sahip olduğu yüksek ısı iletkenliği sayesinde hayvanların birçoğunda ısının tüm vücuda dağılmasında rol oynar. Böylelikle metabolik olarak çok aktif bölgelerde meydana gelen fazla ısının en kısa sürede oluştuğu bölgeden uzaklaştırılarak, metabolik faaliyetlerin aksamadan devamına yardımcı olduğundan canlılar için önemlidir. 6 - Suyun hidrojen atomları canlılardaki birçok organik bileşiğin yapısına girdiğinden ve su fotosentezde hidrojenin kaynağını oluşturduğundan canlılar açısından önemlidir. 11

7 - Su birçok canlı için yaşama ortamı olduğu gibi, aşırı soğukta sudaki canlıları donmaktan koruduğu için de önemlidir. Bir çok maddede sıcaklık düştükçe yoğunluk artmasına karşılık, su sahip olduğu hidrojen bağları nedeniyle sıcaklık düştükçe yoğunluğu azalır. Su en büyük yoğunluğa +4 o. C’ da ulaşır. Bu derecenin altındaki sıcaklıklarda yoğunluğu azalır ve su 0 o. C’ da donar. 12

Su donduğu zaman oluşan buz kitlesi yoğunluğunun azlığından dolayı suya batmaz, donan su (buz) suyun üzerinde kalır. Bu durum buz tabakası altındaki suyun sıcaklığının daha fazla düşmesini önleyerek, kışın veya devamlı soğuk olan bölgelerde sudaki canlıların dondurucu soğuklarda donmadan, buz tabakası altındaki suda yaşamalarını sağlar. Eğer su donarken yoğunluğu artsaydı, oluşan buz kitleleri suyun altında kalarak dipteki canlıları öldürürdü. 13

8 - Su adhezyon ve kohezyon özellikleri ile topraktaki mikroskobik boşluklardan bitkilerin köklerine, buradan itibaren yapraklara kadar giderek bitkilerin hayatta kalmasında önemli rol oynar. Su yüzey reaksiyonlarını kolaylaştırır, vücudun çeşitli kısımlarında sürtünmeyi azaltacak şekilde iş görür. Ayrıca bitkilerle hayvanlar arasındaki ilişkiler göz önüne alındığı zaman, canlılar açısından suyun ne kadar önemli olduğu anlaşılacaktır. 14

Asitler, Bazlar ve Tuzlar Asit çözündüğü zaman hidrojen iyonları (H+) ve bir anyon (negatif yüklü iyon) veren maddedir. Kısaca asit proton vericidir. Baz proton alıcısı olarak tanımlanır. Bazlar suda çözündükleri zaman bir katyon (pozitif yüklü iyon) ve bir hidroksil (OH-) iyonu verecek şekilde ayrışan maddelerdir. Hidrojen iyonu ayrıldıktan sonra asidin kalan kısmı konjuge baz olarak adlandırılır. 15

Asitler inorganik olabildikleri gibi organikte olabilirler. Sülfirik asit (H 2 SO 4) ve hidroklorik asit (HCl) inorganik asitlerdir. Laktik asit (CH 3 CHOHCOOH) ve asetik asit (CH 3 COOH) organik asitlerdir. Sodyum hidroksit (Na. OH) ve amonyum hidroksit (NH 4 OH) inorganik bazdır. 16

Bir çözeltideki hidrojen iyon konsantrasyonu 10 -7 molardan fazla ise çözelti asidiktir. Çözeltideki hidrojen iyon konsantrasyonu 10 -7 molardan az (hidroksil iyon konsantrasyonu 10 -7 molardan fazla) ise çözelti baziktir. Nötr haldeki saf suda hidrojen ve hidroksil iyonları konsantrasyonları eşit olup, her birisi 10 -7 molardır. 17

Bir çözeltideki hidrojen iyon konsantrasyonu ile hidroksil iyon konsantrasyonları çarpımı 1014’tür. Örneğin, 0, 1 molar hidroklorik asit içeren bir çözeltide H+ konsantrasyonu 0, 1 M veya 101 M’dır. Aynı çözeltideki OH- konsantrasyonu 1013 M’dır. 10 -1 x 10 -13=10 -14 olur. 18

Hidrojen iyonları konsantrasyonu genellikle küçük olduğundan, bir sıvıdaki asitlik veya bazlık derecesi genellikle p. H ile ifade edilir. p. H hidrojen iyonları konsantrasyonunun negatif logaritması olarak tanımlanır. p. H değeri 014 arasında değişir. p. H’sı yediye kadar olan çözeltiler asidik, p. H’sı yedi olan nötr (burada H+ ve OH- iyonları konsantrasyonları eşittir), p. H’sı yediden on dörde kadar olanlar baziktir. 19

p. H değerleri logaritmik olduğundan p. H’sı altı olan bir çözeltideki hidrojen iyon konsantrasyonu, p. H’sı yedi olan çözeltideki hidrojen iyon konsantrasyonunun on katı olur. Yani her p. H değeri kendisinden sonra gelen değere göre on kat fazla hidrojen iyon konsantrasyonunu ifade eder. 20

Biyolojik makro moleküllerin yapı ve aktiviteleri, ayrıca hücre ve organizmaların davranışları p. H ile ilişkilidir. Bu nedenle p. H’nın bilinmesi önemlidir. Bitki ve hayvan hücrelerinin içeriği ne güçlü asidik nede güçlü baziktir, asidik ve bazik maddelerin nötr karışımından ibarettir. 21

Tuzlar asit ve bazların etkileşimi sonucu meydana gelirler. Asit ve bazlar reaksiyona girdikleri zaman asitteki H+, bazdaki OH- ile su oluşturmak için birleşir. Tuz oluşumun hidroklorik asit (HCl) ve sodyum hidroksit (Na. OH) ile örnekleyelim. Hidroklorik asit su ve sodyum klorür oluşturmak için Na. OH ile reaksiyona girer. HCl + Na. OH→ H 2 O + Na. Cl 22

Asidin anyonu ile bazın katyonu da birleşerek tuzu oluşturur. Buna göre tuz; bir asitteki hidrojen atomunun yerini başka bir katyonun aldığı bileşik olarak tanımlanabilir. Bir tuzda katyon olarak hidrojen (H+), anyon olarak hidroksil (OH-) bulunmaz. 23

Asitler, bazlar ve tuzlar suda çözündükleri zaman yapıtaşları olan yüklü parçacıklara ayrılırlar ve elektrik akımını iletirler. Çözündükleri zaman yüklü parçacıklara ayrılıp elektrik akımını ileten maddelere elektrolitler denir. Şekerler, alkoller ve diğer birçok madde suda çözündükleri zaman yüklü parçacıklara ayrılmazlar ve elektrik akımını iletmezler. Bu tip maddeler elektrolit olmayan maddeler olarak tanımlanmıştır. 24

Bitki ve hayvanların hücrelerinde ve hücre dışı sıvılarında (kan gibi) çok sayıda çözünmüş halde tuz bulunur. Her ne kadar hücrelerdeki ve hayvanların vücut sıvılarındaki tuzların konsantrasyonu çok düşük ise de, bu düşük değer hücrenin normal işlevleri için çok önemlidir. 25

Normal şartlar altında birbiriyle ilişkili anyon ve katyonların konsantrasyonları dikkate değer derecede sabit kalır. Konsantrasyonda meydana gelecek önemli bir değişme, hücresel işlevlerde bozulmaya ve sonunda ölüme yol açar. Her iyonun konsantrasyonu onun canlı tarafından alınma ve atılma nispetine göre tayin edilir. 26

Hücrelerde tuzların çözünmesi sonucu açığa çıkan başlıca katyonlar sodyum (Na+), potasyum (K+), kalsiyum (Ca+2) ve mağnezyum (Mg+2)’dur. En önemli anyonlar da klor (Cl-), bikarbonat (HCO -3), fosfat (PO -4) ve sülfat (SO 4 -)’tır. Tuzların 3 2 ayrışması sonucu meydana gelen iyonlar canlıdaki birçok faaliyette önemli rol oynarlar. 27

Bu faaliyetlerden bir kısmını; 1. Bazı enzimlerde kofaktör olarak iş görmek, 2. Normal sinirsel faaliyetlerin gerçekleşmesinde ve kasların kasılmasında rol oynamak, 3. Hücre ile çevresi arasındaki ozmotik ilişkilerin sürdürülmesinde iş görmek, 4. Asit-baz dengesinde rol oynamak, 5. Hücre içi ve hücreler arası haberleşmede rol oynamak, 6. Kanın pıhtılaşmasında, kemik oluşumunda iş görmek, 7. Biyolojik öneme sahip bileşiklerin (örneğin hemoglobin, sitokrom, miyoglobin gibi) yapısında yer almak, oluşturur. 28
 Os pneumaticum kemikleri
Os pneumaticum kemikleri Gökyüzüne yakın yerlerde oluşan hava olayları
Gökyüzüne yakın yerlerde oluşan hava olayları Nemli yer priz tesisatı
Nemli yer priz tesisatı Yüzey aktif maddeler nelerdir
Yüzey aktif maddeler nelerdir Yüzey aktif maddeler nelerdir
Yüzey aktif maddeler nelerdir çok kolay alevlenir madde
çok kolay alevlenir madde Saf arı maddeler
Saf arı maddeler Iatro simya ne demek
Iatro simya ne demek Kü nerede
Kü nerede Paramanyetik ferromanyetik diamanyetik maddeler
Paramanyetik ferromanyetik diamanyetik maddeler Yanıcı ve yakıcı sembolü
Yanıcı ve yakıcı sembolü Hetrojen
Hetrojen Olan maddeler
Olan maddeler N tipi ve p tipi yarı iletkenler
N tipi ve p tipi yarı iletkenler Vahiy ve vahyin gönderiliş amacı
Vahiy ve vahyin gönderiliş amacı Kolloid maddeler
Kolloid maddeler Kondrosit kondrin
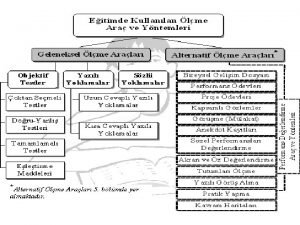
Kondrosit kondrin Doğru yanlış testlerinin avantaj ve dezavantajları
Doğru yanlış testlerinin avantaj ve dezavantajları Element molekülü
Element molekülü Parlayıcı maddeler nelerdir
Parlayıcı maddeler nelerdir Genel izlenimle puanlama
Genel izlenimle puanlama Molekül yapılı modeller
Molekül yapılı modeller Sülfatidler
Sülfatidler Lipofilik
Lipofilik Hidrofobik maddeler
Hidrofobik maddeler Ortak seçenekli maddeler
Ortak seçenekli maddeler ısı maddeler arasında alınıp verilebilir mi
ısı maddeler arasında alınıp verilebilir mi Yangın söndürmede kullanilan kimyasal maddeler
Yangın söndürmede kullanilan kimyasal maddeler Uzun cevaplı yazılı yoklamalar
Uzun cevaplı yazılı yoklamalar