Nomenclatura Inorgnica I Profesora Priscilla Guzmn Colegio San
















- Slides: 23

Nomenclatura Inorgánica I Profesora: Priscilla Guzmán Colegio San José

Habilidades • Conocimiento. • Comprensión. • Aplicación.

Contenidos • • Símbolos químicos. Cálculo de estados de oxidación. Óxidos. Anhídridos. Peróxidos Hidrácido. Hidruros.

Aprendizajes esperados • Conocer los principales símbolos químicos. • Conocer los estados de oxidación. • Conocer la nomenclatura tradicional y la IUPAC. • Nombrar y reconocer los principales compuestos inorgánicos binarios.

NOMENCLATURA INORGÁNICA • La nomenclatura es la encargada de nombrar a los compuestos e iones, para lo cual es necesario conocer los siguientes aspectos: • el nombre del elemento. • su estado de oxidación.

Estado de Oxidación (E. O. ) • Es la carga eléctrica que presenta el elemento. • Esta carga puede ser positiva o negativa. • Un elemento puede tener una o varias y su estado de oxidación está relacionado, en parte, con el grupo al cual pertenece.

Cálculo del estado de oxidación 1. Identificar la presencia de elementos de los grupos IA (+1), IIA (+2) o IIIA (+3) 2. Identificar la presencia de Oxígeno (-2) y/o Hidrógeno (+1) (excepto Hidruros y peróxidos) 3. En ausencia de elementos anteriores, emplear la relación del grupo con su E. Ox más común. Grupo IA IIIA IVA VA VIIA Estado de oxidación +2 +3 +4 +5 -2 -1 +1

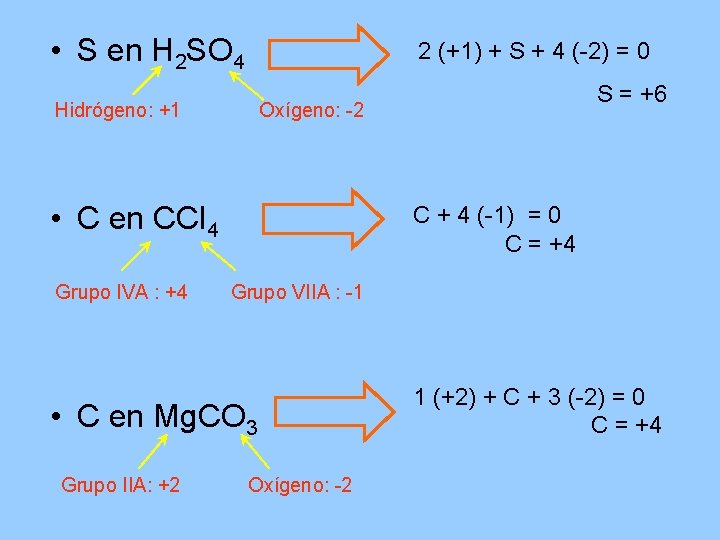
• S en H 2 SO 4 2 (+1) + S + 4 (-2) = 0 Hidrógeno: +1 Oxígeno: -2 • C en CCl 4 Grupo IVA : +4 C + 4 (-1) = 0 C = +4 Grupo VIIA : -1 • C en Mg. CO 3 Grupo IIA: +2 S = +6 Oxígeno: -2 1 (+2) + C + 3 (-2) = 0 C = +4

Pregunta P. S. U. 2. El estado de oxidación del fósforo en el compuesto Al. PO 4 es A) +1 B) +4 C) +5 D) +7 E) +9 C Aplicación

Compuestos Químicos • COMPUESTOS BINARIOS • Están formados por dos elementos, independientes de su cantidad de átomos. • Clasificación de compuestos binarios: óxido básico. anhídridos u óxidos ácidos. hidruros. hidrácidos. peróxidos. sales binarias.

Nomenclatura de compuestos binarios • Se pueden nombrar de acuerdo a Nomenclatura IUPAC o Tradicional. • IUPAC: Compuesto binario, (Nombre del elemento) ………………… (E. Oxidación en números romanos) Compuesto: Cu 2 O IUPAC: Óxido de Cobre (I)

Nomenclatura de compuestos binarios • Tradicional: Compuesto binario, (Nombre del elemento) ……………. terminación ico E. Oxidación mayor o único terminación oso E. Oxidación menor Compuesto: CO 2 Tradicional : Anhídrido Carbónico

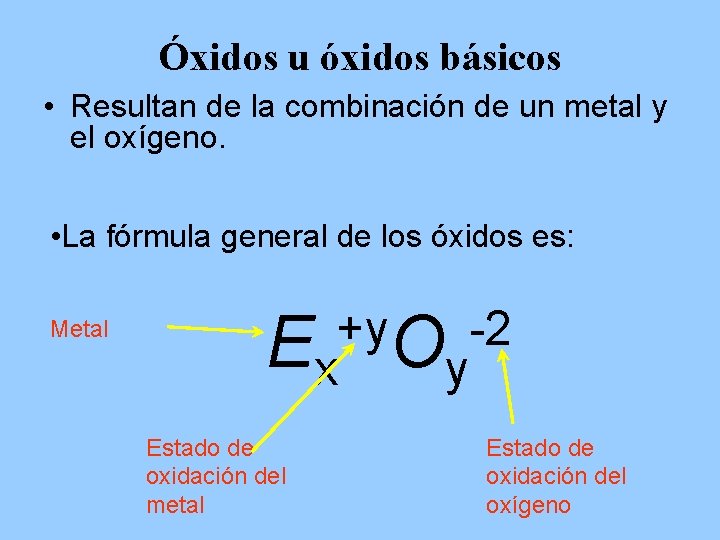
Óxidos u óxidos básicos • Resultan de la combinación de un metal y el oxígeno. • La fórmula general de los óxidos es: Metal +y -2 Ex Oy Estado de oxidación del metal Estado de oxidación del oxígeno

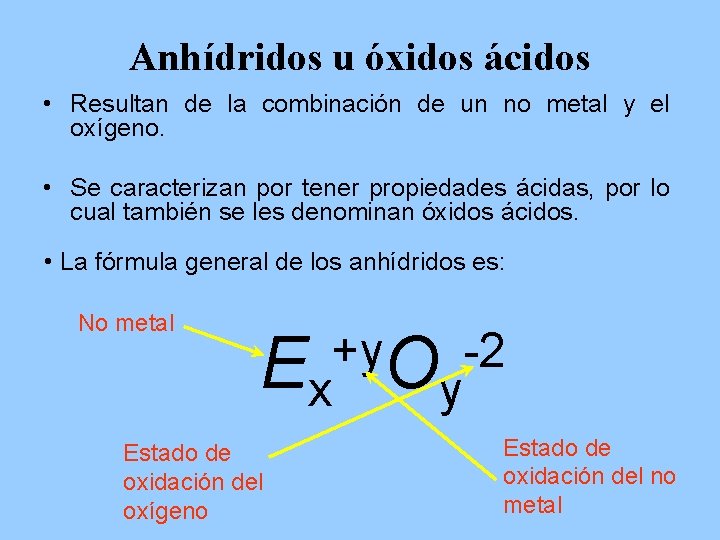
Anhídridos u óxidos ácidos • Resultan de la combinación de un no metal y el oxígeno. • Se caracterizan por tener propiedades ácidas, por lo cual también se les denominan óxidos ácidos. • La fórmula general de los anhídridos es: No metal +y -2 Ex Oy Estado de oxidación del oxígeno Estado de oxidación del no metal

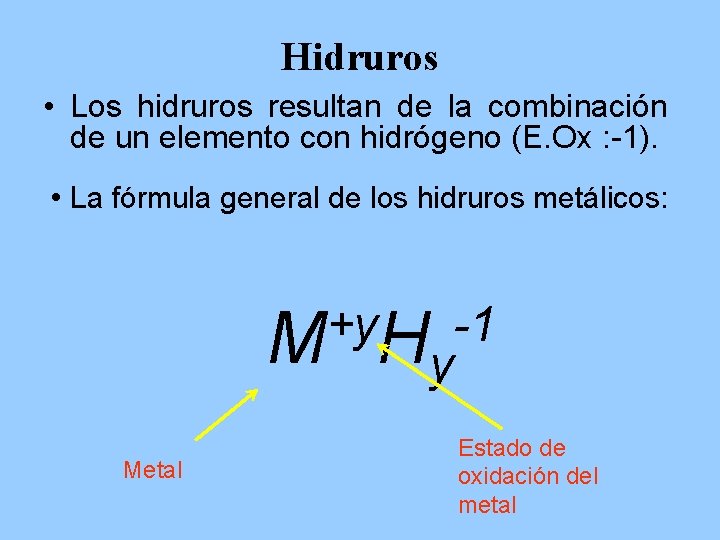
Hidruros • Los hidruros resultan de la combinación de un elemento con hidrógeno (E. Ox : -1). • La fórmula general de los hidruros metálicos: +y -1 M Hy Metal Estado de oxidación del metal

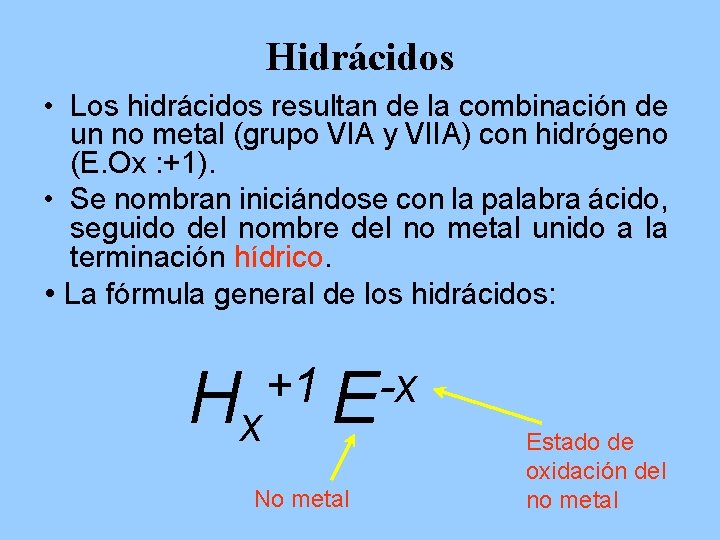
Hidrácidos • Los hidrácidos resultan de la combinación de un no metal (grupo VIA y VIIA) con hidrógeno (E. Ox : +1). • Se nombran iniciándose con la palabra ácido, seguido del nombre del no metal unido a la terminación hídrico. • La fórmula general de los hidrácidos: +1 -x Hx E No metal Estado de oxidación del no metal

Peróxidos • Resultan de la combinación de un metal (grupo IA y IIA) y el oxígeno. • El estado de oxidación del oxígeno es -1 • Se nombran anteponiendo la palabra peróxido. • La fórmula general de los peróxidos es: . Metal +y -1 E O 2 Estado de oxidación del metal (IA y IIA)

Pregunta P. S. U. 4. - Señale cuál(es) de los siguientes compuestos es(son) ternario(s): I. - Li. H II. - Na. OH III. - Mg. Cr 2 O 7 A) Sólo I B) Sólo II C) Sólo III D) Sólo I y II E) Sólo II y III E Reconocimiento

Pregunta P. S. U. 6. Uno de los principales componentes de la lluvia ácida es el dióxido de azufre, ¿cuál es la fórmula de este compuesto? A) SO 4 B) Si. O 3 C) SO 3 D) Si. O 2 E) SO 2 E Comprensión

Pregunta P. S. U. 9. Los compuestos Cu. O, CO y Ca. O 2 se clasifican respectivamente como A) óxido, anhídrido y óxido. B) óxido, anhídrido y peróxido. C) óxido, óxido y óxido. D) anhídrido, óxido y peróxido. E) anhídrido, anhídrido y óxido. B Reconocimiento

Pregunta P. S. U. 15. - El mineral conocido como “corindón” (Al 2 O 3) se puede clasificar como: A) Haluro. B) Sal. C) Óxido. D) Anhídrido. E) Carburo. C Comprensión

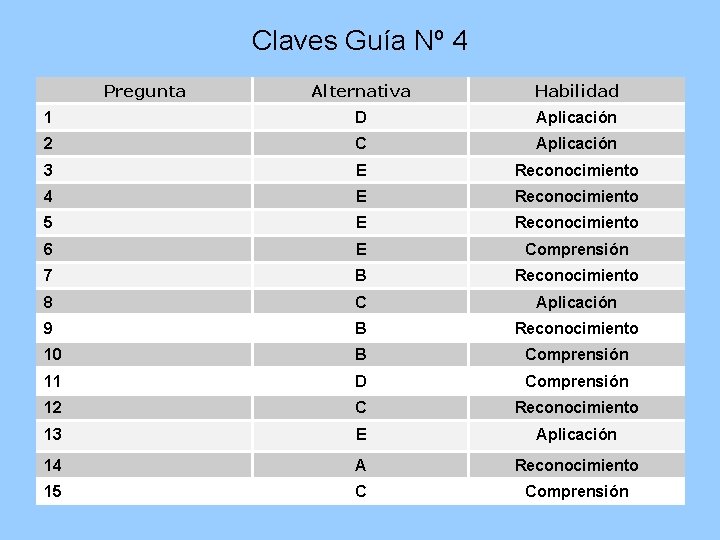
Claves Guía Nº 4 Pregunta Alternativa Habilidad 1 D Aplicación 2 C Aplicación 3 E Reconocimiento 4 E Reconocimiento 5 E Reconocimiento 6 E Comprensión 7 B Reconocimiento 8 C Aplicación 9 B Reconocimiento 10 B Comprensión 11 D Comprensión 12 C Reconocimiento 13 E Aplicación 14 A Reconocimiento 15 C Comprensión

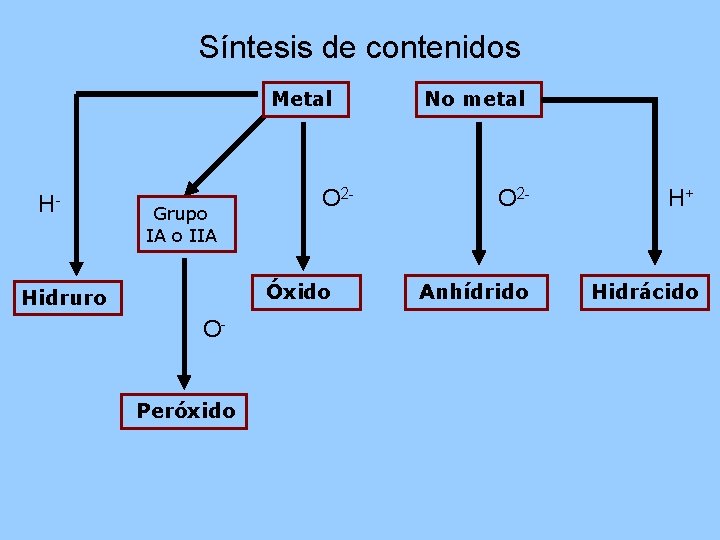
Síntesis de contenidos Metal H- Grupo IA o IIA O 2 - Óxido Hidruro OPeróxido No metal O 2 - H+ Anhídrido Hidrácido
 Enrique guzmn
Enrique guzmn Enrique guzmn
Enrique guzmn Karen roco wikipedia
Karen roco wikipedia Etnometodología
Etnometodología Isabella guzmn
Isabella guzmn Happy birthday emanuela
Happy birthday emanuela Priscilla arnold
Priscilla arnold Priscilla abdelazim
Priscilla abdelazim Priscilla and the wimps essay
Priscilla and the wimps essay Priscilla kankam
Priscilla kankam Priscilla and the wimps summary
Priscilla and the wimps summary Hyperbole in priscilla and the wimps
Hyperbole in priscilla and the wimps Len felicity
Len felicity Classification de priscilla white
Classification de priscilla white Priscilla white classification
Priscilla white classification Priscilla marinho valavicius
Priscilla marinho valavicius Aquila and priscilla
Aquila and priscilla Priscilla salas
Priscilla salas Acv tomografia
Acv tomografia Classification priscilla white
Classification priscilla white Priscilla taylor md
Priscilla taylor md Priscilla and the wimps theme
Priscilla and the wimps theme Early christian art
Early christian art Priscilla marinho valavicius
Priscilla marinho valavicius













































