Profesora Priscilla AGuzmn INTRODUCCIN LA TERMODINAMICA Colegio San



















- Slides: 27

Profesora: Priscilla. AGuzmán INTRODUCCIÓN LA TERMODINAMICA Colegio: San José

Termodinámica La Termodinámica estudia los intercambios energéticos que acompañan a los fenómenos físico-químicos. Al estudiar el intercambio de energía entre un sistema y su entorno, se puede predecir en qué sentido puede ocurrir el cambio químico o físico.

Termodinámica En ese aspecto, la Termodinámica predice: Ø si los reaccionantes se transforman en productos, o sea, si la reacción es espontánea o no. Ø en qué medida ocurre el cambio, o sea, las cantidades de productos que se obtienen y la cantidad de reaccionantes quedan sin reaccionar una vez terminada la reacción, o sea, cuando se alcanza el estado de equilibrio.

Termodinámica A la Termodinámica: Ø sólo le interesa el estado inicial y el estado final (no le importa cómo ocurre la reacción). Ø no le interesa el tiempo que demora en ocurrir el proceso. Ø para estudiar el proceso mide propiedades macroscópicas, tales como: temperatura, presión, volumen.

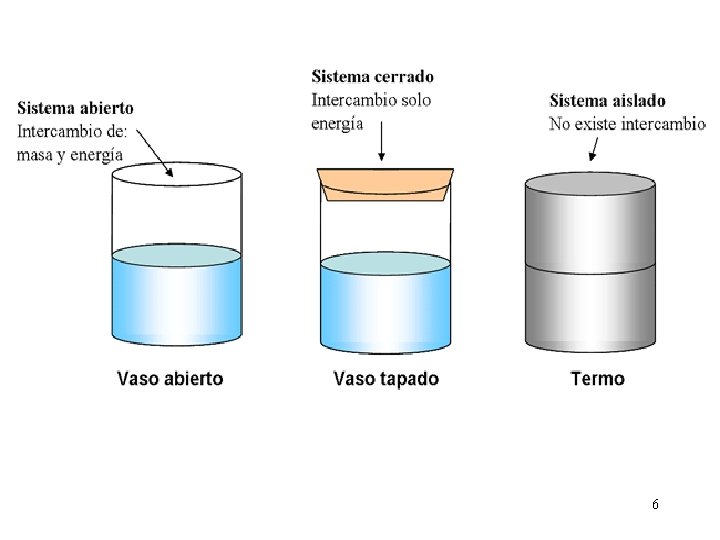
Termodinámica: conceptos básicos Sistema: parte del universo que va a ser estudiado y para lo cual se le ponen límites físicos o imaginarios. Puede ser: Ø sistema abierto: intercambia materia y energía con el medio. Ej: la célula. Ø sistema cerrado: sólo intercambia energía con el medio. Ej: una estufa. Ø sistema aislado: no intercambia materia ni energía. Ej: café caliente en el interior de un termo aislado.

6

Termodinámica: conceptos básicos Entorno: porción del universo que está fuera de los límites del sistema. En él hacemos observaciones sobre la energía transferida al interior o al exterior del sistema. Por ejemplo, un vaso de precipitado con una mezcla de reacción puede ser el sistema y el baño de agua donde se sumerge el vaso constituye el medio ambiente.

Termodinámica: conceptos básicos Para definir un proceso termodinámico basta establecer la diferencia entre el estado final y el estado inicial de sus propiedades macroscópicas, las cuales se llaman funciones de estado, como Ø temperatura Ø presión Ø volumen Estado termodinámico: es la condición en la que se encuentra el sistema. Cada estado termodinámico se define por un conjunto de sus propiedades macroscópicas llamadas funciones de estado.

Funciones de estado Las funciones de estado sólo dependen del estado inicial y del estado final y no dependen de cómo ocurrió el proceso. Las funciones de estado son: T = temperatura P = presión V = volumen E = energía interna H = entalpía S = entropía G = energía libre Las funciones de estado se escriben con mayúsculas. Otras funciones que dependen de cómo se realice el proceso no son termodinámicas y se escriben con minúsculas. Estas son: q = calor w = trabajo

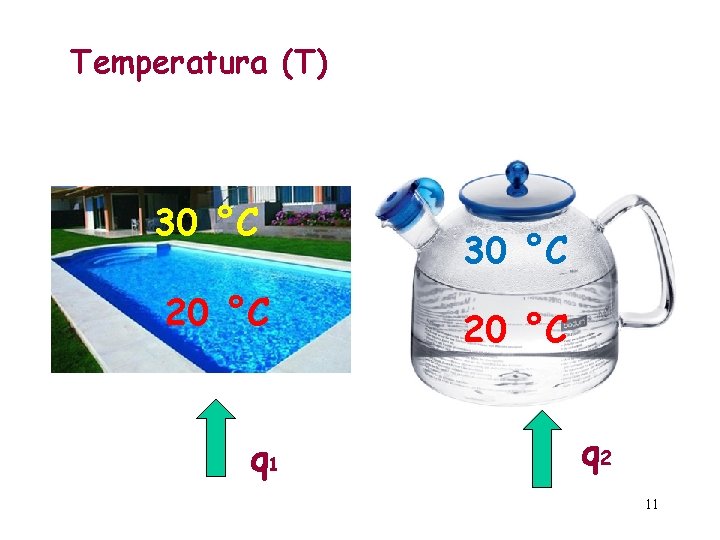
Energía interna y temperatura Energía interna: es la capacidad de un sistema para realizar un trabajo. Tiene que ver con la estructura del sistema. Se debe a la energía cinética de las moléculas, la energía de vibración de los átomos y a la energía de los enlaces. No se puede conocer su valor absoluto, sólo la diferencia al ocurrir un cambio en el sistema: DE. Es una función de estado. Temperatura (T): es una función de estado y corresponde a la medida de la energía cinética de las moléculas de un sistema.

Temperatura (T) 30 °C 20 °C q 1 30 °C 20 °C q 2 11

Calor y trabajo Calor (q): es la energía transferida entre el sistema y su ambiente debido a que existe entre ambos una diferencia de temperatura. No es una función de estado.

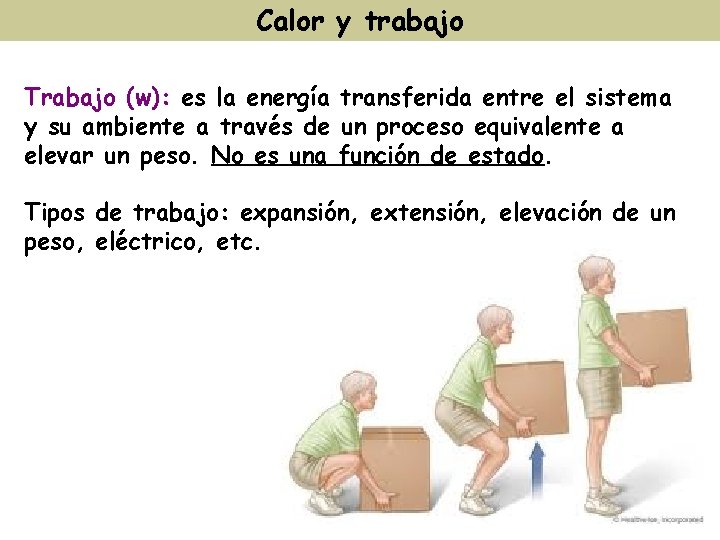
Calor y trabajo Trabajo (w): es la energía transferida entre el sistema y su ambiente a través de un proceso equivalente a elevar un peso. No es una función de estado. Tipos de trabajo: expansión, extensión, elevación de un peso, eléctrico, etc.

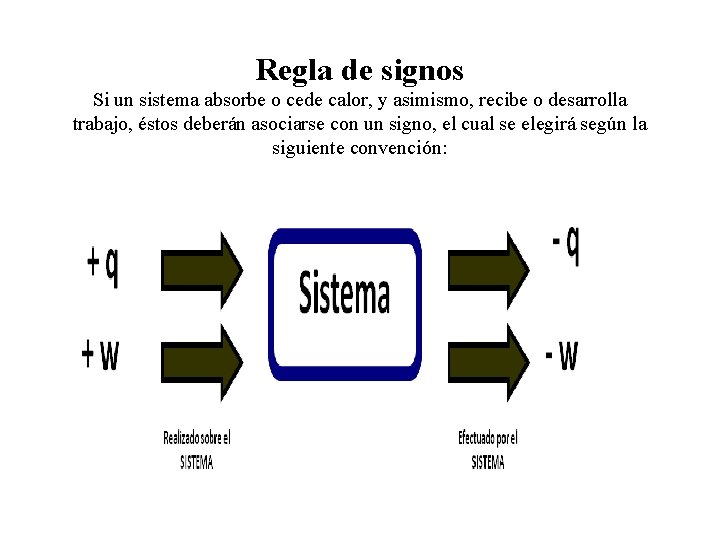
Regla de signos Si un sistema absorbe o cede calor, y asimismo, recibe o desarrolla trabajo, éstos deberán asociarse con un signo, el cual se elegirá según la siguiente convención:

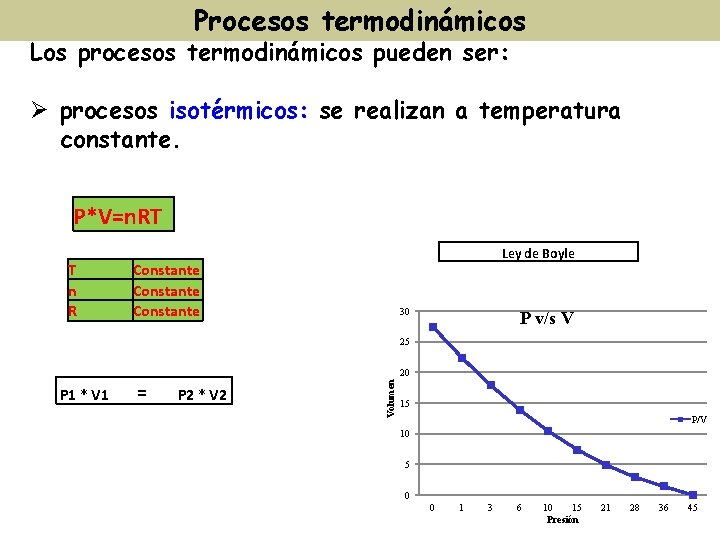
Procesos termodinámicos Los procesos termodinámicos pueden ser: Ø procesos isotérmicos: se realizan a temperatura constante. P*V=n. RT T n R Ley de Boyle Constante 30 P v/s V 25 P 1 * V 1 = P 2 * V 2 Volumen 20 15 P/V 10 5 0 0 1 3 6 10 15 Presión 21 28 36 45

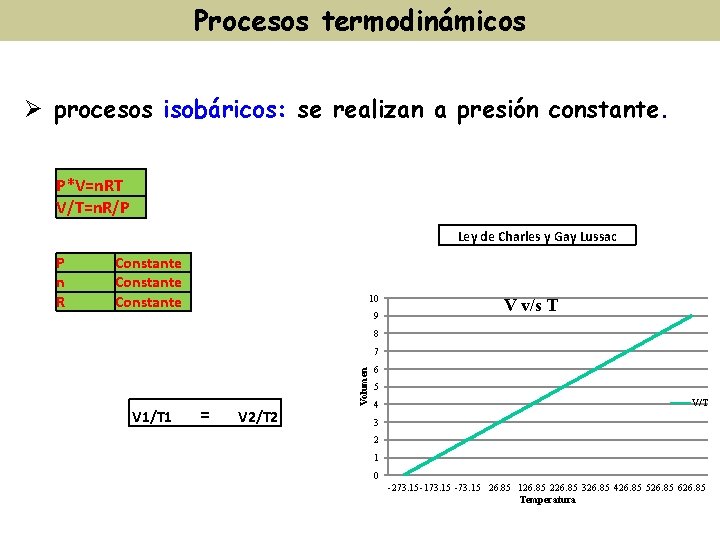
Procesos termodinámicos Ø procesos isobáricos: se realizan a presión constante. P*V=n. RT V/T=n. R/P Ley de Charles y Gay Lussac Constante 10 9 V v/s T 8 7 V 1/T 1 = Volumen P n R V 2/T 2 6 5 4 V/T 3 2 1 0 -273. 15 -173. 15 -73. 15 26. 85 126. 85 226. 85 326. 85 426. 85 526. 85 626. 85 Temperatura

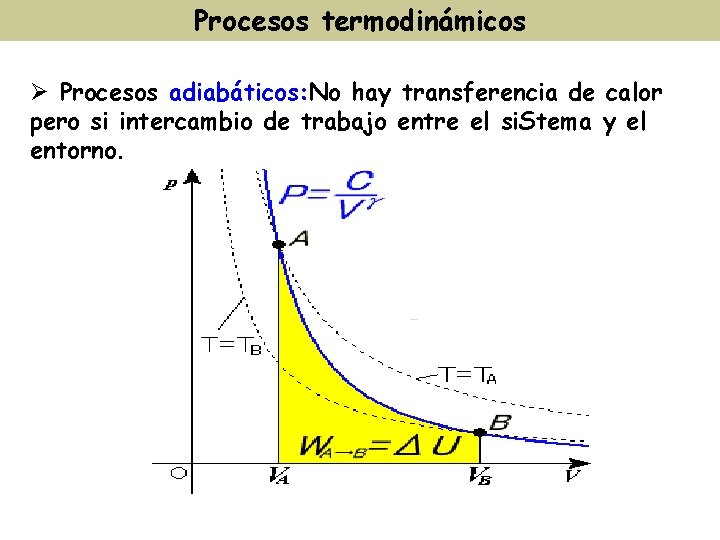
Procesos termodinámicos Ø Procesos adiabáticos: No hay transferencia de calor pero si intercambio de trabajo entre el si. Stema y el entorno.

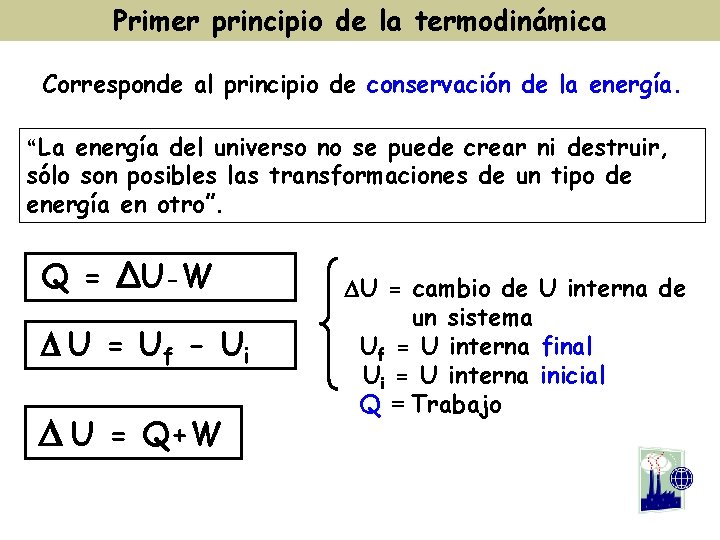
Primer principio de la termodinámica Corresponde al principio de conservación de la energía. “La energía del universo no se puede crear ni destruir, sólo son posibles las transformaciones de un tipo de energía en otro”. Q = ∆U-W D U = U f - Ui D U = Q+W DU = cambio de U interna de un sistema Uf = U interna final Ui = U interna inicial Q = Trabajo

Primer principio de la termodinámica DU = Q+W 1. Calcular la variación de energía interna para un sistema que ha absorbido 2990 J y realiza un trabajo de 4000 J sobre su entorno. ∆U = Q+W ∆U = 2. 990 J +(-4000 J) ∆U =-1. 010 J El sistema ha disminuido su energía interna en 1. 010 J.

Primer principio de la termodinámica Ejercicios 1. Calcular la variación de energía interna para un sistema que ha absorbido 5000 J y realiza un trabajo de 3000 J sobre su entorno. ∆U = Q+W ∆U = 5. 000 J +(-3000 J) ∆U = 2000 J

Primer principio de la termodinámica 2. Calcular la variación de energía interna para un sistema que ha liberado 2. 590 J y el trabajo es realizado por las fuerzas esteriores sobre el sistema, siendo el valor del trabajo 3. 560 J. ∆U = Q+W ∆U = -2590 J +(+3560 J) ∆U = +978 J

Entalpía Describe los cambios térmicos que se llevan a presión cte. : DU = qp + P x DV donde, QP es calor a presión cte Por lo que, para el calor intercambiado en estas condiciones se cumple: Qp =(U 2+ P x. V 2)-(U 1+ P x V 1) El término U+ P x. V recibe el nombre de entalpía(H) QP= H 2 -H 1=∆H

La variación de entalpía(∆H) es igual a la diferencia entre la entalpía de los productos y la de los reactantes: ∆H = Hproductos-Hreactantes Dependiendo del calor puesto en juego en un proceso químico, las reacciones pueden ser endotérmicas o exotérmicas.

Entalpía Si un sistema (reacción) Ø absorbe calor es ENDOTERMICO y DH es positivo. DH = (+) Ø libera calor es EXOTERMICO y DH es negativo. DH = (-) Se han medido los cambios de entalpía estándar: DH° en condiciones estándar: P= 1 atm tº = 25 °C Concentración de los componentes del sistema = 1 M

Entalpía Ø Cambio de entalpía estándar de formación: DH°F = calor liberado o absorbido al formarse 1 mol del compuesto a partir de sus elementos. Ø Cambio de entalpía estándar de reacción: DH°R = calor liberado o absorbido en una reacción química. Los cambios de entalpía estándar de formación de todos los compuestos químicos están tabulados, y con estos datos se puede calcular el cambio de entalpía estándar de cualquier reacción: DHºR DH°R = (la suma de los DH°F de los productos) (la suma de los DH°F de los reaccionantes)

Ejemplo: 1. Calcular la variación de entalpia(∆H) que se produce en la reacción de transformación del diamante en grafito: C(diamante)→ C(grafito) (1) C(diamante) +O 2(g)→CO 2(g) (2) C(grafito) +O 2(g) →CO 2(g) ∆H=-395. 4 KJ/mol ∆H=-393. 5 KJ/mol (1)C(diamante) +O 2(g)→CO 2(g) (3) CO 2(g) → C(grafito) +O 2(g) ∆H=-395. 4 KJ/mol ∆H=+393. 5 KJ/mol C(diamante) → C(grafito) ∆H=-1. 9 KJ/mol

2. Calcular ∆Hf para la formación de la acetona (CH 3 COCH 3)según la reacción: 3 C(s)+3 H 2(g)+1/2 O 2 (g)→ CH 3 COCH 3(l), conociendo los valores de calor de combustión: (1) H 2(g) +1/2 O 2→ H 2 O(l) ∆H=-285. 8 KJ/mol /x 3 (2) C (S) + O 2→ CO 2 (l) ∆H=-393. 5 KJ/mol /x 3 (3) CH 3 COCH 3(l) +4 O 2→ 3 CO 2(g)+ 3 H 2 O(l) ∆H=-1. 786 KJ/mol (1) H 2(g) +3/2 O 2→ 3 H 2 O(l) (2) 3 C (S) + 3 O 2→ 3 CO 2 (l) (3) 3 CO 2(g)+ 3 H 2 O(l) → CH 3 COCH 3(l) +4 O 2 3 H 2(g)+3 C(s)+ 1/2 O 2→ CH 3 COCH 3(l) ∆H=-857. 4 KJ/mol ∆H=-1. 180, 5 KJ/mol ∆H= +1. 786 KJ/mol ∆H= -251. 9 KJ/mol
 Que diferencia hay entre filosofia y ciencia
Que diferencia hay entre filosofia y ciencia Enzimas introducción
Enzimas introducción Introduccin
Introduccin Introduccin
Introduccin Introduccin
Introduccin Induccin
Induccin Priscilla and the wimps theme
Priscilla and the wimps theme Early christian art characteristics
Early christian art characteristics Edh cern
Edh cern Priscilla salovaara
Priscilla salovaara Matthew arnold md
Matthew arnold md Priscilla abdelazim
Priscilla abdelazim Acecite
Acecite Priscilla kankam
Priscilla kankam Aquila and priscilla
Aquila and priscilla Priscilla and the wimps summary
Priscilla and the wimps summary Hyperbole in priscilla and the wimps
Hyperbole in priscilla and the wimps Priscilla meet felicity
Priscilla meet felicity Priscilla white classification
Priscilla white classification Priscilla white classification
Priscilla white classification Priscilla marinho valavicius
Priscilla marinho valavicius Hhloans deferment
Hhloans deferment Hematoma epidural arteria
Hematoma epidural arteria Clasificación de priscilla white
Clasificación de priscilla white Priscilla taylor md
Priscilla taylor md Colegio san miguel gijon
Colegio san miguel gijon Iglesia san vicente barakaldo
Iglesia san vicente barakaldo San francisco de asis temuco
San francisco de asis temuco



















































