MODELO DE ALINEAMIENTO ESTRATGICO PARA EL PERODO 2013













- Slides: 29

MODELO DE ALINEAMIENTO ESTRATÉGICO PARA EL PERÍODO 2013 -2015 DEL AREA DE VALIDACIONES DE UN LABORATORIO FARMACÉUTICO

ESTRUCTURA DE LA PRESENTACIÓN • • • • Descripción de la empresa y del proceso en estudio Planteamiento del problema Objetivo general del proyecto Objetivos específicos Metodología Resultados del análisis externo e interno Objetivos corporativos para Operaciones Objetivos de Validación que impactan en los objetivos corporativos Alineamiento con filosofía corporativa y objetivos organizacionales Matriz estratégica y priorización de estrategias Planes de acción Plan de implementación. Cuadro de Mando. Conclusiones y recomendaciones

DESCRIPCIÓN DE LA EMPRESA • Es un laboratorio farmacéutico de capital nacional, con más de 70 años de actividad en el Ecuador. • Productos: salud humana, veterinarios y de consumo, fabricación a terceros. • Fabricación de: comprimidos, cápsulas, soluciones inyectables, jarabes, soluciones, suspensiones, polvos, antibióticos, vacunas, toxoides, plaguicidas. • Importados: antivirales, biotecnológicos y oncológicos. • En el área de Validaciones: posee un Comité de Validación. Realiza Validación de sistemas, procesos y calificación de equipos.

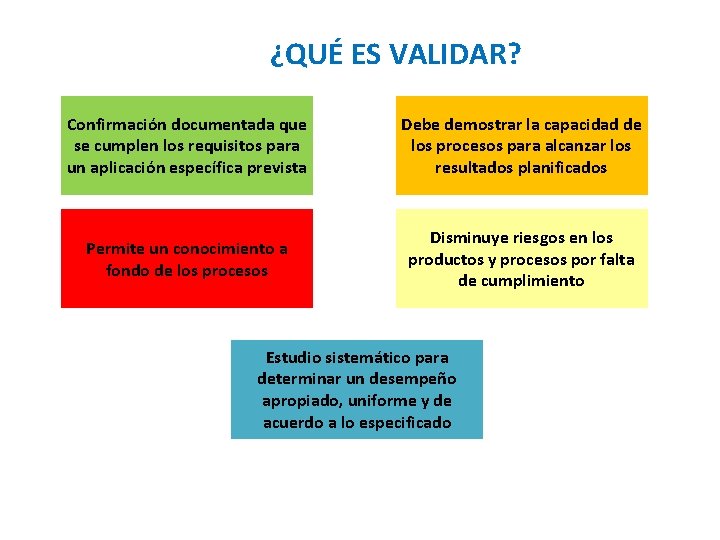
¿QUÉ ES VALIDAR? Confirmación documentada que se cumplen los requisitos para un aplicación específica prevista Debe demostrar la capacidad de los procesos para alcanzar los resultados planificados Permite un conocimiento a fondo de los procesos Disminuye riesgos en los productos y procesos por falta de cumplimiento Estudio sistemático para determinar un desempeño apropiado, uniforme y de acuerdo a lo especificado

PLANTEAMIENTO DEL PROBLEMA Insuficiente sincronización de los esfuerzos de validación entre todos los departamentos responsables Interés de otros departamentos por la Validación está en segundo plano, no hay coordinación con Planificación de la Producción Actividades de validación no se realizan dentro del tiempo previsto, se dilata su cumplimiento y demanda sobreesfuerzo de I+D La Validación es requerimiento de la BPM, su incumplimiento puede acarrear la no certificación y no otorgamiento de permiso de funcionamiento Riesgo de tener procesos fuera de control luego afectación a la calidad de los productos y su uso seguro Riesgo de retiro de mercado, afectación de imagen corporativa, incumplimiento de estándares internacionales y ruptura de contratos de fabricación

OBJETIVO GENERAL Diseñar un modelo de alineamiento estratégico para el área de Validaciones de un laboratorio farmacéutico

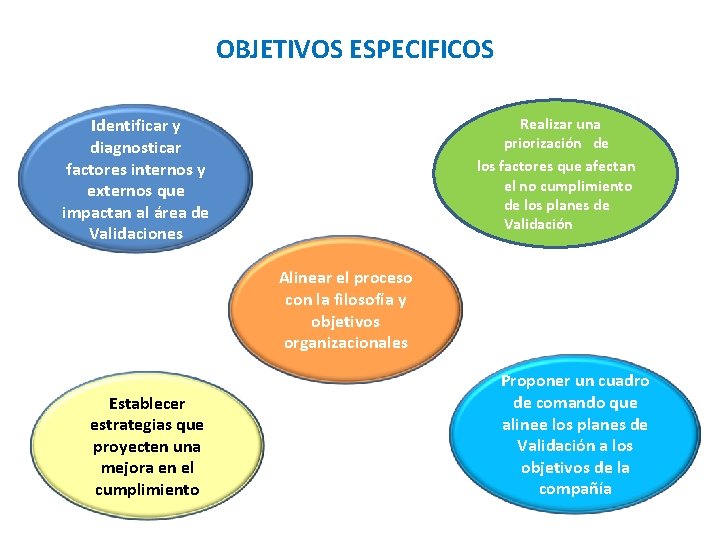
OBJETIVOS ESPECIFICOS Realizar una priorización de los factores que afectan el no cumplimiento de los planes de Validación Identificar y diagnosticar factores internos y externos que impactan al área de Validaciones Alinear el proceso con la filosofía y objetivos organizacionales Establecer estrategias que proyecten una mejora en el cumplimiento Proponer un cuadro de comando que alinee los planes de Validación a los objetivos de la compañía

METODOLOGÍA q Identificación de los procesos que por su importancia e impacto sobre la calidad de los productos deben ser validados q Definición del tipo de validaciones requeridas en los procesos q Realización de un análisis situacional de la compañía respecto a la Validación q Realización de un análisis estratégico que defina y priorice estrategias a ser incorporadas en planes de acción. Estas estrategias deben alinearse hacia los objetivos corporativos q Establecimiento de un modelo de cuadro de mando integral que sincronice las actividades de Validación y plan de implementación

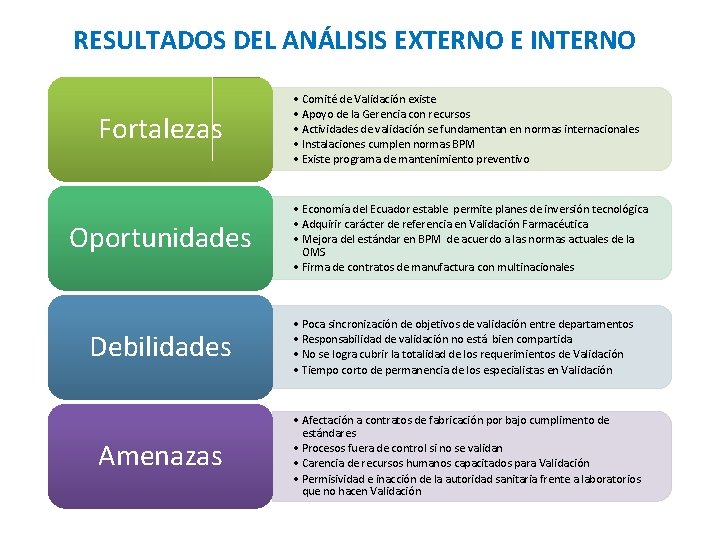
RESULTADOS DEL ANÁLISIS EXTERNO E INTERNO Fortalezas Oportunidades • Comité de Validación existe • Apoyo de la Gerencia con recursos • Actividades de validación se fundamentan en normas internacionales • Instalaciones cumplen normas BPM • Existe programa de mantenimiento preventivo • Economía del Ecuador estable permite planes de inversión tecnológica • Adquirir carácter de referencia en Validación Farmacéutica • Mejora del estándar en BPM de acuerdo a las normas actuales de la OMS • Firma de contratos de manufactura con multinacionales Debilidades • Poca sincronización de objetivos de validación entre departamentos • Responsabilidad de validación no está bien compartida • No se logra cubrir la totalidad de los requerimientos de Validación • Tiempo corto de permanencia de los especialistas en Validación Amenazas • Afectación a contratos de fabricación por bajo cumplimento de estándares • Procesos fuera de control si no se validan • Carencia de recursos humanos capacitados para Validación • Permisividad e inacción de la autoridad sanitaria frente a laboratorios que no hacen Validación

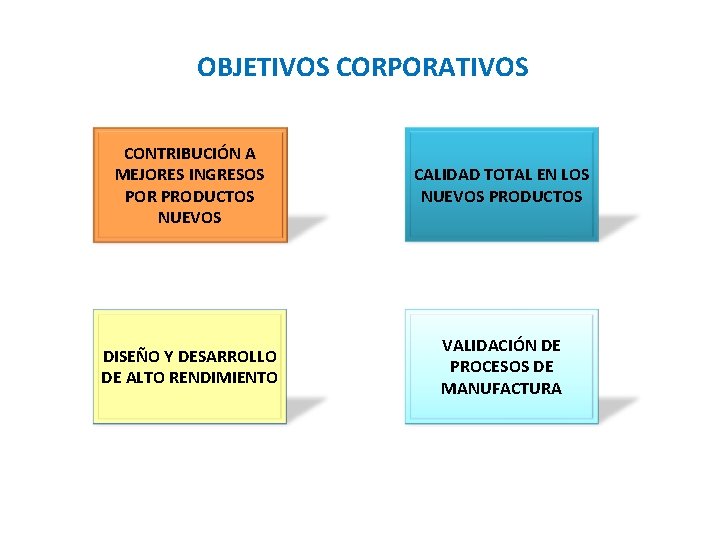
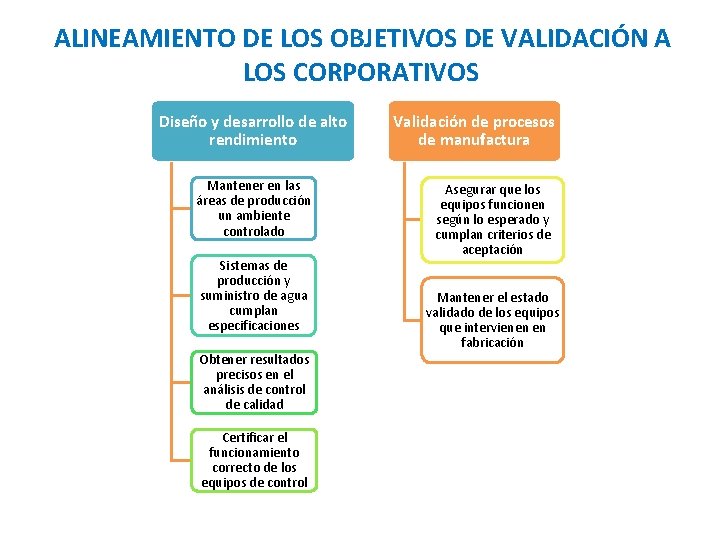
OBJETIVOS CORPORATIVOS CONTRIBUCIÓN A MEJORES INGRESOS POR PRODUCTOS NUEVOS CALIDAD TOTAL EN LOS NUEVOS PRODUCTOS DISEÑO Y DESARROLLO DE ALTO RENDIMIENTO VALIDACIÓN DE PROCESOS DE MANUFACTURA

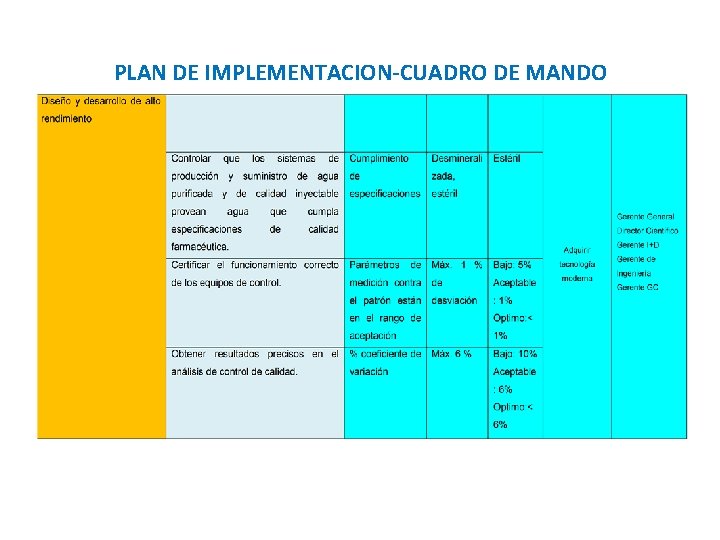
OBJETIVOS DE VALIDACIÓN QUE IMPACTAN EN LOS CORPORATIVOS Sistemas de apoyo crítico • Mantener en las áreas de producción un ambiente controlado • Sistemas de producción y suministro de agua cumplan especificaciones Sistemas computacionales ERP • Asegurar la confiabilidad del sistema que controla automatización de Producción, Calidad, Costos e inventarios y comercialización Procesos de Fabricación • Asegurar ejecución precisa de instrucciones de fabricación para cumplimiento de especificaciones de proceso y producto

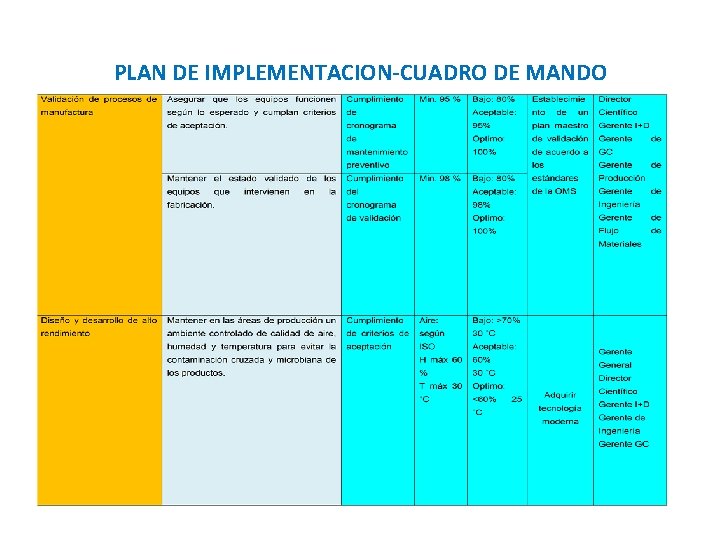
OBJETIVOS DE VALIDACIÓN QUE IMPACTAN EN LOS CORPORATIVOS Temperatura cinética media Equipos de fabricación • Asegurar que los equipos funcionen según lo esperado y cumplan criterios de aceptación • Mantener el estado validado de los equipos que intervienen en fabricación Equipos de control de procesos • Certificar el funcionamiento correcto de los equipos de control • Obtener resultados precisos en el análisis de control de calidad • Determinar que la temperatura promedio de almacenamiento de los productos se encuentre dentro de especificaciones para garantizar su estabilidad • Salvaguardar que el transporte en la cadena de suministro del producto cumpla con los requerimientos

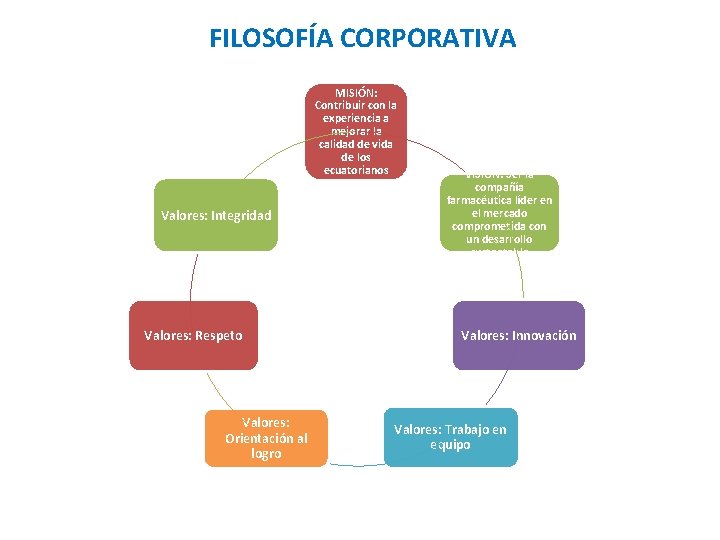
FILOSOFÍA CORPORATIVA MISIÓN: Contribuir con la experiencia a mejorar la calidad de vida de los ecuatorianos Valores: Integridad Valores: Respeto Valores: Orientación al logro VISIÓN: Ser la compañía farmacéutica líder en el mercado comprometida con un desarrollo sustentable Valores: Innovación Valores: Trabajo en equipo

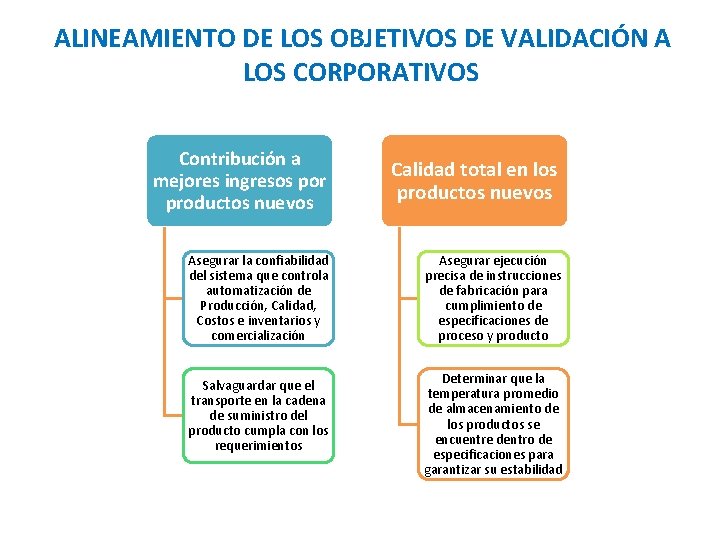
ALINEAMIENTO DE LOS OBJETIVOS DE VALIDACIÓN A LOS CORPORATIVOS Contribución a mejores ingresos por productos nuevos Calidad total en los productos nuevos Asegurar la confiabilidad del sistema que controla automatización de Producción, Calidad, Costos e inventarios y comercialización Asegurar ejecución precisa de instrucciones de fabricación para cumplimiento de especificaciones de proceso y producto Salvaguardar que el transporte en la cadena de suministro del producto cumpla con los requerimientos Determinar que la temperatura promedio de almacenamiento de los productos se encuentre dentro de especificaciones para garantizar su estabilidad

ALINEAMIENTO DE LOS OBJETIVOS DE VALIDACIÓN A LOS CORPORATIVOS Diseño y desarrollo de alto rendimiento Mantener en las áreas de producción un ambiente controlado Sistemas de producción y suministro de agua cumplan especificaciones Obtener resultados precisos en el análisis de control de calidad Certificar el funcionamiento correcto de los equipos de control Validación de procesos de manufactura Asegurar que los equipos funcionen según lo esperado y cumplan criterios de aceptación Mantener el estado validado de los equipos que intervienen en fabricación

MATRIZ ESTRATÉGICA DERIVADA DEL ANALISIS FODA

MATRIZ ESTRATÉGICA DERIVADA DEL ANALISIS FODA AMENAZAS FA DA de F 3 A 4: Solicitar auditorías de mejora en D 1 A 7: Establecer reuniones semanales con fabricación bajo licencia por bajo validación a las multinacionales que otorgan Producción, Ingeniería y Garantía de Calidad cumplimiento de los estándares de licencia de fabricación. para multinacionales. F 1 A 7: Seguimiento exhaustivo de la validación. A 7. Procesos fuera de control si no se por el Comité de Validación. D 5 A 7: Establecer con Planificación de la validan. F 2 A 5: Contratación de más profesionales en Producción A 5. Carencia de recursos humanos carreras afines para capacitarles en validación. necesarios para ejecutar las validaciones. capacitados en validación. F 2 A 9: Realizar contactos técnicos, reuniones A 9. Permisividad e inacción de la de trabajo y seguimiento con las máximas autoridad sanitaria frente a laboratorios autoridades del Ministerio de Salud para que A 4. Afectación a contratos que no tienen programas de validación. se fortalezcan las auditorías en BPM. seguimiento la del cronograma asignación de de tiempos

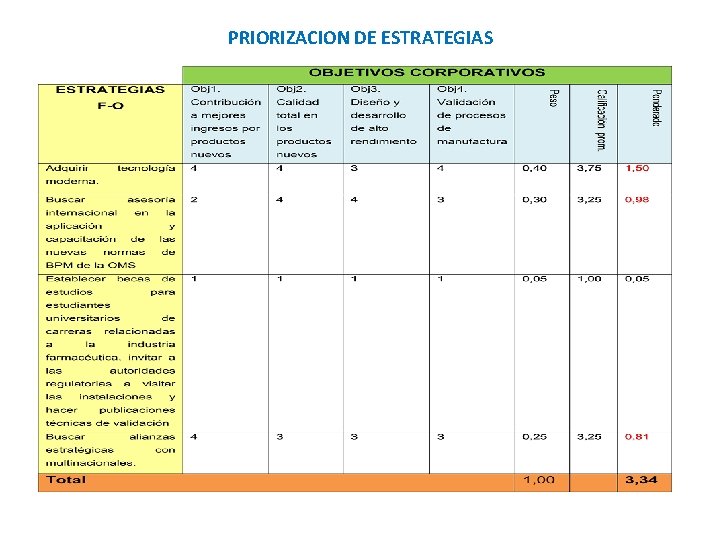
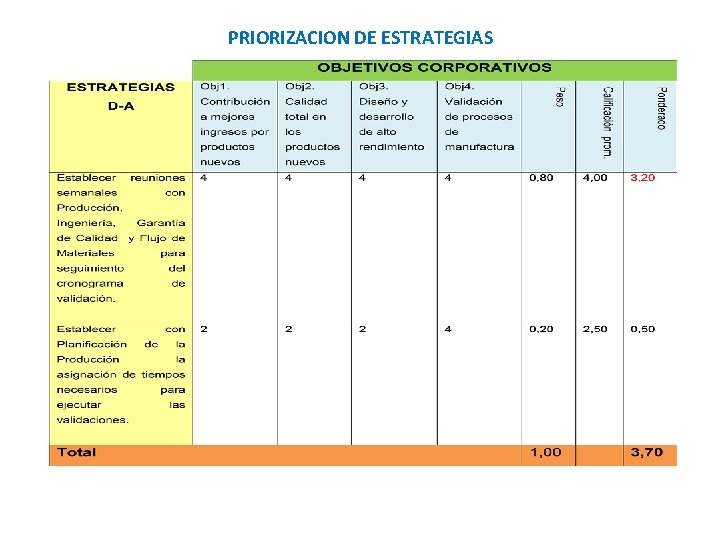
PRIORIZACION DE ESTRATEGIAS

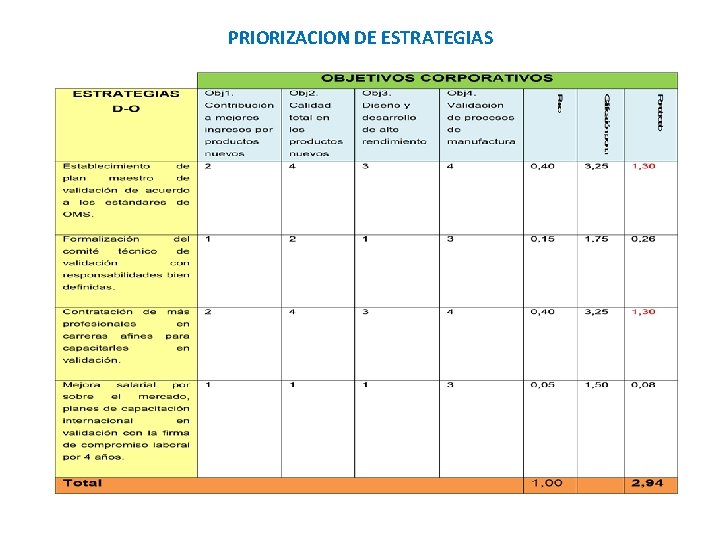
PRIORIZACION DE ESTRATEGIAS

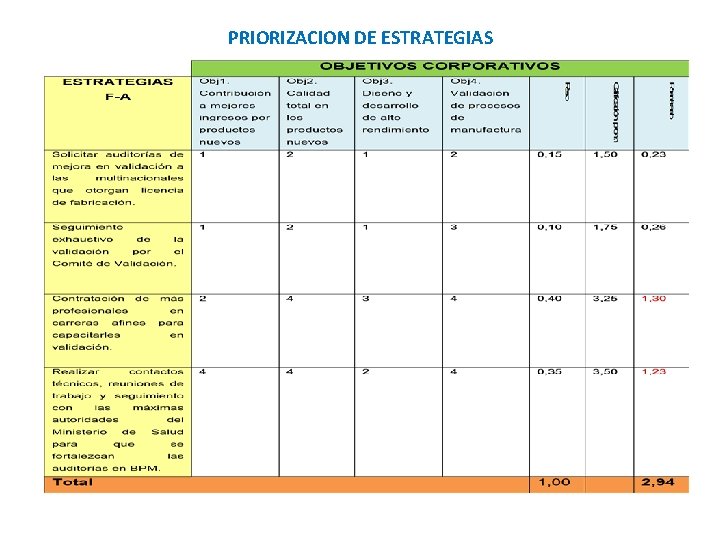
PRIORIZACION DE ESTRATEGIAS

PRIORIZACION DE ESTRATEGIAS

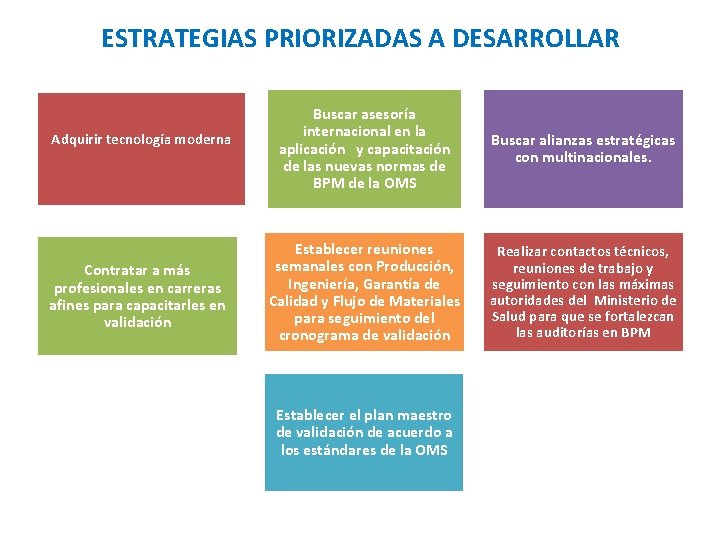
ESTRATEGIAS PRIORIZADAS A DESARROLLAR Adquirir tecnología moderna Contratar a más profesionales en carreras afines para capacitarles en validación Buscar asesoría internacional en la aplicación y capacitación de las nuevas normas de BPM de la OMS Buscar alianzas estratégicas con multinacionales. Establecer reuniones semanales con Producción, Ingeniería, Garantía de Calidad y Flujo de Materiales para seguimiento del cronograma de validación Realizar contactos técnicos, reuniones de trabajo y seguimiento con las máximas autoridades del Ministerio de Salud para que se fortalezcan las auditorías en BPM Establecer el plan maestro de validación de acuerdo a los estándares de la OMS

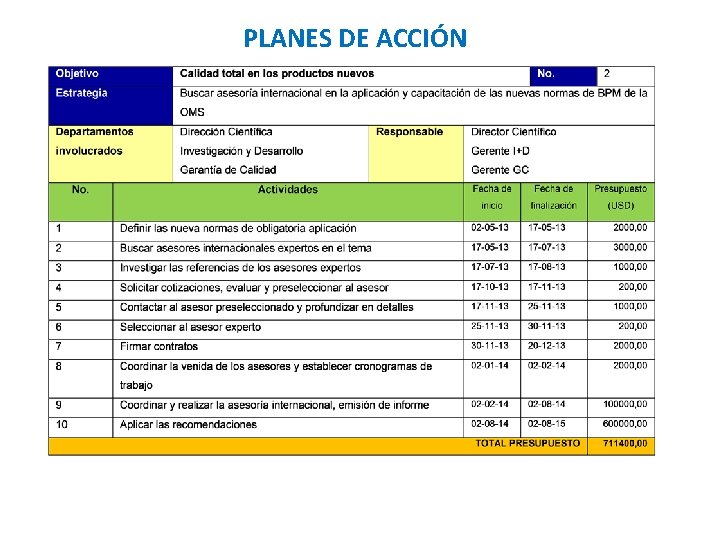
PLANES DE ACCIÓN

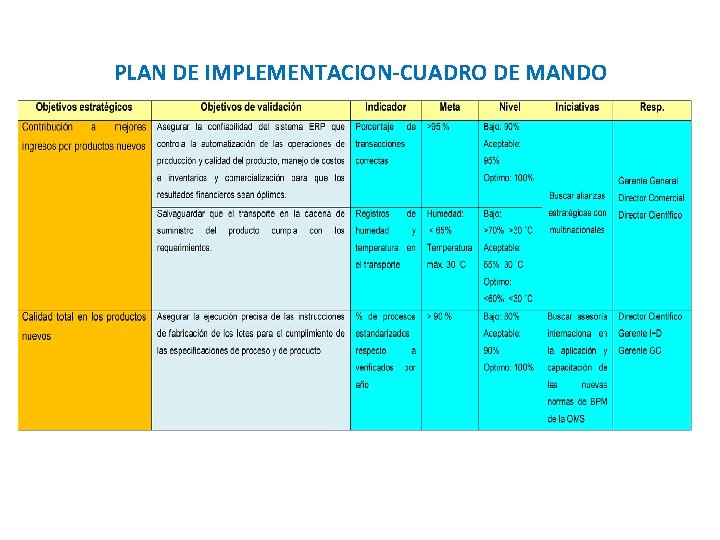
PLAN DE IMPLEMENTACION-CUADRO DE MANDO

PLAN DE IMPLEMENTACION-CUADRO DE MANDO

PLAN DE IMPLEMENTACION-CUADRO DE MANDO

CONCLUSIONES ü La validación es en requerimiento fundamental en la industria farmacéutica puesto que es parte componente de la calidad de un medicamento. ü El proceso actual de validación no está controlado y no se cumple en los niveles requeridos, encontrándose en un nivel de cumplimiento del 80 %. ü La validación en la empresa está a exclusivamente bajo la responsabilidad del departamento de Investigación y Desarrollo y no funciona en forma sincronizada con los otros departamentos que deben intervenir. Las responsabilidades funcionales no están especificadas. ü La validación no es parte de los objetivos departamentales de las áreas distintas al departamento de Investigación y Desarrollo y no está alineada con los objetivos corporativos. ü El incumplimiento en la ejecución de la validación tiene riesgos potenciales muy altos, puesto que se pueden afectar los atributos de calidad de los productos al tener procesos fuera de control y sistemas de apoyo crítico que no eviten la contaminación cruzada y microbiana. ü La ejecución incompleta de la validación es causal de impedimento en el otorgamiento del certificado de Buenas Prácticas de Manufactura que confiere la autoridad de salud del Ecuador, el mismo que es un requerimiento para poder obtener el permiso de funcionamiento de los laboratorios farmacéuticos.

CONCLUSIONES ü El no otorgamiento del permiso de funcionamiento implica la suspensión de operaciones de manufactura, consecuentemente se vería afectada la rentabilidad y la supervivencia de la empresa. ü En el Ecuador existen laboratorios que no tienen en su estructura organizacional el área de validación, es decir que contravienen el cumplimiento del estándar 32 de la Organización Mundial de la Salud para las Buenas Prácticas de Manufactura; en consecuencia se transforman en competencia desleal ya que la calidad de lo que producen no está garantizada. ü La inversión en tecnologías de medición para la validación es muy alta y por tanto es limitada a las pruebas de cumplimiento obligatorio y no las complementarias. ü En la industria farmacéutica es requerimiento la actualización permanente en el uso de normativas en BPM de la Organización Mundial de la Salud.

RECOMENDACIONES • Se debe buscar la aplicación de los estándares modernos de Buenas Prácticas de Manufactura que son establecidos por el comité de expertos de la Organización Mundial de la Salud. • Se deben establecer cronogramas de estudio e implementación de los nuevos requerimientos ya que de esta manera se fortalece la capacidad competitiva de la empresa, al tener mejores estándares dentro de su sistema de calidad. • Se recomienda buscar y establecer alianzas estratégicas con empresas multinacionales fuertes que tiene muy avanzado su know how en validación. • La planeación de los proyectos de inversión en tecnología farmacéutica debe hacerse para tres años a fin de mantener bajo control la mejora en equipamientos y sistemas nuevos y mejorados. • Los cambios relacionados a la validación deben ser conocidos, evaluados y aprobados por las gerencias de I+D, Garantía de Calidad, Producción, Ingeniería y Dirección Científica. • Se recomienda establecer el plan de mejora continua de validación para el trienio 2013 -2015 a fin de que se puedan planificar, ejecutar y evaluar los cambios.
 Perodo
Perodo Lic
Lic Carta circular de planificacion
Carta circular de planificacion Buscar x imagenes
Buscar x imagenes Interliteral
Interliteral Plantilla de mapa curricular basado en estándares
Plantilla de mapa curricular basado en estándares Poder de alineamiento
Poder de alineamiento Alineamiento clustalw
Alineamiento clustalw Matriz de alineamiento
Matriz de alineamiento Blast alineamiento de secuencias
Blast alineamiento de secuencias Modelo bidimensional para evaluar el riesgo para la salud
Modelo bidimensional para evaluar el riesgo para la salud Mealy y moore
Mealy y moore Capas de la tierra
Capas de la tierra Creador del modelo atomico actual
Creador del modelo atomico actual Modelo oriental habilidades directivas
Modelo oriental habilidades directivas Modelo nacional para la calidad total
Modelo nacional para la calidad total Modelo de abordaje de promocion de la salud
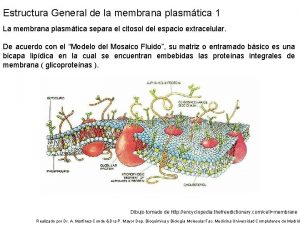
Modelo de abordaje de promocion de la salud Modelo de mosaico fluido para dibujar
Modelo de mosaico fluido para dibujar Modelo rice aptus
Modelo rice aptus Modelo kap educacion para la salud
Modelo kap educacion para la salud Modelo clasico o tradicional para el diseño de puestos
Modelo clasico o tradicional para el diseño de puestos Formato de inspección de epp sura
Formato de inspección de epp sura Modelo educativo para la educacion obligatoria
Modelo educativo para la educacion obligatoria Kse 2013
Kse 2013 Lembar pengesahan dokumen 1 kurikulum 2013
Lembar pengesahan dokumen 1 kurikulum 2013 Access 2013 tutorial
Access 2013 tutorial Quran in word 2013
Quran in word 2013 Brs 2013
Brs 2013 2013 apes frq
2013 apes frq Iso 690:2013
Iso 690:2013