Mezclas Una mezcla est formada por la unin





















- Slides: 22

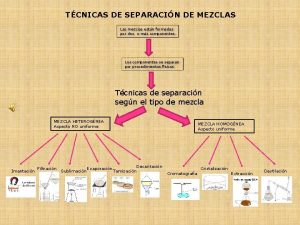
Mezclas Una mezcla está formada por la unión de sustancias en cantidades variables y que no se encuentran químicamente combinadas. Por lo tanto, una mezcla no tiene un conjunto de propiedades únicas, sino que cada una de las sustancias constituyentes aporta al todo con sus propiedades específicas.

Mezclas homogéneas Las mezclas homogéneas son aquellas cuyos componentes no son identificables a simple vista, es decir, se aprecia una sola fase física (monofásicas). Ejemplo: aire, agua potable.

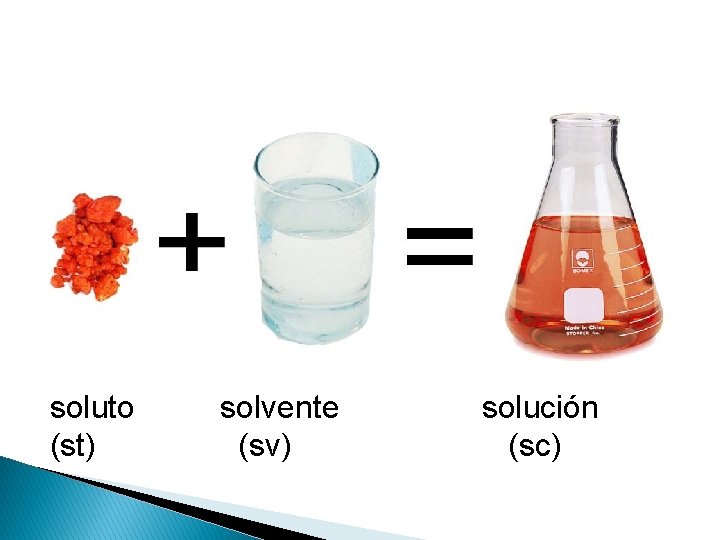
Soluciones Químicas �Son mezclas homogéneas (una fase) que contienen dos o más tipos de sustancias denominadas soluto y solvente; que se mezclan en proporciones variables; sin cambio alguno en su composición, es decir no existe reacción química. Soluto + Solvente → Solución

soluto (st) solvente (sv) solución (sc)

El soluto es un líquido y el solvente también es un líquido SOLUCIÓN LÍQUIDA, Cuando: Ejemplo: alcohol disuelto en agua El soluto es un sólido y el solvente es un líquido Ejemplo: azúcar en agua. El soluto es un gas y el solvente es un líquido. Ejemplo: dióxido de carbono (CO 2) disuelto en agua (refresco)

El soluto es un sólido y el solvente también es un sólido. Ejemplo: (Bronce) zinc en cobre SOLUCION SÓLIDA, Cuando: El soluto es un líquido y el solvente es un sólido Ejemplo: amalgama de mercurio disuelto en plata (se usa en dentadura) El soluto es un gas y el solvente es un sólido

El soluto es un sólido y el solvente es un gas. Ejemplo: vapor de yodo en aire SOLUCION GASEOSA, Cuando: El soluto es un líquido y el solvente es un gas. Ejemplo: agua en aire El soluto es un gas y el solvente también es un gas. Ejemplo: la solución de oxígeno y otros gases en nitrógeno (constituyen el aire)

Soluto Es la sustancia que se disuelve, dispersa o solubiliza y siempre se encuentra en menor proporción, ya sea en peso o volumen. A la naturaleza del soluto se deben el color, el sabor y la conductividad eléctrica de las soluciones. El soluto da el nombre a la solución.

Solvente o disolvente � Es la sustancia que disuelve o dispersa al soluto y generalmente se encuentra en mayor proporción. � Existen solventes polares (agua, alcohol etílico y amoníaco) y no polares (benceno, éter, tetracloruro de carbono). � En las soluciones líquidas se toma como solvente universal al agua debido a su alta polaridad. � El solvente da el aspecto físico de la solución.

CONCENTRACIÓN DE UNA SOLUCIÓN La relación entre la cantidad de sustancia disuelta (soluto) y la cantidad de disolvente se conoce como concentración. Esta relación se expresa cuantitativamente en forma de unidades físicas y unidades químicas, debiendo considerarse la densidad y el peso molecular del soluto.

Hablar de solución diluida o concentrada, resulta muy inexacto. Por eso existen formas de determinar cuantitativamente las concentraciones de las soluciones. Existen dos tipos de unidades: - Unidades físicas - Unidades químicas

Concentración en Unidades Físicas Porcentaje masa en masa (% m/m o % p/p): Indica la masa de soluto en gramos, presente en 100 gramos de solución. Xg soluto → 100 g solución � Ej: Una solución de azúcar en agua, contiene 20 g de azúcar en 70 g de solvente. Expresar la solución en % p/p. soluto + solvente → solución 20 g 70 g 90 g 20 g azúcar → 90 g solución Xg azúcar → 100 g solución X = 20 * 100 = 22, 22 p/p 90

Porcentaje masa en volumen (% m/v o % p/v) Indica la masa de soluto en gramos disuelto en 100 m. L de solución. Xg soluto → 100 ml solución Ej: Una solución salina contiene 30 g de Na. Cl en 80 m. L de solución. Calcular su concentración en % p/v. 30 g Na. Cl → 80 ml solución Xg Na. Cl → 100 ml solución X = 30 * 100 = 37, 5 %p/v 80

Porcentaje en volumen (% v/v) Indica el volumen de soluto, en m. L, presente en 100 m. L de solución. X ml soluto → 100 ml solución Ej: Calcular la concentración en volumen de una solución alcohólica, que contiene 15 m. L de alcohol disueltos en 65 m. L de solución. 15 ml alcohol X ml alcohol → → 65 ml solución 100 ml solución X = 15 * 100 = 65 23 %v/v

Concentración común (g/L) � Indica la masa de soluto en gramos, presente en un litro de solución (recordar que 1 L = 1000 m. L, por lo que es lo mismo decir mg/m. L). Xg soluto → 1 L o 1000 m. L solución EJ: Una solución de KCl contiene 10 g de sal en 80 m. L de solución. Calcular su concentración en gramos por litro. 10 g KCl Xg KCl → → 80 m. L solución 1000 m. L solución X = 10 * 1000 = 80 125 g/L

Partes por millón (ppm) Se define como los miligramos de soluto disueltos en 1000 ml o 1 litro de solución. Nota 1 g = 1000 mg X mg soluto → 1000 ml solución � EJ: Calcular la concentración en ppm de una solución que contiene 0, 85 g de KNO 3 disueltos en 670 m. L de solución. En primer lugar se debe transformar los gramos a miligramos, según la relación de arriba. 1 g → 1000 mg 0, 85 g → X mg X = 850 mg Teniendo los miligramos calculados, es posible realizar la regla de tres: 850 mg KNO 3 → 670 m. L solución X mg KNO 3 → 1000 m. L solución X = 1268, 65 ppm

CONCENTRACIÓN EN UNIDADES QUÍMICAS Molaridad (M): Indica el número de moles de soluto disuelto hasta formar un litro de solución. X mol → 1 L o 1000 ml solución M = mol de soluto V (L) solución

Ejemplo Calcular la concentración molar de una solución disolviendo 7, 2 moles de HCl en 7 litros de solución. Resolución 1: 7, 2 mo. L → 7 L X mo. L → 1 L X= 1, 02 mo. L Resolución 2 M = 7, 2 moles KCl 7 L M = 1, 02 mo. L/L

EJERCICIO 1 Explica con detalle cómo prepararías 250 cm 3 de una solución de cloruro de sodio de composición en masa 20 g/l. # Vamos a calcular, en primer lugar, la masa de soluto que se necesita; para ello, despeja la masa de soluto en la expresión de la concentración en masa. # Calcula la masa de soluto (cloruro de sodio). # Describe el procedimiento que seguirías para prepara la citada disolución, incluyendo los aparatos utilizados. 1. Se pesan 5 g de cloruro de sodio en una balanza. 2. Se añade agua al recipiente que contiene el cloruro de sodio y se agita hasta que se disuelva. 3. Se vierte esta disolución en un matraz aforado de 250 cm 3. 4. Se añade agua al matraz hasta el enrase.

EJERCICIO 2 Se disuelven 8 g de hidróxido de sodio en agua y se obtienen 200 cm 3 de solución. (a) Calcula la concentración en masa de la solución. (b) Calcula el volumen de una solución de la misma concentración en masa que contiene 100 g de hidróxido de sodio. # Escribir la expresión de la concentración en masa en función de la masa de soluto y el volumen de disolución # Hallar el volumen de la solución en litros o su equivalente dm 3. # Calcula la concentración en masa de la disolución. # Despeja el volumen de solución en la expresión de la concentración en masa. # Calcula el volumen de solución que contiene los 100 g de hidróxido de sodio. V = 200 cm 3 = 0, 200 l

EJERCICIO 3 Se disuelven 50 g de azúcar en agua hasta obtener 2 litros de disolución. (a) Calcula la concentración en masa (g/l) de la disolución obtenida. (b) ¿Qué volumen de esta disolución hemos de tomar para que contenga 5 g de azúcar? # Escribe la expresión de la concentración en masa, en función de la masa de soluto y el volumen de solución # Calcula la concentración en masa de la disolución de azúcar. # Despeja el volumen de disolución en la expresión de la concentración en masa. # Calcula el volumen de disolución que contiene los 5 g de azúcar.

Esta dada por la proporción de soluto en la solución. Por la abundancia relativa del soluto en las soluciones, estas pueden ser: a). - Diluida: cuando proporcionalmente tienen poco soluto b). -Concentrada: cuando proporcionalmente tienen abundante soluto c). - Saturadas: cuando la abundancia de soluto es tal que el solvente ya no es capaz de disolver mas soluto. d). - Sobre Saturada: cuando tiene mas soluto que su punto de saturación, la sobre saturación se logra mediante procedimientos especiales como por ejemplo calentar la solución.
 Baile es diptongo o hiato
Baile es diptongo o hiato Una mesa presidencial esta formada por 8 personas
Una mesa presidencial esta formada por 8 personas Cara lateral curva
Cara lateral curva Las lentejas es una sustancia pura o una mezcla
Las lentejas es una sustancia pura o una mezcla Una tuberia contiene una mezcla de he y n2
Una tuberia contiene una mezcla de he y n2 Fenomeno quimico
Fenomeno quimico Entidad esférica formada por un núcleo y corteza
Entidad esférica formada por un núcleo y corteza Proceso de segmentacion
Proceso de segmentacion Rayos proximos al eje
Rayos proximos al eje Barrera hematogaseosa funcion
Barrera hematogaseosa funcion Es la abertura
Es la abertura Sistema nervioso eferente y aferente
Sistema nervioso eferente y aferente Terreno muito íngreme de 100 a 800 metros de altitude
Terreno muito íngreme de 100 a 800 metros de altitude Tres personas compraron un boleto de loteria en 60 pesos
Tres personas compraron un boleto de loteria en 60 pesos Mezcla de la mayonesa
Mezcla de la mayonesa Qué es una mezcla
Qué es una mezcla Decantacion de liquidos
Decantacion de liquidos El pan de pascua es una mezcla homogenea o heterogenea
El pan de pascua es una mezcla homogenea o heterogenea Mezcla homogenea clasificacion
Mezcla homogenea clasificacion Juan tiene una mezcla homogenea de sal y agua
Juan tiene una mezcla homogenea de sal y agua Imagenes de una mezcla
Imagenes de una mezcla Unin
Unin Unin merlin
Unin merlin