DISOLUCIONES DISOLUCION Mezcla homognea formada por dos o














- Slides: 15

DISOLUCIONES

DISOLUCION �Mezcla homogénea formada por dos o más compuestos que no reaccionan entre si. �Al compuesto que se encuentra en mayor proporción se le denomina SOLVENTE. �Al compuesto o compuestos que se encuentran en menor proporción se les denomina SOLUTOS.

Algunos factores que influyen en la formación de las disoluciones son: �Efecto temperatura-presión �Naturaleza del soluto y del solvente �El tamaño de partícula �El calor de disolución o entalpía de disolución

EFECTO DE LA TEMPERATURA Y PRESIÓN �La solubilidad de una sustancia es la máxima cantidad de ella que se puede disolver en una cantidad de solvente a una presión y temperatura determinada. �Generalmente la solubilidad de los sólidos en líquidos aumenta con la temperatura, existiendo algunas excepciones a esta regla.

La solubilidad del gas aumenta con la presión y la baja temperatura.

EFECTO DE LA TEMPERATURA Y PRESION �En lo referente a los gases, estos normalmente disminuyen su solubilidad en los líquidos a medida que se eleva la temperatura. �Con respecto a la presión, esta influye muy poco cuando el soluto es un sólido o un liquido, no así en los gases cuya propiedad de solubilizarse en un liquido se incrementa con la presión.

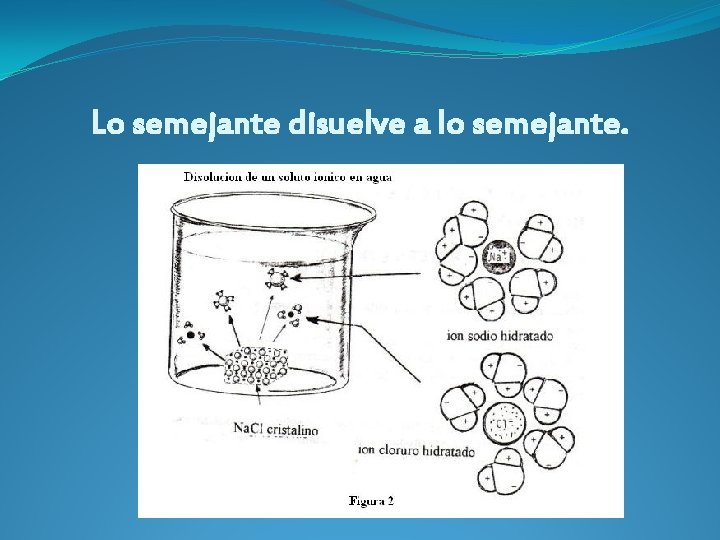
NATURALEZA DEL SOLUTO Y SOLVENTE �El agua es u solvente ampliamente utilizado, tanto por su propiedad polar, como también por su carácter inerte frente a muchos solutos. �Por esta propiedad, el agua con facilidad disuelve a solutos polares y iónicos. Tratándose de solutos iónicos como el cloruro de sodio, los dipolos de la molécula de agua atraen electrostática a iones del compuesto.

�Los cationes sodio (Na+ ) quedan rodeados por moléculas de agua cuyos extremos negativos se orientan hacia ellos. �Los aniones cloruro(Cl- ) se rodean también por moléculas de agua, con los extremos positivos orientados también hacia ellos. �Cuando esto sucede se ha formado un hidrato y se dice que ha ocurrido una hidratación. Para el caso general de un solvente que no sea el agua, se llama una solvatación.

�En las soluciones iónicas, las partículas se mueven libremente en el seno del agua y por ello tienen la propiedad de conducir la corriente eléctrica. �Por el contrario para solutos moleculares, es decir aquellos que no se descomponen en iones, sino que se conservan como moléculas, el soluto se hidrata como molécula, sin romperse en iones. � Como ejemplo tenemos el azúcar disuelto en agua.

�En general el agua disuelve a compuestos con cargas eléctricas, debido a la fuerte atracción existente entre los iones o moléculas polares con el dipolo del agua. �Compuestos no polares como la gasolina, éter, hexano, benceno, etc. , no pueden disolver a sustancias iónicas o polares, pero si a grasas y aceites que son de naturaleza no polar.

Lo semejante disuelve a lo semejante.

Grado de pulverización de los reactivos �La pulverización, es decir, la reducción a partículas de menor tamaño, proporciona una superficie específica mayor, dando como resultado una mayor velocidad de disolución, ya que facilita el contacto entre el soluto y el solvente y, por tanto, la colisión entre las partículas.

Calor de disolución �Es la variación de entalpia (propiedad termodinámica que mide el calor que absorbe o pierde la materia), relacionada con la adición de una cantidad determinada de soluto a una cantidad determinada de solvente a temperatura y presión constantes. �El proceso de disolución del Cloruro de Sodio en agua requiere energía, ya que deben separarse el Na+ y el Cl - que se encuentran unidos por fuerzas electrostáticas en el cristal y posteriormente solvatarse en el solvente quedando al estado de iones en la solución.


Calor de disolución �El balance energético de estos procesos puede dar un resultado positivo o negativo, es decir, en algunos casos se requiere energía, como calor, para disolver un sólido y en otros casos se desprende energía, también en forma de calor. �En el caso particular de una disolución, el calor desprendido o absorbido se llama “Calor de Disolución”, o mejor “Entalpía de Solución”, D Hsoln. �El proceso de disolución del Na Cl en agua, se puede representar por: �Na Cl (s) —H 2 O→ Na+ (ac) + Cl- (ac) D Hsoln = 4, 0 k. J
 Destilacion fraccionada
Destilacion fraccionada Homognea
Homognea Homognea
Homognea Es la abertura
Es la abertura Un comerciante desea
Un comerciante desea Entidad esférica formada por un núcleo y corteza
Entidad esférica formada por un núcleo y corteza Una mesa presidencial está formada por ocho personas
Una mesa presidencial está formada por ocho personas Uruguay es un diptongo
Uruguay es un diptongo La esfera tiene una sola base
La esfera tiene una sola base Proceso de segmentacion
Proceso de segmentacion Rayos proximos al eje
Rayos proximos al eje Estructuras del sistema respiratorio
Estructuras del sistema respiratorio Dendritas
Dendritas Terreno íngreme de 100 a 800 metros de altitude
Terreno íngreme de 100 a 800 metros de altitude Espuma para rasurar es solución coloide o suspension
Espuma para rasurar es solución coloide o suspension Concentraciones molares
Concentraciones molares