SOLUCIONES DEFINICIONES Solucin Mezcla homognea solutos componentes de




























- Slides: 30

SOLUCIONES

DEFINICIONES • Solución - Mezcla homogénea • soluto(s) – componente(s) de la solución que se encuentra(n) presente en menor cantidad. • disolvente - componente de la solución que se encuentra presente en mayor cantidad y tiene la capacidad de disolver al soluto.

Formas de expresar la concentración de una solución • Molaridad = moles de soluto Litros de solución donde … moles = gramos / masa molar

Porcentaje en masa: %(w/w) = gramos de soluto x 100 gramos de solución

• Porcentaje en volumen: %(v/v) = mililitros de soluto x 100 mililitros de solución

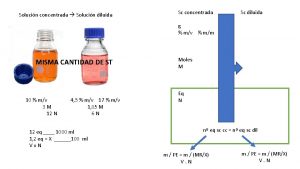
Preparación de solución expresada en Molaridad por pesada directa: • Ejemplo: Prepare 100 m. L de una solución acuosa, 0. 200 M en Na. Cl (masa molar = 58. 44 g/mol) – Para calcular los gramos de soluto que se deben pesar: – Molaridad x Litros x masa molar= gramos de soluto

Procedimiento para preparar la solución: 1. Se pesan los gramos de soluto que se calcularon. 2. Se obtiene un matraz volumétrico del volumen requerido. Para el ejemplo se necesita un matraz de 100 m. L. 3. Echar agua destilada al fondo del matraz. 4. Con un embudo, echar los gramos de soluto ya pesados. 5. Agitar hasta que se disuelva el soluto.

Preparando una solución expresada en porcentaje • Ejemplo: Prepare 100 g de una solución al 1. 00% (w/w) en Na. Cl: • Gramos de soluto=(gramos de solución) x (%) 100 • Se añaden los gramos de agua necesarios para completar los 100 gramos.

Preparando una solución expresada en porcentaje • Ejemplo: Prepare 100 m. L de una solución al 1. 00% (v/v) en etanol: • Mililitros de soluto=(m. L de solución) x (%) 100 • Se añaden los m. L de agua necesarios para completar los 100 mililitros. • ¿Cómo se preparan 50 m. L de una solución al 3. 00% en etanol?

Prepare una solución 2: 5 en etanol • (Se lee 2 a 5) • Se echan 2 m. L de etanol por cada 5 m. L de agua.

Prepare una solución 2/10 en etanol • (Se lee 2 en 10) • Se echan 2 m. L de etanol y se completa con agua hasta obtener un volumen total de 10 m. L.

Diluciones Para una solución expresada en molaridad o porcentaje: C 1 x V 1 = C 2 x V 2 donde: C 1 es la concentración de la solución que ya está preparada V 1 es la alícuota que se debe transferir de la solución ya preparada C 2 es la concentración de la solución que se va a preparar V 2 es el volumen de la solución que se va a preparar

CONCENTRACIÓN DE SOLUCIONES • HAGAMOS EJERCICIOS…

¿Qué sucede a nivel molecular para que se forme una solución? • La fuerzas de atracción entre las moléculas del soluto y las moléculas del disolvente son tan o más fuertes que las fuerzas de atracción entre las moléculas del soluto mismas y las fuerzas de atracción entre las moléculas del dislvente mismas.


¿Cómo cambia la energía de la solución respecto a las sustancias puras? DH soln = DH 1 + DH 2 + DH 3 1: separación de las moléculas del soluto 2: separación de las moléculas del disolvente 3: formación de interacciones soluto-dislvente

¿Qué factores determinan si una solución se formará o no en forma espontánea? • Energía: Sistemas donde tiende a disminuir el contenido de energía (proceso exotérmico). • Desorden: Sistemas donde el desorden tiende a aumentar (aumento en entropía).

¿Qué factores afectan la solubilidad? • Interacciones soluto-disolvente Si las fuerzas intermoleculares en el soluto y las fuerzas intermoleculares en el disolvente son similares habrá una mejor solubilidad

¿Qué factores afectan la solubilidad? • Efectos de presión En líquidos y sólidos este factor no es importante, pero en soluciones entre líquidos y gases sí. ¿Por qué?

¿Qué factores afectan la solubilidad? • Efecto de temperatura Por lo general aumenta la solubilidad con aumento en temperatura. Sin embargo en soluciones con gases es todo lo contario: La solubilidad disminuye con aumento en temperatura. (Ver figs. 13. 14 y 3. 15)

Propiedades Coligativas • Propiedades que sólo dependen de la concentración del soluto y no de la naturaleza de sus moléculas. • Las propiedades coligativas no guardan ninguna relación con el tamaño ni con cualquier otra propiedad de los solutos.


Propiedades Coligativas • Ley de Raoult : PA= XA P 0 A – Si las interaciones soluto-disolvente son mayores que disolvente-dislvente la presión de vapor del disolvente sobre la solución será menor que la que predice la ley de Raoult. – ¿Si las interacciones disolvente –disolvente son mayores que las soluto-disolvente?


Propiedades Coligativas • Elevación del punto de ebullición de una solución comparada con el disolvente puro si el soluto es no volátil. ¿Por qué? • Depresión del punto de fusión de una solución con respecto al disolvente puro si el soluto es no volátil. ¿Por qué?

FÓRMULAS • ΔT ebull. = Kb x m – Donde: m = molalidad de la solución Kb = constante ΔT = T ebull. de la solución - T ebull. disolvente • ΔT fus. = Kf x m – Donde: m = molalidad de la solución Kf = constante ΔT = T fus. Del disolvente - T fus. solución

¿Qué es ósmosis y presión osmótica? • Ósmosis: movimiento neto del disolvente de donde hay mayor cantidad hacia donde hay menor cantidad de moléculas de disolvente. ( por lo tanto se moverá hacia donde haya mayor cantidad de soluto, osea hacia donde esté más concentrada la solución) • Presión osmótica: presión necesaria para evitar la ósmosis.

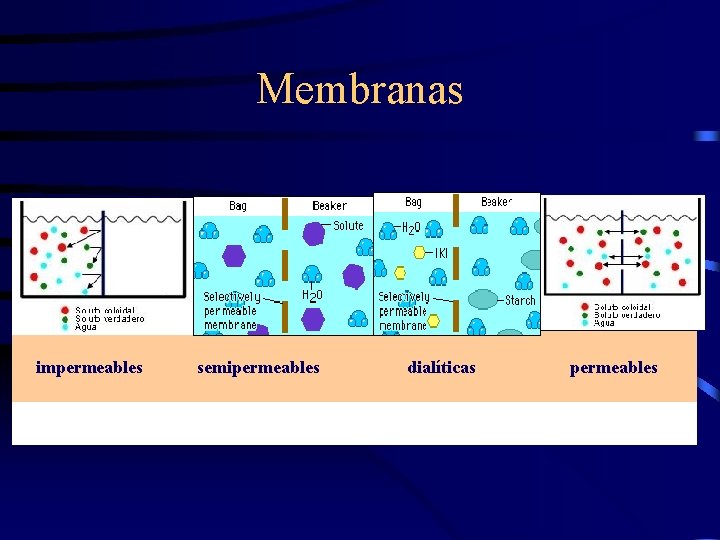
Membranas impermeables semipermeables dialíticas permeables

Coloides • Partícula lo suficientemente pequeña como para experimentar movimiento Browniano pero a la vez mucho más grande que las moléculas del medio en que se encuentra. Miden entre 0. 2 y 200 nm. • Puede ser un sólido, líquido (es decir, una emulsión) o un gas (burbujas). • En el caso de coloides sólidos pueden tener distintas geometrías (los coloides más estudiados son esféricos). • Pueden ser de tamaño más o menos uniforme (llamados monodispersos) o con una gran variación de tamaño (polidispersos).

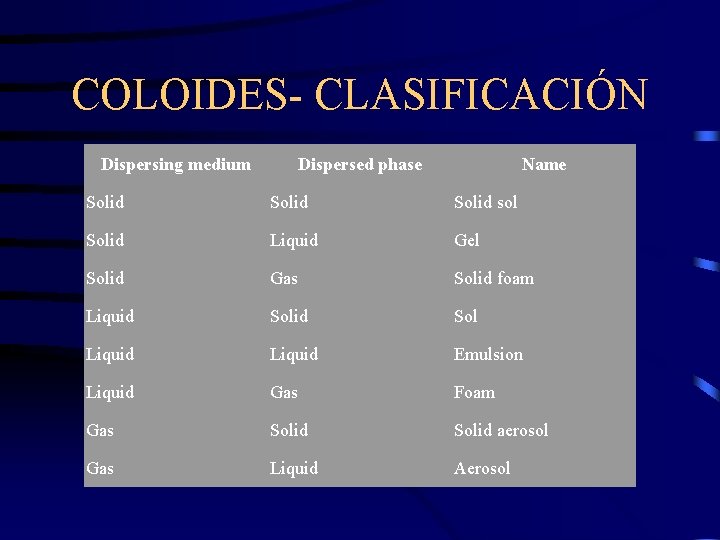
COLOIDES- CLASIFICACIÓN Dispersing medium Dispersed phase Name Solid sol Solid Liquid Gel Solid Gas Solid foam Liquid Sol Liquid Emulsion Liquid Gas Foam Gas Solid aerosol Gas Liquid Aerosol
 Mezcla homognea
Mezcla homognea Mezcla homognea
Mezcla homognea Destilacion fraccionada
Destilacion fraccionada Componentes componentes
Componentes componentes Amminoacidos
Amminoacidos Componentes componentes
Componentes componentes Bolo alimenticio dibujo
Bolo alimenticio dibujo Solucin
Solucin Solucin
Solucin Solucin
Solucin Vertical resultado
Vertical resultado Solucin
Solucin Solucin
Solucin Solucin
Solucin Solucin
Solucin Mistura
Mistura Partes por milhão em volume
Partes por milhão em volume Flux convectivo
Flux convectivo Definiciones de las funciones trigonometricas
Definiciones de las funciones trigonometricas Definiciones quimicas
Definiciones quimicas Tres definiciones de concepto
Tres definiciones de concepto Definiciones de estados financieros
Definiciones de estados financieros Definiciones de sociologia
Definiciones de sociologia Definiciones básicas
Definiciones básicas Conclusion del pensamiento critico
Conclusion del pensamiento critico Tipo de espacios confinados
Tipo de espacios confinados Ambiente en textos narrativos
Ambiente en textos narrativos El no contesto entraron en el bar
El no contesto entraron en el bar Definiciones de emprender
Definiciones de emprender Definiciones de salud ocupacional
Definiciones de salud ocupacional Michael rutter resiliencia
Michael rutter resiliencia