Solu es Solues Soluo uma mistura homognea de












- Slides: 14

Soluç ões

Soluções Solução: é uma mistura homogênea de soluto e solvente Solvente: Componente cujo estado físico é preservado. Soluto: Dissolvido no solvente Observação: Se todos os componentes estiverem no mesmo estado físico, o solvente é aquele presente em maior quantidade.

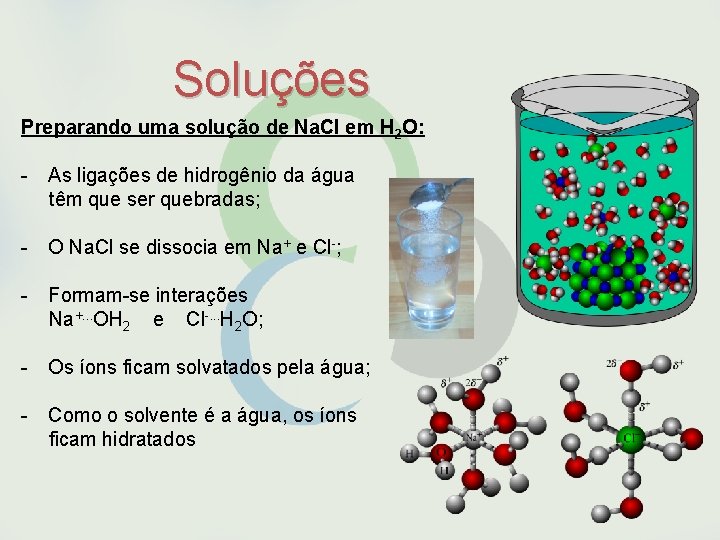
Soluções Preparando uma solução de Na. Cl em H 2 O: - As ligações de hidrogênio da água têm que ser quebradas; - O Na. Cl se dissocia em Na+ e Cl-; - Formam-se interações Na+. . . OH 2 e Cl-. . . H 2 O; - Os íons ficam solvatados pela água; - Como o solvente é a água, os íons ficam hidratados

Soluções

ormas de expressar a concentraçã - Diluídas - Quantidade de matéria - Concentradas - Molalidade - Insaturadas - Porcentagem de massa - ppm (partes por milhão) - Saturadas - ppb (partes por bilhão) - Supersaturadas - Volume de O 2 - Fração molar

ormas de expressar a concentraçã - QUANTIDADE DE MATÉRIA c = quantidade de matéria por litro n = quantidade de matéria do soluto V = volume da solução - FRAÇÃO EM QUANTIDADE DE MATÉRIA x = fração em mol n = quantidade de matéria do soluto n. T = quantidade de matéria total

Exercício 1. O cloreto de hidrogênio (HCl) é bastante solúvel em água. Comercialmente ele é vendido como uma solução aquosa de densidade 1, 19 g m. L-1, e que contém 360 g de HCl para cada 1000 g de solução. Qual é a concentração desta solução em quantidade de matéria? Resolução: - Para cada litro de solução, temos que sua massa é de 1190 g. - Se em 1000 g de solução, temos 360 g de HCl em 1 L = 1190 g teremos X g de HCl X = 428, 4 g HCl/L

Exercício 1. Qual é a fração molar de etanol em uma solução contendo, 20 g de etanol dissolvidos em 80 g de octano? E qual é a fração molar de octano? Resolução: - A massa molecular de etanol é 46 e portanto, 20 g de etanol contém 20/46 = 0, 4348 mol - A massa molecular de octano é 114 e portanto, 80 g de octano contém 80/114 = 0, 7017 mol

ormas de expressar a concentraçã - % EM MASSA - ppm massa do componente na solução x 106 ppm do componente = massa total da solução - MOLALIDADE m = molalidade n = quantidade de matéria do soluto massa = massa do solvente (kg)

Exercício 1. Etilenoglicol, HOCH 2 OH, é utilizado como anticongelante em regiões frias. Suponha que 1, 0 kg de etilenoglicol foram adicionados no radiador de um carro que contém 4, 0 kg de água. Qual é a molalidade e a porcentagem em massa do etilenoglicol?

Diluições Frequentemente temos que preparar uma nova solução, menos concentrada, a partir de uma solução estoque. Para diluir uma solução, basta adicionar mais solvente. O volume da solução aumenta, mas o numero de mol permanece o mesmo. Portanto: c(inicial). V(l)(inicial) = c(final). V(l)(final)

Diluições - Exercícios 1. Calcule a molaridade de uma solução de ácido sulfúrico preparada pela mistura de 15, 0 m. L de H 2 SO 4 6, 0 mol L-1 com 250, 0 m. L de H 20. 2. Qual volume de uma solução estoque de Na. OH 0, 750 mol L 1 deve ser utilizado para preparar 2, 5 L de uma solução de Na. OH 0, 125 mol L-1?

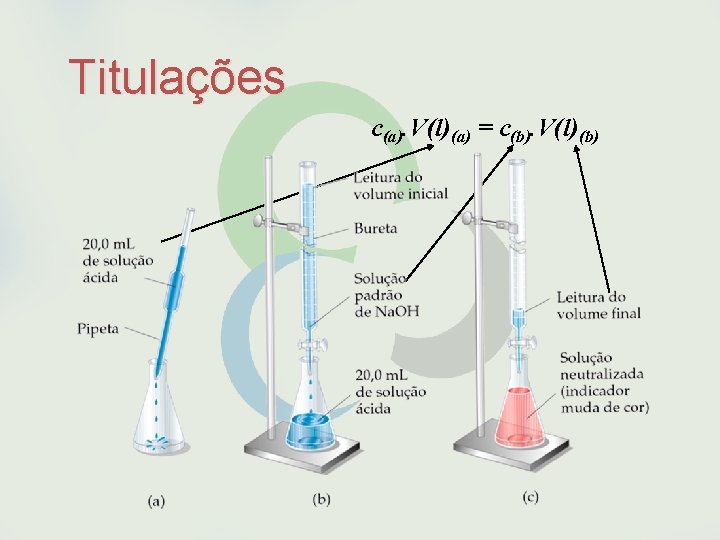
Titulações Objetivo: Sabendo a concentração de uma solução padrão (ex. Na. OH), podemos determinar a concentração de uma solução com concentração desconhecida (ex. HCl) e portanto a quantidade de matéria (ex. HCl). Se: Na equação de neutralização: 1 HCl + 1 Na. OH Na. Cl + H 2 O. A quantidade de matéria de HCl é igual a de Na. OH (1 : 1) Portanto: c(a). V(l)(a) = c(b). V(l)(b)

Titulações c(a). V(l)(a) = c(b). V(l)(b)
 Solues
Solues Ci.vi=cf.vf
Ci.vi=cf.vf Mistura
Mistura Como separar uma mistura heterogênea
Como separar uma mistura heterogênea Sao preparadas 3 misturas binarias
Sao preparadas 3 misturas binarias Mackenzie o processo inadequado para separar
Mackenzie o processo inadequado para separar Misturas heterogêneas
Misturas heterogêneas Unterschied solu-decortin und prednisolon
Unterschied solu-decortin und prednisolon Solu zanichelli
Solu zanichelli Solun perusrakenne
Solun perusrakenne Solu.zone chimica molecole in movimento
Solu.zone chimica molecole in movimento Dr jelena drulovic
Dr jelena drulovic James joyce life zanichelli
James joyce life zanichelli Flux convectivo
Flux convectivo Mezcla homognea
Mezcla homognea


























