MAGNITUDES MOLARES 1 ero Medio Profesora Paula Cspedes



![• Por ejemplo: • Hay 6, 02 x 10 23 [átomos] de Cobre • Por ejemplo: • Hay 6, 02 x 10 23 [átomos] de Cobre](https://slidetodoc.com/presentation_image_h2/94c13cdce738b84b1555d4d84a73f25c/image-4.jpg)



![• 3. Se suman todos los resultados • 12, 01 [gr/mol] • + • 3. Se suman todos los resultados • 12, 01 [gr/mol] • +](https://slidetodoc.com/presentation_image_h2/94c13cdce738b84b1555d4d84a73f25c/image-8.jpg)

![• Átomos de Ca: 40, 08 x 1 = 40, 08 [gr/mol] • • Átomos de Ca: 40, 08 x 1 = 40, 08 [gr/mol] •](https://slidetodoc.com/presentation_image_h2/94c13cdce738b84b1555d4d84a73f25c/image-10.jpg)
![• Por lo tanto, la masa de 1 [mol] de Ca(OH)2 es igual • Por lo tanto, la masa de 1 [mol] de Ca(OH)2 es igual](https://slidetodoc.com/presentation_image_h2/94c13cdce738b84b1555d4d84a73f25c/image-11.jpg)

![• Por lo tanto 2 [moles] de O 2 ocuparan un volumen de • Por lo tanto 2 [moles] de O 2 ocuparan un volumen de](https://slidetodoc.com/presentation_image_h2/94c13cdce738b84b1555d4d84a73f25c/image-13.jpg)


![Ejemplo • Determinar el volumen ocupado por 6, 42 [mol] de O 2 en Ejemplo • Determinar el volumen ocupado por 6, 42 [mol] de O 2 en](https://slidetodoc.com/presentation_image_h2/94c13cdce738b84b1555d4d84a73f25c/image-17.jpg)
![• • X [lt] O 2 x 1 [mol] O 2 = 22, • • X [lt] O 2 x 1 [mol] O 2 = 22,](https://slidetodoc.com/presentation_image_h2/94c13cdce738b84b1555d4d84a73f25c/image-18.jpg)

- Slides: 19

MAGNITUDES MOLARES 1 ero Medio Profesora: Paula Céspedes D.

Objetivo • Conocer las magnitudes molares para poder realizar cálculos estequiométricos a través de una reacción química. . Colegio San Nicolás - Canal Chacao 2

Magnitudes Molares • Representan la variación de una propiedad extensiva del sistema debido a la adición, a temperatura y presión constantes, de un mol del componente sin que varíe apreciablemente la composición del sistema. • Podemos contar cualquier cosa usando el número de Avogadro. Solo debemos saber que en un mol hay 6, 02 x 10 23 unidades de esa cosa. Si aplicamos esto al átomo, resulta muy conveniente. Colegio San Nicolás - Canal Chacao 3
![Por ejemplo Hay 6 02 x 10 23 átomos de Cobre • Por ejemplo: • Hay 6, 02 x 10 23 [átomos] de Cobre](https://slidetodoc.com/presentation_image_h2/94c13cdce738b84b1555d4d84a73f25c/image-4.jpg)
• Por ejemplo: • Hay 6, 02 x 10 23 [átomos] de Cobre (Cu) en 1 [mol] de Cobre (Cu) • 6, 02 x 10 23 [átomos] Cu – 1 [mol] Cu • Hay 6, 02 x 10 23 [moléculas] de Dióxido de carbono (CO 2) en 1 [mol] de Dióxido de Carbono (CO 2) • 6, 02 x 10 23 [moléculas] CO 2 – 1 [mol] CO 2 Colegio San Nicolás - Canal Chacao 4

• Diariamente, empleamos varias unidades para contar objetos, como la docena y la resma. Los Químicos utilizan la unidad mol para referirse a la cantidad de átomos, moléculas u otras partículas. Colegio San Nicolás - Canal Chacao 5

MASA MOLAR • La Masa Molar (M) es la masa de 1 mol de átomos, moléculas u otras partículas, expresada en gramos. Para un elemento, su masa molar es equivalente a su masa atómica (que aparece en la tabla periódica). Así, la masa molar del Cobre (Cu) es de 63, 55 [gr/mol]. Para un compuesto, su masa molar resulta al sumar las masas atómicas de todos los átomos presentes en la fórmula química del compuesto, pero debes multiplicar cada masa atómica por la cantidad de átomos que hay de cada uno antes de sumarlos. Colegio San Nicolás - Canal Chacao 6

EJEMPLO • Calcular la masa molar del Dióxido de Carbono (CO 2): • 1. Buscar la masa atómica de cada uno de los átomos que forman el compuesto: • Masa atómica del C: 12, 01 [gr/mol] • Masa atómica del O: 15, 99 [gr/mol] • 2. Se debe multiplicar cada masa atómica por la cantidad de átomos que tiene el compuesto: • Átomos de C: 12, 01 x 1 = 12, 01 [gr/mol] • Átomos de O: 15, 99 x 2 = 31, 98 [gr/mol] Colegio San Nicolás - Canal Chacao 7
![3 Se suman todos los resultados 12 01 grmol • 3. Se suman todos los resultados • 12, 01 [gr/mol] • +](https://slidetodoc.com/presentation_image_h2/94c13cdce738b84b1555d4d84a73f25c/image-8.jpg)
• 3. Se suman todos los resultados • 12, 01 [gr/mol] • + 31, 98 [gr/mol] • 43, 99 [gr/mol] Masa molar del CO 2 • Por lo tanto, la masa de 1[mol] de CO 2 es igual a 43, 99 [gr] y • 6, 02 x 10 23 [moléculas] es igual 43, 99 [gr] Colegio San Nicolás - Canal Chacao 8

Ejemplo • Calcular la masa molar de Hidróxido de Calcio (Ca(OH)2): • 1. Buscar las masas atómicas de cada uno de los átomos que forman el compuesto en la tabla periódica: • Masa atómica de Ca: 40, 08 [gr/mol] • Masa atómica de O: 15, 99 [gr/mol] • Masa atómica de H: 1, 00 [gr/mol] • 2. Se deben multiplicar las masas atómicas de c/u por la cantidad de átomos que hay en la fórmula: Colegio San Nicolás - Canal Chacao 9
![Átomos de Ca 40 08 x 1 40 08 grmol • Átomos de Ca: 40, 08 x 1 = 40, 08 [gr/mol] •](https://slidetodoc.com/presentation_image_h2/94c13cdce738b84b1555d4d84a73f25c/image-10.jpg)
• Átomos de Ca: 40, 08 x 1 = 40, 08 [gr/mol] • Átomos de O: 15, 99 x 2 = 31, 98 [gr/mol] • Átomos de H: 1, 00 x 2 = 2, 00 [gr/mol] • 3. Se suman todos los resultados y da la masa molar del compuesto: • 40, 08 [gr/mol] • 31, 98 [gr/mol] • + 2, 00 [gr/mol] • 74, 06 [gr/mol] Masa molar Ca(OH)2 Colegio San Nicolás - Canal Chacao 10
![Por lo tanto la masa de 1 mol de CaOH2 es igual • Por lo tanto, la masa de 1 [mol] de Ca(OH)2 es igual](https://slidetodoc.com/presentation_image_h2/94c13cdce738b84b1555d4d84a73f25c/image-11.jpg)
• Por lo tanto, la masa de 1 [mol] de Ca(OH)2 es igual a 74, 06 [gr/mol] y 6, 02 x 10 23 [moléculas] es igual a 74, 06 [gr]. • 1 [mol] Ca(OH)2 - 74, 06 [gr] Ca(OH)2 • 6, 02 x 10 23 [moléculas] Ca(OH)2 – 74, 06 [gr] Ca(OH)2 Colegio San Nicolás - Canal Chacao 11

VOLUMEN MOLAR • Es el volumen que ocupa un mol de un elemento o compuesto en estado gaseoso. • Un mol de cualquier gas, en condiciones normales de presión y temperatura, siempre ocupará 22, 4 litros [lt]. Al hablar de condiciones normales (CN), nos referimos a 0 ° Celsius [°C] de temperatura y a 1 atmósfera [atm] de presión. • 1 [mol] gas – 22, 4 [lt] gas en CN. Colegio San Nicolás - Canal Chacao 12
![Por lo tanto 2 moles de O 2 ocuparan un volumen de • Por lo tanto 2 [moles] de O 2 ocuparan un volumen de](https://slidetodoc.com/presentation_image_h2/94c13cdce738b84b1555d4d84a73f25c/image-13.jpg)
• Por lo tanto 2 [moles] de O 2 ocuparan un volumen de 44, 8 [lt ] de O 2 en CN. • 2 [moles] O 2 - 44, 8 [lt] O 2 en CN. Colegio San Nicolás - Canal Chacao 13

• Entonces, si se tiene una reacción en que uno de los reactantes o productos es un gas, se puede calcular su volumen conociendo la cantidad de sustancia. • Por ejemplo: • 1 [mol] O 2 o cualquier otro gas, ocupa 22, 4 [lt] en (CN). • Escrito de otra forma: • 1 [mol] O 2 - 22, 4 [lt] O 2 en CN. Colegio San Nicolás - Canal Chacao 14

Ejemplo • En la reacción de electrólisis, el agua se descompone en 2 gases, el hidrógeno H 2 y el oxígeno O 2. La reacción química que representa el proceso es: • 2 H 2 O (l) → 2 H 2 (g) + O 2 (g) • A partir de la reacción química se puede establecer que se obtienen 2 [mol] de H 2 y 1 [mol]de O 2 y aplicando el volumen molar: • 2 [mol] H 2 equivalen a 44, 8 [lt] • 1 [mol]O 2 equivale a 22, 4 [lt] Colegio San Nicolás - Canal Chacao 15

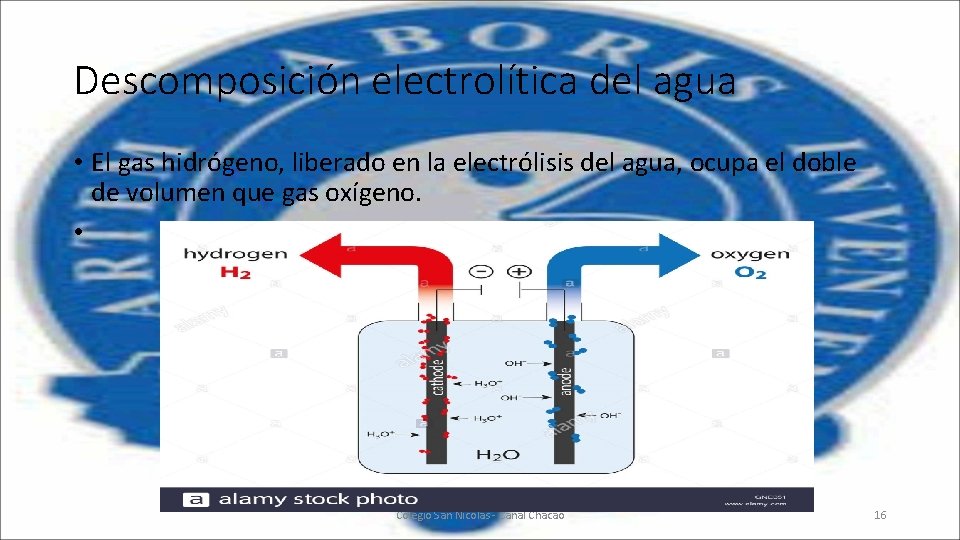
Descomposición electrolítica del agua • El gas hidrógeno, liberado en la electrólisis del agua, ocupa el doble de volumen que gas oxígeno. • Colegio San Nicolás - Canal Chacao 16
![Ejemplo Determinar el volumen ocupado por 6 42 mol de O 2 en Ejemplo • Determinar el volumen ocupado por 6, 42 [mol] de O 2 en](https://slidetodoc.com/presentation_image_h2/94c13cdce738b84b1555d4d84a73f25c/image-17.jpg)
Ejemplo • Determinar el volumen ocupado por 6, 42 [mol] de O 2 en CN. • Nosotros vimos en la relación anterior que 1 [mol] de cualquier sustancia gaseosa ocupan un volumen de 22, 4 [lt] en condiciones normales (CN). Por lo tanto se aplica una regla de tres simple para resolver el ejercicio: • X [lt] O 2 - 6, 42 [mol] O 2 se debe multiplicar cruzado y 22, 4 [lt] O 2 - 1 [mol] O 2 despejar la incógnita. • Colegio San Nicolás - Canal Chacao 17
![X lt O 2 x 1 mol O 2 22 • • X [lt] O 2 x 1 [mol] O 2 = 22,](https://slidetodoc.com/presentation_image_h2/94c13cdce738b84b1555d4d84a73f25c/image-18.jpg)
• • X [lt] O 2 x 1 [mol] O 2 = 22, 4 [lt] O 2 x 6, 42 [mol] O 2 X[lt] O 2 = 22, 4 [lt] O 2 x 6, 42 [mol] O 2 1 [mol] O 2 X [lt] O 2 = 143, 81 o X = 143, 81 [lt] O 2 • Colegio San Nicolás - Canal Chacao 18

Ejercicios • 1. Calcular la masa molar de los siguientes compuestos: • a) H 2 O (agua) (respuesta: 18 [gr/mol]) • b) C 6 H 12 O 6 (glucosa) (respuesta: 179, 94 [gr/mol] • c) H 2 SO 4 (Ácido sulfúrico) (respuesta: 98, 02 [gr/mol] • 2. Determinar los moles correspondientes de 100, 0 [lt ]de CO 2 en condiciones normales (CN). (respuesta: 4, 46 [mol] CO 2) Colegio San Nicolás - Canal Chacao 19
 Concentraciones molares
Concentraciones molares Molares inferiores
Molares inferiores Função do esôfago
Função do esôfago Que es fraccion molar en quimica
Que es fraccion molar en quimica Exodoncia a colgajo
Exodoncia a colgajo Verbo de 9 letras
Verbo de 9 letras Ero
Ero Sigla de profesora
Sigla de profesora Ero liivik
Ero liivik Mit jelent a kis erő nagy idő
Mit jelent a kis erő nagy idő Tita de la garza
Tita de la garza Gustar presente indicativo
Gustar presente indicativo Fizikai munka rejtvény
Fizikai munka rejtvény Porter 5 erő
Porter 5 erő De la profesora
De la profesora Tableau ero
Tableau ero La profesora marta en el proceso de desarrollo
La profesora marta en el proceso de desarrollo Er frug
Er frug F erő
F erő Ero is
Ero is