LES PROCDS DE SPARATION Thermochimie chapitre 10 Guy














- Slides: 24

LES PROCÉDÉS DE SÉPARATION Thermochimie : chapitre 10 Guy COLLIN, 2014 -12 -29

Les procédés de séparation n Les lois de la thermodynamique prévoient l’existence de constante d’équilibre entre phases, entre réactifs et produits d’une réaction… Ainsi établis, ils indiquent qu’il est généralement impossible d’obtenir un produit pur. Quels sont les procédés mis en jeu dans l’industrie pour contourner ces équilibres et obtenir des produits purs ? G = H - TS 2014 -12 -29

La distillation simple n n Soient A et B sont deux liquides miscibles en toutes proportions. Les fractions molaires en phases liquide et gazeuse sont G = H - TS 2014 -12 -29

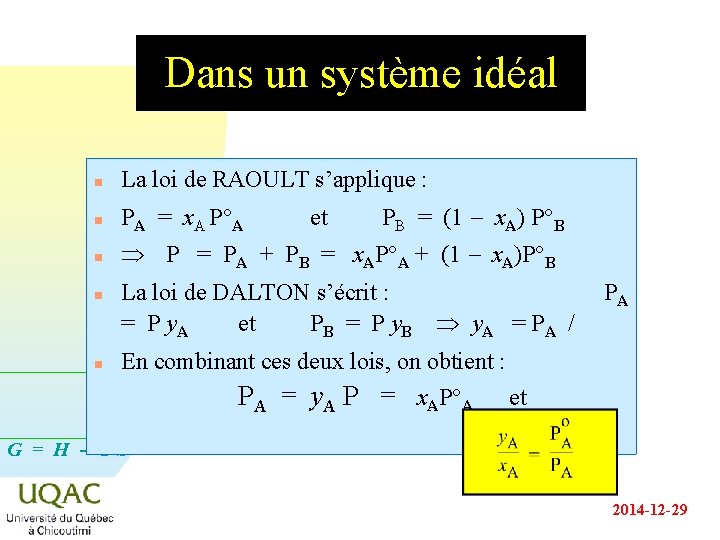
Dans un système idéal n La loi de RAOULT s’applique : n PA = x. A P°A n Þ P = PA + PB = x. AP°A + (1 - x. A)P°B n n et PB = (1 - x. A) P°B La loi de DALTON s’écrit : = P y. A et PB = P y B Þ y. A = P A / PA En combinant ces deux lois, on obtient : PA = y. A P = x. AP°A et G = H - TS 2014 -12 -29

La volatilité n n n Les volatilités des composés A et B , v. A et v. B , sont par définition : n v. A = y. A / x. A et v B = y. B / x. B Si la température d’ébullition de A, TA, est inférieure à celle de B, TB, alors v. A > 1 et v. B < 1, et v. B = y. B / x. B = (1 - y. A ) / (1 - x. A ) La volatilité relative a est donnée par a = v. A / v. B. On obtient une relation entre y. A, x. A et a. G = H - TS 2014 -12 -29

Composition de la vapeur La distillation isobarique y. A n a = 10 a=3 a = 1, 5 n a = 1 x. A G = H - Composition TS du liquide O n La fonction y. A = ƒ(x. A) est un morceau d’arc d’hyperbole avec paramètre a. a varie avec T et on a donc intérêt à avoir une valeur a maximum pour obtenir une séparation la plus aisée possible. Si P est fixé, le système est monovariant. 2014 -12 -29

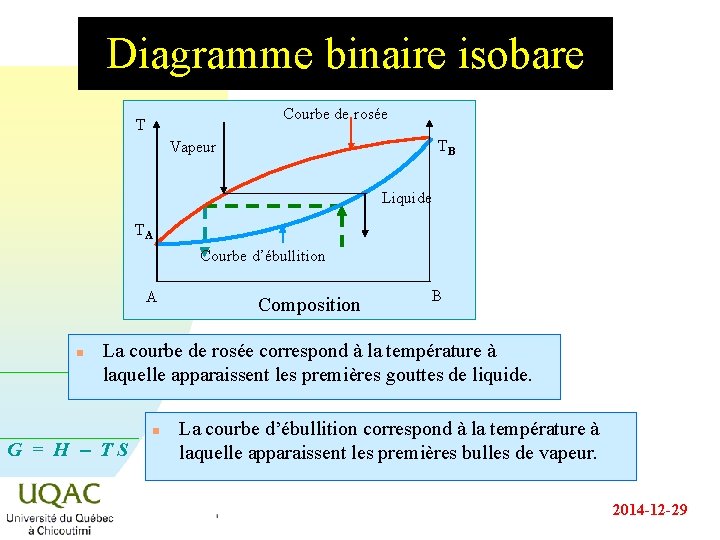
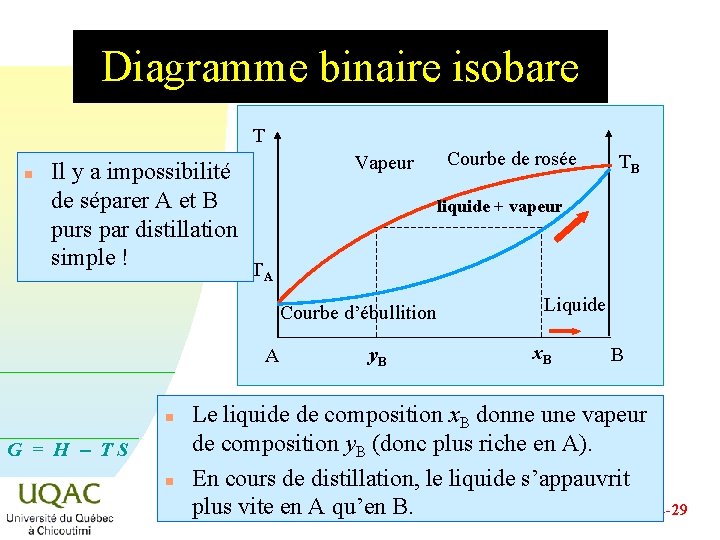
Diagramme binaire isobare Température Vapeur surchauffée Courbe de rosée T liquide + vapeur TA Courbe d’ébullition A G = H - TS TB Vapeur n Liquide Composition des phases B À l’intérieur du fuseau de distillation coexistent en équilibre la phase liquide et la phase vapeur 2014 -12 -29

Diagramme binaire isobare Courbe de rosée T TB Vapeur Liquide TA Courbe d’ébullition A n Composition B La courbe de rosée correspond à la température à laquelle apparaissent les premières gouttes de liquide. G = H - TS n La courbe d’ébullition correspond à la température à laquelle apparaissent les premières bulles de vapeur. 2014 -12 -29

Diagramme binaire isobare T n Il y a impossibilité de séparer A et B purs par distillation simple ! TA Vapeur n G = H - TS n TB liquide + vapeur Courbe d’ébullition A Courbe de rosée y. B Liquide x. B B Le liquide de composition x. B donne une vapeur de composition y. B (donc plus riche en A). En cours de distillation, le liquide s’appauvrit plus vite en A qu’en B. 2014 -12 -29

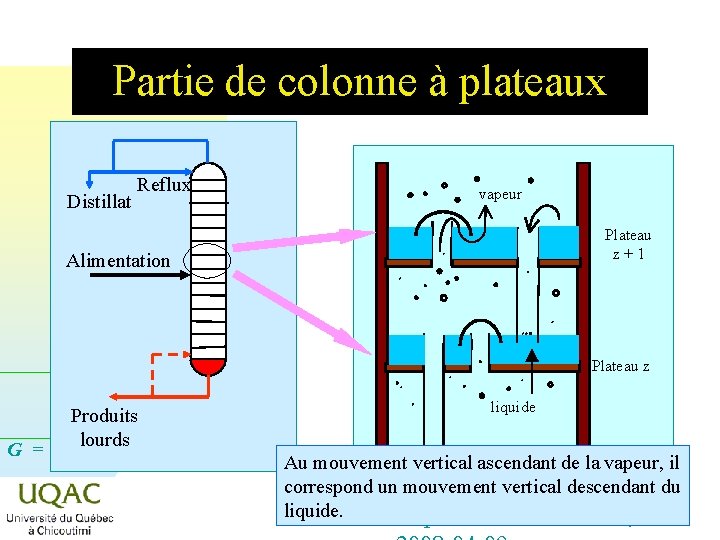
Partie de colonne à plateaux Distillat Reflux vapeur Plateau z+1 Alimentation Plateau z Produits lourds G = H - TS liquide Au mouvement vertical ascendant de la vapeur, il correspond un mouvement vertical descendant du 2014 -12 -29 liquide. Dépt. des sciences fond. ,

Une colonne à distiller n De la plus petite à la plus grande : Vigreux G = H - TS 2014 -12 -29

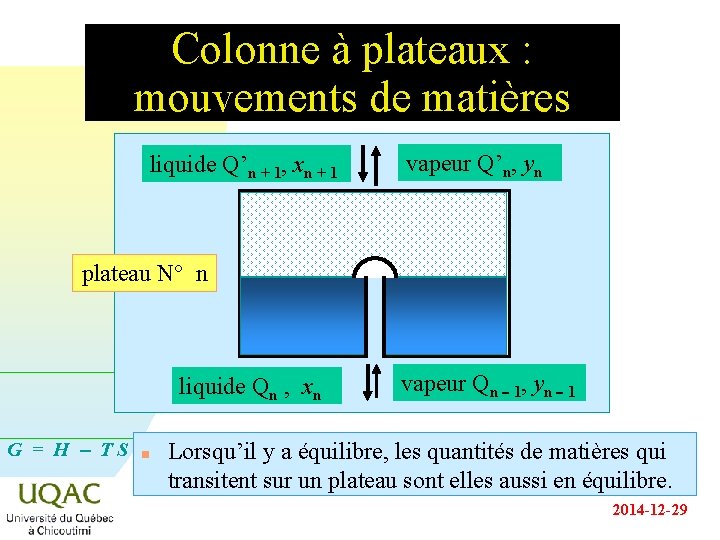
Colonne à plateaux : mouvements de matières liquide Q’n + 1, xn + 1 vapeur Q’n, yn plateau N° n liquide Qn , xn G = H - TS n vapeur Qn - 1, yn - 1 Lorsqu’il y a équilibre, les quantités de matières qui transitent sur un plateau sont elles aussi en équilibre. 2014 -12 -29

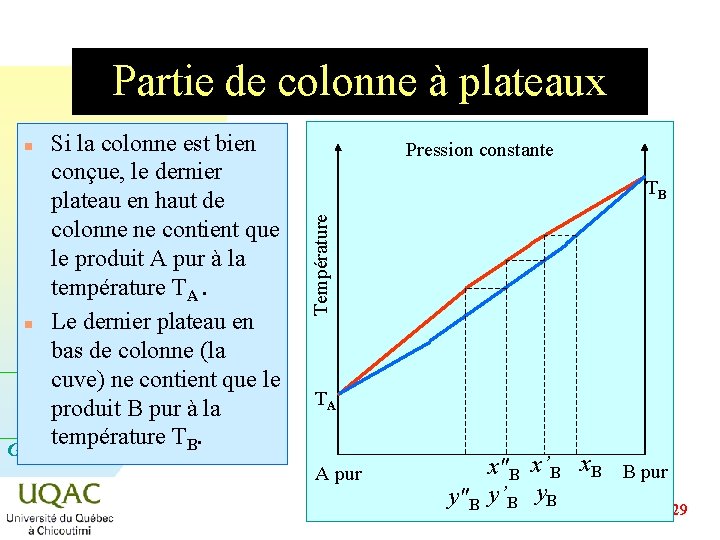
Partie de colonne à plateaux Si la colonne est bien conçue, le dernier plateau en haut de colonne ne contient que le produit A pur à la température TA. n Le dernier plateau en bas de colonne (la cuve) ne contient que le produit B pur à la température TB. G = H - TS Pression constante n Température TB TA A pur x"B x’B x. B B pur y"B y’B y. B 2014 -12 -29

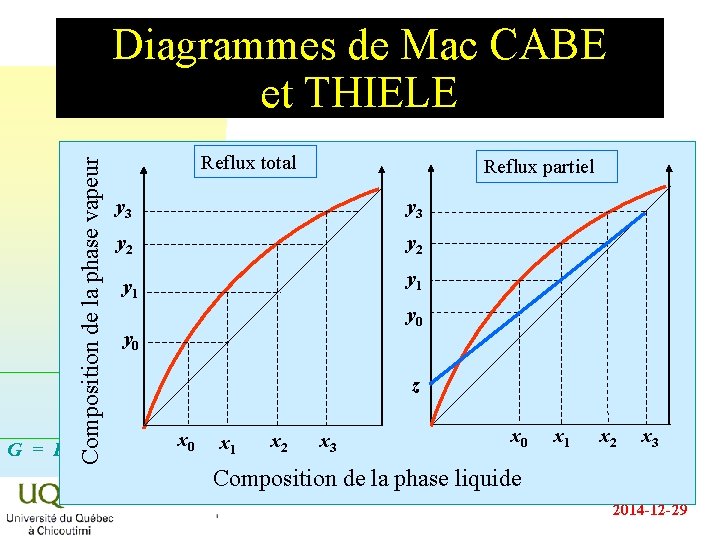
Efficacité de la colonne n n On peut donc calculer le nombre de plateaux théoriques pourvu que l’on connaisse la composition du mélange initial et celle du mélange recherché. Le nombre de plateaux théoriques est donné par la formule de FENSKE : n+1 = éy ê n Lnê ëxo æ 1 - y öù o÷ú ç ç 1 - y ÷ú è nøû Ln a Cette formule n’est valide qu’à reflux total : il faut que ces déplacements verticaux de liquide et de vapeur soient égaux. n L’efficacité de la colonne est le rapport du nombre de G = H - TS plateaux théoriques au nombre de plateaux réel. n 2014 -12 -29

Composition de la phase vapeur Diagrammes de Mac CABE et THIELE Reflux total Reflux partiel y 3 y 2 y 1 y 0 G = H - TS z x 0 x 1 x 2 x 3 Composition de la phase liquide 2014 -12 -29

Application aux mélanges azéotropiques n n Il est donc possible de séparer deux composés A et B miscibles en toute proportion à l’aide de la rectification. Que se passe-t-il dans le cas de mélange azéotropique ? 64 T (°C) 60 56 P = 752 mm. Hg acétone G H -la. Tcomposition S n = Pour n chloroforme azéotropique le liquide et la vapeur ont la même composition. 2014 -12 -29 En distillation, l’azéotrope se comporte comme un produit pur.

y(acétone) en phase vapeur La rectification azéotropique 64 20 % 60 56 x(acétone) en solution liquide n G = H - TS n T (°C) P = 752 mm. Hg acétone composition chloroforme Le système A-B se divise et se comporte comme deux systèmes A-azéotrope et azéotrope-B. Dépendant de la composition du mélange à séparer, on 2014 -12 -29 obtient un produit pur et. Dépt. l’azéotrope. des sciences fond. ,

L’entraînement à la vapeur n n n Au-dessus d’un système de deux liquides complètement non miscibles, la pression de vapeur est la somme des pressions de vapeur des deux constituants purs : n P = P°A + P °B C’est une technique de « co-distillation » . Elle permet d’abaisser la température de distillation d’un composé thermiquement sensible à sa température normale d’ébullition. G = H - TS 2014 -12 -29

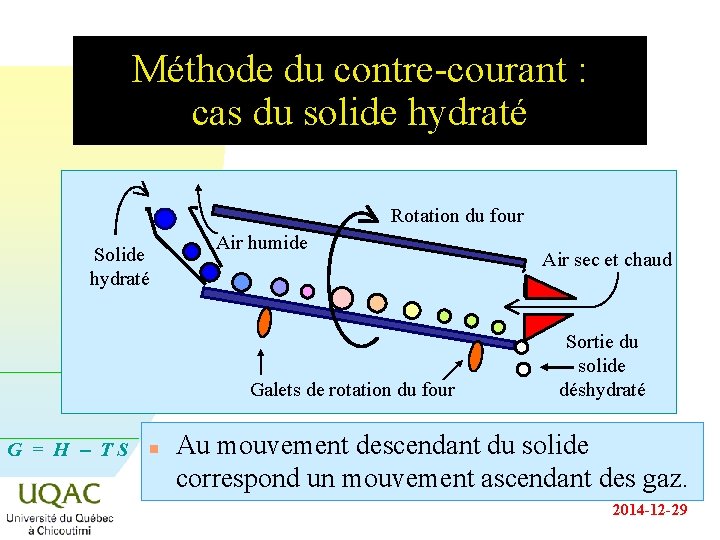
La méthode de contre-courant Soit un solide hydraté, S, n. H 2 O, que l’on veut déshydrater. n S, n. H 2 O S + n H 2 O avec DG > O n Ln KP = n Ln PH O 2 n Dans un vase clos à la température T considérée, le composé hydraté est en équilibre avec la vapeur d’eau : il faudrait travailler à haute température. n On utilise une méthode plus économique appelée G = H - T S la méthode du contre-courant. n 2014 -12 -29

Méthode du contre-courant : cas du solide hydraté Rotation du four Solide hydraté Air humide Galets de rotation du four G = H - TS n Air sec et chaud Sortie du solide déshydraté Au mouvement descendant du solide correspond un mouvement ascendant des gaz. 2014 -12 -29

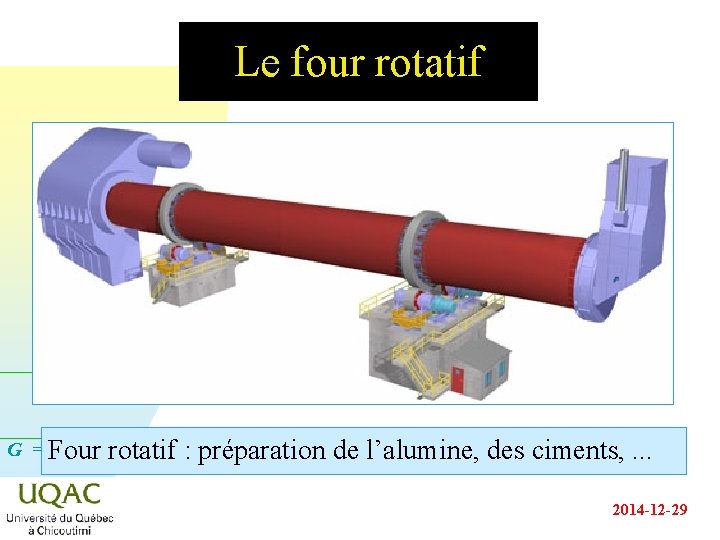
Le four rotatif G = Four H - Trotatif S : préparation de l’alumine, des ciments, . . . 2014 -12 -29

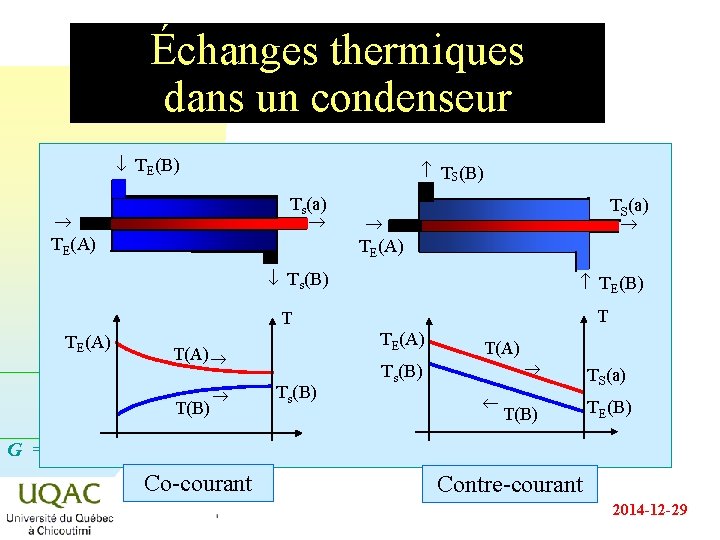
Le four rotatif et. . . le condenseur n n Usages : u les cimenteries, u la fabrication de l’alumine, u un soluté partagé entre deux solvants non miscibles, . . . Cette technique est aussi celle à la base du fonctionnement du réfrigérant ou du condenseur : la "matière" à éliminer étant la chaleur. G = H - TS 2014 -12 -29

Échanges thermiques dans un condenseur ¯ TE(B) TS(B) Ts(a) TE(A) TS(a) TE(A) ¯ Ts(B) TE(B) T T TE(A) T(A) T(B) Ts(B) T(A) Ts(B) ¬ T(B) TS(a) TE(B) G = H - TS Co-courant Contre-courant 2014 -12 -29

Conclusions n n n S’il est impossible d’obtenir un produit pur par distillation simple, la rectification (utilisation de la colonne à plateaux) permet d’obtenir une séparation complète de deux constituants à fuseau de distillation simple. Dans le cas des systèmes azéotropiques on obtient un constituant pur et le mélange azéotropique. La technique du contre-courant constitue un autre moyen de déplacer artificiellement un équilibre physique (cas du réfrigérant) ou chimique (cas du four rotatif). G = H - TS 2014 -12 -29
 Loi de kirchhoff thermochimie
Loi de kirchhoff thermochimie Schéma filtration eau boueuse
Schéma filtration eau boueuse Sparation
Sparation Sparation
Sparation Sparation
Sparation Tirez pas sur le scarabée résumé complet
Tirez pas sur le scarabée résumé complet Le petit prince résumé simple
Le petit prince résumé simple Le petit prince résumé
Le petit prince résumé Lecture analytique petit pays incipit
Lecture analytique petit pays incipit Taktik good guy bad guy
Taktik good guy bad guy Résumé de chapitre 26 le dernier jour d'un condamné
Résumé de chapitre 26 le dernier jour d'un condamné Marqueur de relation conclusion
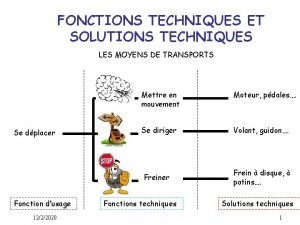
Marqueur de relation conclusion Fonctions techniques
Fonctions techniques Allez vous en sur les places paroles
Allez vous en sur les places paroles Les constellations les plus connues
Les constellations les plus connues Resume de la ficelle de guy maupassant
Resume de la ficelle de guy maupassant Podc management
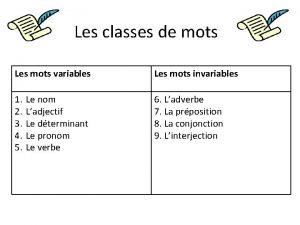
Podc management Classe de mots variables
Classe de mots variables Projecte les flors
Projecte les flors Les voitures les plus rapides du monde
Les voitures les plus rapides du monde Preactionneurs
Preactionneurs Remplacez les mots soulignes par les pronoms convenable
Remplacez les mots soulignes par les pronoms convenable Qu'est-ce que tu aimes manger
Qu'est-ce que tu aimes manger Haribo c'est beau la vie
Haribo c'est beau la vie Trouvez les réponses. écrivez-les en chiffres (numbers).
Trouvez les réponses. écrivez-les en chiffres (numbers).