CHAPITRE 4 APPLICATIONS EN THERMOCHIMIE 1 EFFET DE
















- Slides: 22

CHAPITRE 4 APPLICATIONS EN THERMOCHIMIE

1 - EFFET DE LA TEMPÉRATURE SUR LES ENTHALPIES DE RÉACTION Soit une réaction chimique d’équation. On cherche la valeur de Dr H(T 2) de l'enthalpie à une température T 2 connaissant celle à T 1. Loi de KIRCHOFF:

Application: Loi de Kirchoff Soit la réaction d’équation : CH 4 (g) + 4 Cl 2 (g) --> CCl 4(g) + 4 HCl (g) avec Dr. H° = -401, 08 k. J/mol à 298 K. Calculer l'enthalpie standard de cette réaction à 650 K Données: Réponse On doit écrire la loi de Kirchhoff et calculer Dr. C°P = 4 C°P (HCl) +C°P (CCl 4) - 4 C°P (Cl 2) – C°P(CH 4)=28. 56 J K-1 mol-1 Dr. H°(650 K) =Dr. H°(298 K) + Dr. C°P (650 -298) Dr. H°(650 K) =-401, 08 103 + 28, 56*(650 -298) = -391, 03 k. J/mol.

2 - Loi de HESS Comme l'enthalpie est une fonction d'état, la loi de Hess est à proprement parler une évidence. Il est tout de même profitable de se remémorer les 3 formulations suivantes: -Le changement d'enthalpie d'un processus ne dépend que de l'état initial et de l'état final du processus, et non des états intermédiaires traversés. -Le changement d'enthalpie d'un processus qui parcourt plusieurs états transitoires est la somme des enthalpies des processus transitoires. -Le changement d'enthalpie d'un processus cyclique fermé est nul.

3 -ENTHALPIE STANDARD DE FORMATION Δf. H°T (X, ) L’enthalpie (molaire) standard de formation d’un corps est l’enthalpie de formation d’une mole de ce corps dans son état standard à partir des éléments pris isolément à la température considérée et chacun étant dans son état naturel. L’état naturel de la plus part des éléments chimiques est solide. --Les éléments H, N, O, F, Cl, ont un état naturel gaz en molécules diatomiques. -- les gazs nobles ou rares sont des gaz monoatomiques. Rque: Par conséquent, l'enthalpie standard de formation des éléments eux-mêmes est par définition nulle. Les réactions suivantes sont des exemples de réaction de formation standard

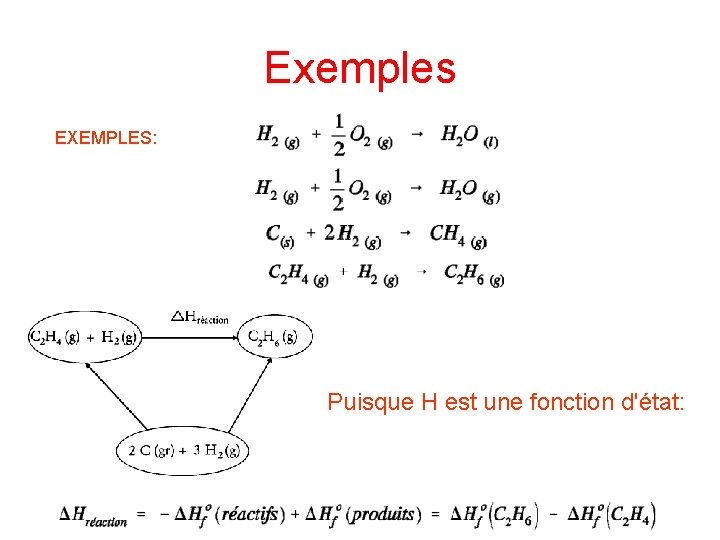
Exemples EXEMPLES: Puisque H est une fonction d'état:

Application Le nitrile acrylique est un intermédiaire dans la fabrication de la fibre synthétique Orlon. Il peut être élaborer suivant la réaction : CH 3 -CHO + HCN --> CH 3 -CHOH-CN (1) Quelle est l'enthalpie standard de cette réaction à 25°C ? On donne les enthalpies standard de formation à 25° C suivantes en k. J mol-1 : HCN -130 CH 3 -CHO -166 CH 3 -CHOH-CN -1980 CO 2 gaz -393 H 2 O liquide -285

Réponse 3 C solide + 2, 5 H 2 gaz + 0, 5 O 2+ 0, 5 N 2 --> CH 3 -CHOH-CN (2) Df. H°(2) = -1980 k. J mol-1 2 C solide + 2 H 2 gaz + 0, 5 O 2 --> CH 3 -CHO gaz (3) Df. H°(3) = -166 k. J mol-1 C solide + 0, 5 H 2+ 0, 5 N 2 --> HCN (4) Df. H°(4) = -130 k. J mol-1 (1)= (2) - (3)- (4) Dr. H°(1) = Df. H°(2) - Df. H°(3) - Df. H°(4) Dr. H°(1) = -1980 -(-166 )-(-130) = -1684 k. J mol-1.

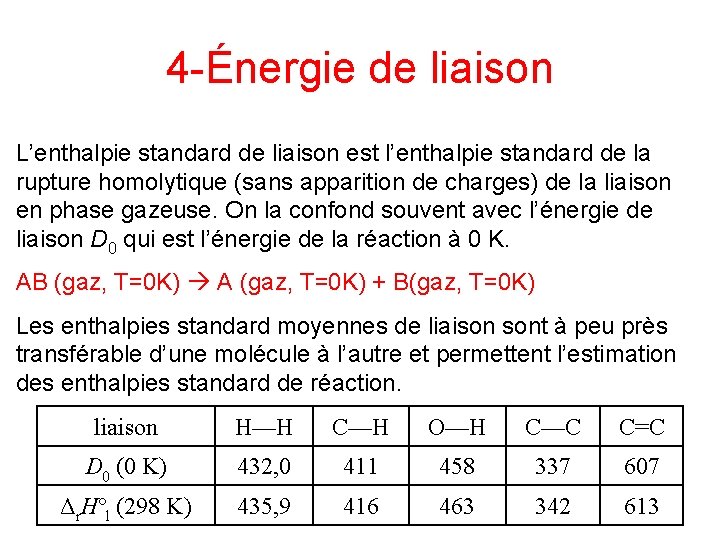
4 -Énergie de liaison L’enthalpie standard de liaison est l’enthalpie standard de la rupture homolytique (sans apparition de charges) de la liaison en phase gazeuse. On la confond souvent avec l’énergie de liaison D 0 qui est l’énergie de la réaction à 0 K. AB (gaz, T=0 K) A (gaz, T=0 K) + B(gaz, T=0 K) Les enthalpies standard moyennes de liaison sont à peu près transférable d’une molécule à l’autre et permettent l’estimation des enthalpies standard de réaction. liaison H—H C—H O—H C—C C=C D 0 (0 K) 432, 0 411 458 337 607 Δr. Hºl (298 K) 435, 9 416 463 342 613

Application: Énergie de liaison Soit la réaction d’équation : CH 4 (g) + 4 Cl 2 (g) --> CCl 4(g) + 4 HCl (g) Dr. H° = -401, 08 k. J/mol à 298 K. 1. Connaissant les enthalpies standard de formation des composés à 298 K calculer l'enthalpie standard de formation de CCl 4 (g). • En déduire l'énergie de la liaison C-Cl. • Déterminer l'enthalpie standard de formation du trichlorométhane (chloroforme) Données : DH° (C-H) = 415 k. J / mol à 298 K Enthalpie molaire de vaporisation du trichlorométhane : 30, 4 k. J/mol

Réponse CH 4 (g) + 4 Cl 2 (g) --> CCl 4(g) + 4 HCl (g) Enthalpie standard de formation CCl 4 (g): Dr. H° (298 K) = 4 Df. H° (HCl(g))+Df. H° (CCl 4(g))- 4 Df. H° (Cl 2(g))-Df. H° (CH 4(g)) Df. H° (CCl 4(g)) = Dr. H° (298 K) - 4 Df. H° (HCl(g)) + 4 Df. H° (Cl 2(g))+Df. H° (CH 4(g)) Df. H° (Cl 2(g)) = 0 corps pur simple dans son état de référence Df. H° (CCl 4(g)) = -401, 08 -4*(-92, 3) + 4*0 +(-74, 6) = -106, 48 k. J/mol.

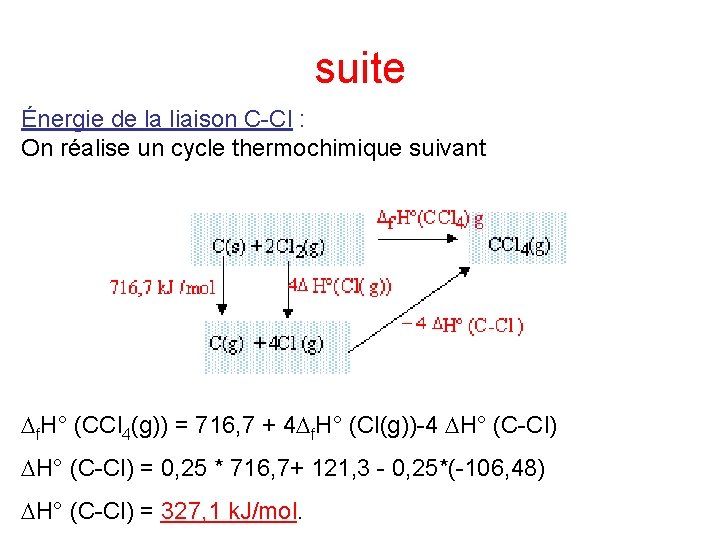
suite Énergie de la liaison C-Cl : On réalise un cycle thermochimique suivant Df. H° (CCl 4(g)) = 716, 7 + 4 Df. H° (Cl(g))-4 DH° (C-Cl) = 0, 25 * 716, 7+ 121, 3 - 0, 25*(-106, 48) DH° (C-Cl) = 327, 1 k. J/mol.

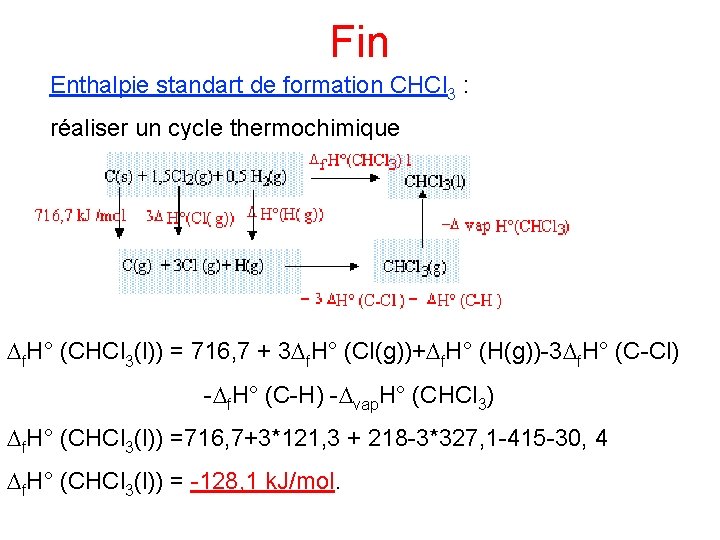
Fin Enthalpie standart de formation CHCl 3 : réaliser un cycle thermochimique Df. H° (CHCl 3(l)) = 716, 7 + 3 Df. H° (Cl(g))+Df. H° (H(g))-3 Df. H° (C-Cl) -Df. H° (C-H) -Dvap. H° (CHCl 3) Df. H° (CHCl 3(l)) =716, 7+3*121, 3 + 218 -3*327, 1 -415 -30, 4 Df. H° (CHCl 3(l)) = -128, 1 k. J/mol.

5 -Enthalpie de combustion Comme la réaction de combustion est facile à faire, on utilise les valeurs des enthalpies de combustions des composés pures pour calculer l’enthalpie de réaction. Exemple: H 2 O(l) -285. 84 combustion de l'octane : C 8 H 18 (g) + 12, 5 O 2 (g)-->8 CO 2 (g) + 9 H 2 O (g) Dr. H° comb = 9 Df. H° (H 2 O(l))+8 Df. H° CO 2 (g) - Df. H° C 8 H 18(g) Df. H° (O 2(g)) = 0 corps pur simple dans son état de référence Dr. H° comb = 9 * (-285, 84)+ 8*(-393, 5) +227, 4 = -5483 k. J/mol

Application Connaissant les enthalpies de combustion standard du butane -2877, 13 k. J mol-1 , déterminer l'enthalpie de formation du n butane. Composé H 2 O(l) CO 2(g) Df. H° (k. J/mol) -285. 84 -393 4 C solide + 5 H 2 gaz --> C 4 H 10 gaz (1) C 4 H 10 gaz + 6, 5 O 2 -->4 CO 2 + 5 H 2 O liq (2) H 2 + 0, 5 O 2 --> H 2 O liq (3) C solide + O 2 --> CO 2 (4) (1) = 4*(4) + 5*(3) - (2) DHf 0 = 4*(-393) + 5*(-285, 84) + 2877, 13 = -126 k. J mol-

6 -Énergie de résonance du benzène L’énergie de résonance est la différence entre l’énergie du benzène hypothétique de Kékulé et l’énergie du benzène réel. On va la calculer en utilisant le cycle ci-dessous.

suite L’enthalpie de formation du benzène est Δf. Hº(C 6 H 6)= 82, 93 k. J. mol− 1. On obtient donc pour l’enthalpie molaire standard de résonance : ΔHºm, rés(C 6 H 6) = 6 ΔHºm, sub(C graphite) + 3 Δr. Hºl(H 2) - 3 Δr. Hºl(C—C) - 3 Δr. Hºl(C=C) - 6 Δr. Hºl(C—H) - Δf. Hº(C 6 H 6) Numériquement : ΔHºm, rés(C 6 H 6) = 164 k. J. mol− 1.

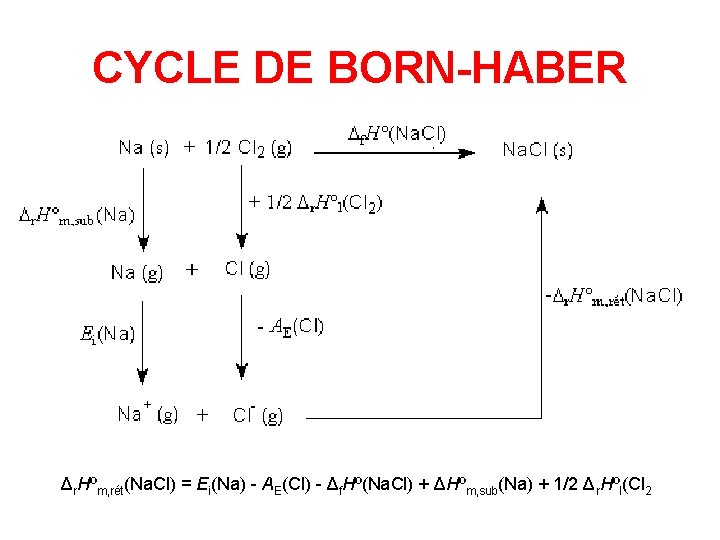
L’ÉNERGIE RÉTICULAIRE L’enthalpie standard réticulaire d’un cristal ionique est l’enthalpie standard de la réaction de dissociation du cristal ionique en ions séparés en phase gazeuse. Par exemple, pour le chlorure de sodium : Δr. Hºm, rét(Na. Cl, 298 K) L’enthalpie standard réticulaire est parfois confondue avec l’énergie réticulaire qui est l’énergie interne de la même réaction à 0 K. Pour obtenir une valeur expérimentale de l’énergie réticulaire, on utilise le cycle de Born-Haber :

CYCLE DE BORN-HABER - Δr. Hºm, rét(Na. Cl) = Ei(Na) - AE(Cl) - Δf. Hº(Na. Cl) + ΔHºm, sub(Na) + 1/2 Δr. Hºl(Cl 2

IONISATION La réaction de première ionisation d’une espèce X a pour équation : Son enthalpie molaire standard Δr. Hºm, ion(T) est souvent confondue avec l’énergie d’ionisation, notée Ei, qui est en fait l’énergie interne standard de la réaction à 0 K. X et X+ doivent être à l’état gaz. On peut ioniser X+ et obtenir une énergie de deuxième ionisation. L’énergie d’ionisation est définie positive puisque reçue par le système.

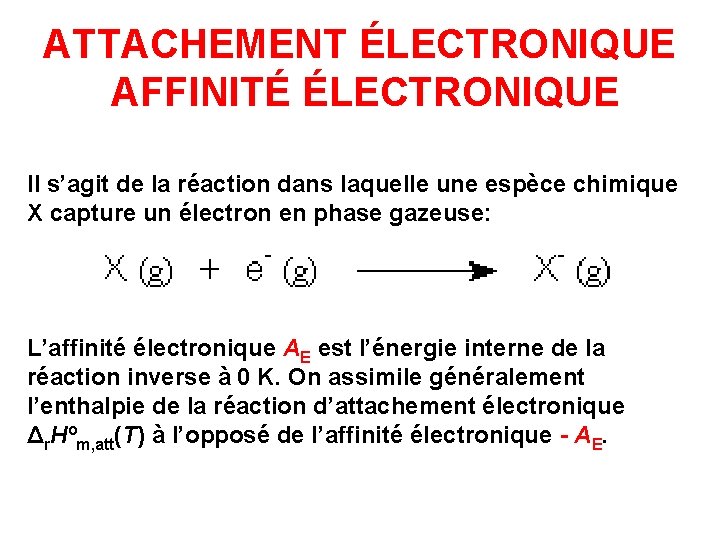
ATTACHEMENT ÉLECTRONIQUE AFFINITÉ ÉLECTRONIQUE Il s’agit de la réaction dans laquelle une espèce chimique X capture un électron en phase gazeuse: L’affinité électronique AE est l’énergie interne de la réaction inverse à 0 K. On assimile généralement l’enthalpie de la réaction d’attachement électronique Δr. Hºm, att(T) à l’opposé de l’affinité électronique - AE.

ENTROPIES et ENTHALPIE LIBRE DES RÉACTIONS CHIMIQUES Comme pour la fonction enthalpie, on utilise le fait que l’entropie est une fonction d’état, ce qui permet d’écrire : Δr. S°T = ΣST°(P) - Σ ST°(R) avec P= produits R= réactifs Δr. G°= Δr. H° - T Δr. S°
 Loi de kirchhoff thermochimie
Loi de kirchhoff thermochimie Contrat didactique définition
Contrat didactique définition Petit pays chapitre par chapitre
Petit pays chapitre par chapitre Résumé chapitre par chapitre tirez pas sur le scarabée
Résumé chapitre par chapitre tirez pas sur le scarabée Le petit prince chapitre 5
Le petit prince chapitre 5 Resume du livre le petit prince
Resume du livre le petit prince Effet de serre
Effet de serre Courbe de sécurité plongée
Courbe de sécurité plongée Effet de serre
Effet de serre Effet chélate
Effet chélate Comptabilisation tup avec effet retroactif
Comptabilisation tup avec effet retroactif Effet stochastique
Effet stochastique Effet inductif repulsif
Effet inductif repulsif Effet joule formule
Effet joule formule L'effet venturi
L'effet venturi Effet inductif et mésomère
Effet inductif et mésomère Perte par effet joule
Perte par effet joule Effet sagnac
Effet sagnac Effet ciseau
Effet ciseau Effet de serre exposé
Effet de serre exposé Effet magnus tennis
Effet magnus tennis Effet doppler
Effet doppler Effet photoélectrique
Effet photoélectrique