La nouvelle rglementation des mdicaments de thrapie innovante





















- Slides: 34

La nouvelle réglementation des médicaments de thérapie innovante Nicolas FERRY ANSM

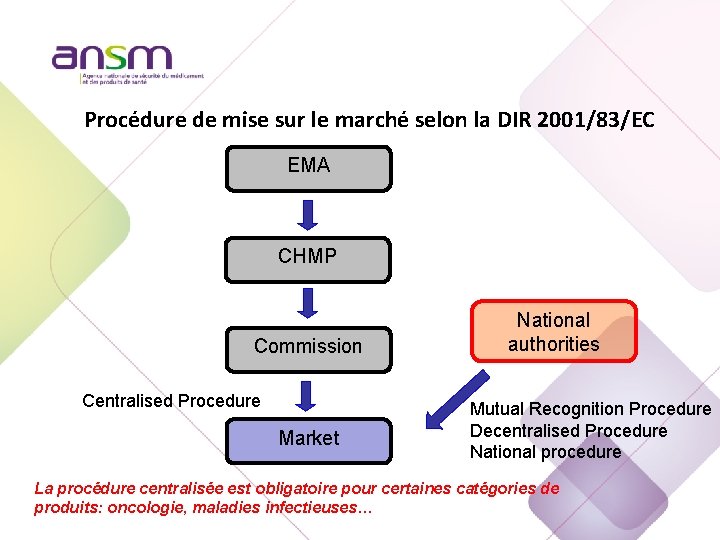
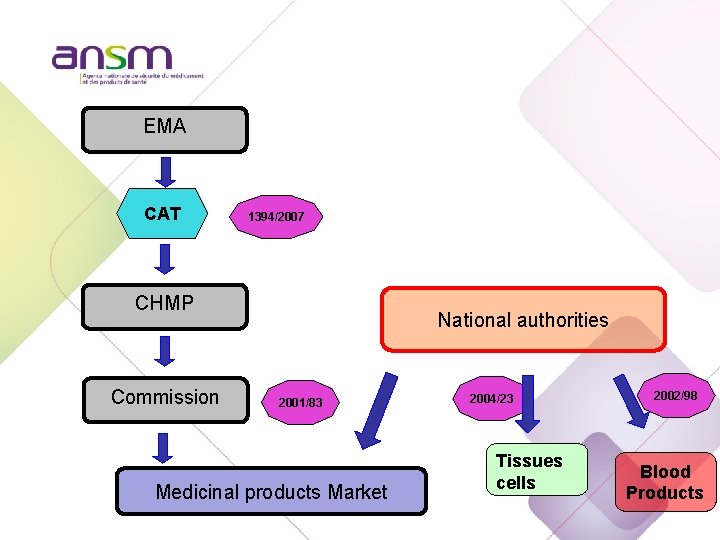
Procédure de mise sur le marché selon la DIR 2001/83/EC EMA CHMP Commission Centralised Procedure Market National authorities Mutual Recognition Procedure Decentralised Procedure National procedure La procédure centralisée est obligatoire pour certaines catégories de produits: oncologie, maladies infectieuses…

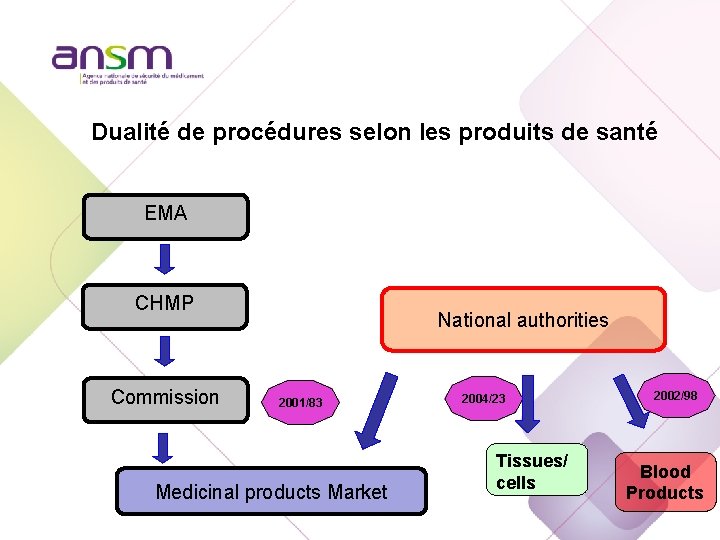
Dualité de procédures selon les produits de santé EMA CHMP Commission National authorities 2001/83 Medicinal products Market 2004/23 Tissues/ cells 2002/98 Blood Products

La réglementation des MTI (Médicaments de Thérapie Innovante) • Creation of the Committee for ATMPs (CAT) • Definition of 4 different types of ATMPS • Marketing Authorisation of ATMPs through centralised procedure

EMA CAT 1394/2007 CHMP Commission National authorities 2001/83 Medicinal products Market 2004/23 Tissues cells 2002/98 Blood Products

Definitions for gene and cell therapy

Directive 2009/120/EC

Directive 2009/120 EC


A product which may fall within the definition of a somatic cell therapy or a tissue engineered product and of a gene therapy product shall be considered as a gene therapy product

Quelles sont les manipulations non substantielles? D’après le reg 1394/2007 : • Découpage • Broyage • Centrifugation • Sterilisation • Irradiation • Separation, concentration • Cryopréservation, congélation

Les manipulations substantielles? Certaines manipulations sont généralement considérées comme substantielles par le CAT: • Culture • Transfert de gènes

Tissue engineered product: • Contains engineered cells or tissues and • is intended to regenerate, repair or replace a human tissue (engineered also meaning not intended to be used for the same essential function in the recipient as in the donor) Combined advanced therapy medicinal product: • Incorporate medical device (Dir 93/42/EEC) or active implantable medical device (Dir 90/385/EEC) and • A cellular or tissue part containing viable cells or tissues or • The cellular or tissue part containing non viable cells or tissues must be liable to act primary to the device referred to.

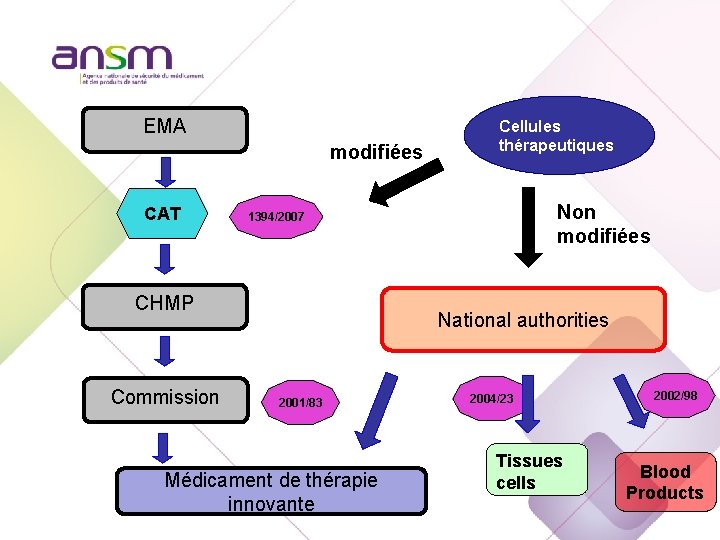
EMA modifiées CAT Non modifiées 1394/2007 CHMP Commission Cellules thérapeutiques National authorities 2001/83 Médicament de thérapie innovante 2004/23 Tissues cells 2002/98 Blood Products

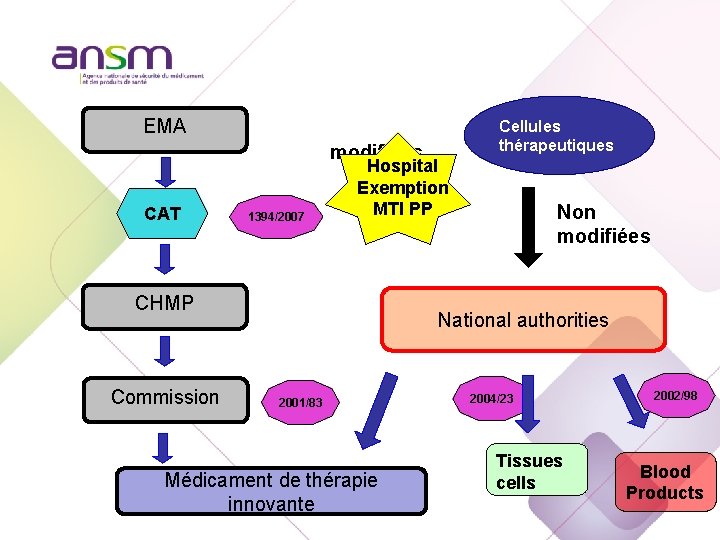
EMA modifiées CAT 1394/2007 Hospital Exemption MTI PP CHMP Commission Cellules thérapeutiques Non modifiées National authorities 2001/83 Médicament de thérapie innovante 2004/23 Tissues cells 2002/98 Blood Products

Hospital Exemption MTI PP Art 28 Reg 1394/2007/EC « médicaments de thérapie innovante, tels que définis dans le règlement (CE) no 1394/2007, préparés de façon ponctuelle, selon des normes de qualité spécifiques, et utilisés au sein du même État membre, dans un hôpital, sous la responsabilité professionnelle exclusive d’un médecin, pour exécuter une prescription médicale déterminée pour un produit spécialement conçu à l’intention d’un malade déterminé »

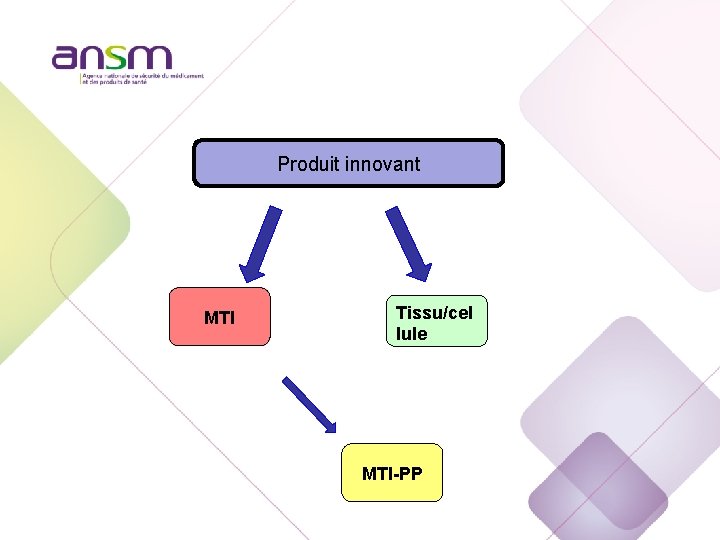
Produit innovant MTI Tissu/cel lule MTI-PP

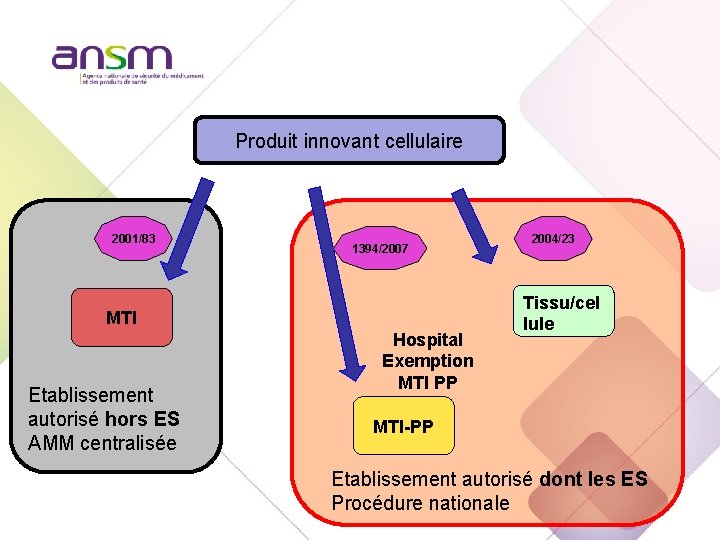
Produit innovant cellulaire 2001/83 1394/2007 MTI Etablissement autorisé hors ES AMM centralisée Hospital Exemption MTI PP 2004/23 Tissu/cel lule MTI-PP Etablissement autorisé dont les ES Procédure nationale

La réglementation française Loi du 22 mars 2011 Création de nouveaux établissements autorisés pour la fabrication des MTI l Création d’une nouvelle catégories de médicaments: les MTI PP l Décret du 6 novembre 2012 Arrêté du 4 février 2013 l Format de dossier pour les établissements fabricant des MTI-PP

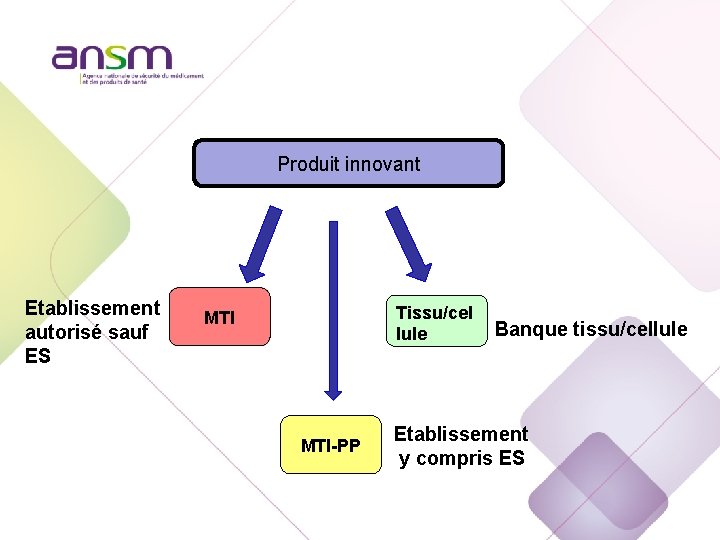
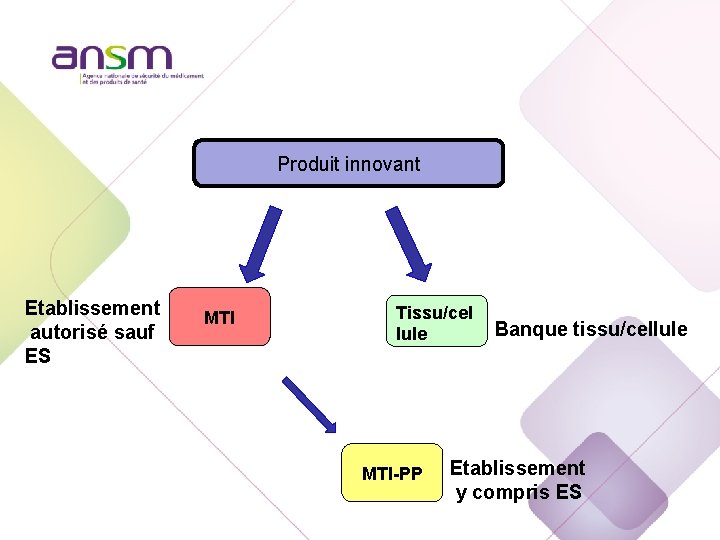
Produit innovant Etablissement autorisé sauf ES Tissu/cel lule MTI-PP Banque tissu/cellule Etablissement y compris ES

Quelques rappels importants: La distinction entre MTI et PTC peut être réalisée par le CAT de l’EMA dont c’est un des rôles (art 17 REG 1394/2007) 2. Un MTI-PP est d’abord un MTI et doit répondre à la définition des MTI 3. La réglementation MTI-PP est une “exemption“ 1.

Essais cliniques (Dir 2001/20/EC) Pour les essais cliniques, les médicaments doivent être fabriqués selon les Bonnes Pratiques de Fabrication, donc dans des établissements autorisés selon la réglementation française

- Quelques exemples

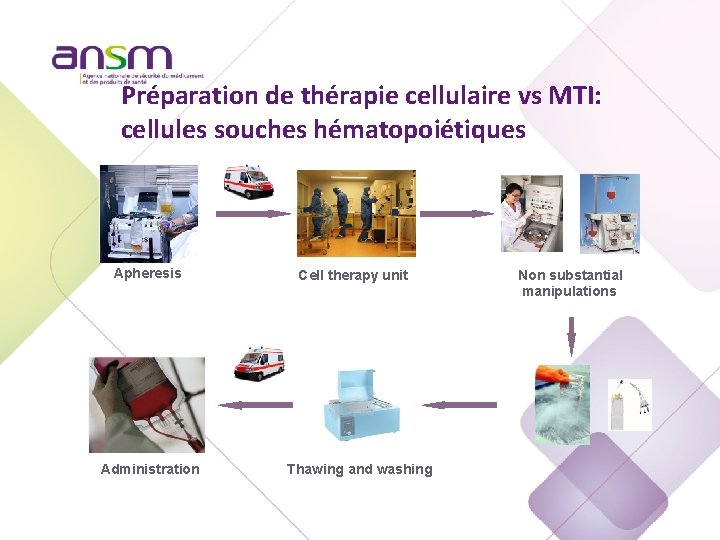
Préparation de thérapie cellulaire vs MTI: cellules souches hématopoiétiques Apheresis Administration Cell therapy unit Thawing and washing Non substantial manipulations

Préparation de thérapie cellulaire vs MTI: tri cellulaire ü Product consisting of naturally occurring antigen-specific CD 8+ donor lymphocytes isolated with streptamers ü Intended for the treatment of infectious diseases ü Not an ATMP CAT decision 26/01/2010

Préparation de thérapie cellulaire vs MTI: tri cellulaire ü Product consisting of naturally occurring antigen-specific CD 8+ donor lymphocytes isolated with anti IFNg selection after short activation ü Intended for the treatment of infectious diseases ü ATMP

Préparation de thérapie cellulaire vs MTI: CD 34 usage non homologue ü Bone marrow-derived autologous CD 34 cells ü Intended for improvement of heart function in patients with refractory angina and chronic myocardial ischemia ü Tissue-engineered product ü 22/03/2012

Fraction stroma-vasculaire Autologous, non-manipulated lipoaspirate containing adipocytes and stromal vascular fraction ü intended to act as a natural autologous lipofiller ü Not ATMP ü 31/05/2012 ü

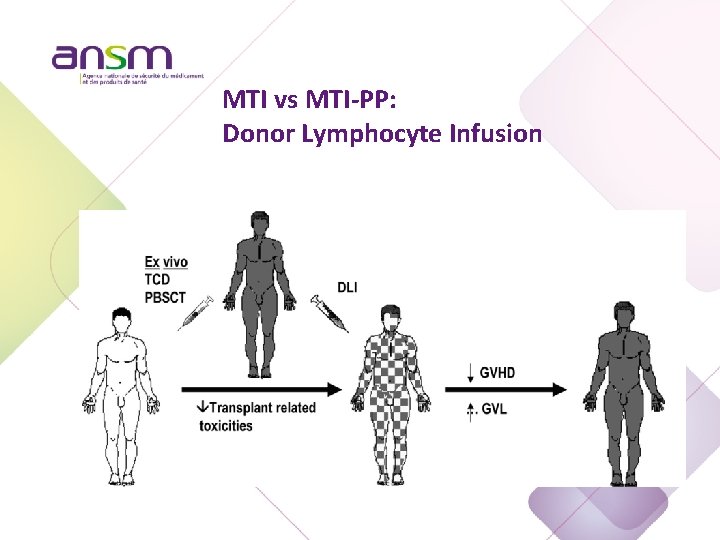
MTI vs MTI-PP: Donor Lymphocyte Infusion

Critères de l’exemption hospitalière ü ü ü Préparation ponctuelle (non industrielle) Produit conçu pour un malade déterminé Utilisé dans un hôpital sous la responsabilité d’un médecin Fabriqué selon BPF ou BP spécifiques Peut être fabriqué dans un établissement de soins

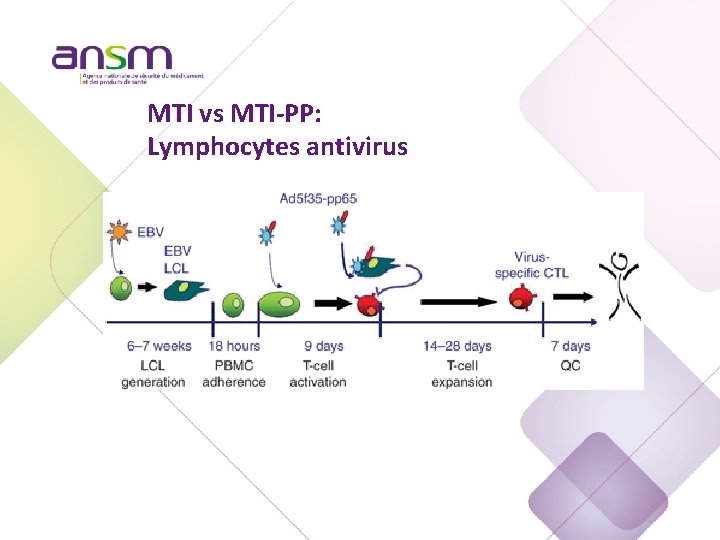
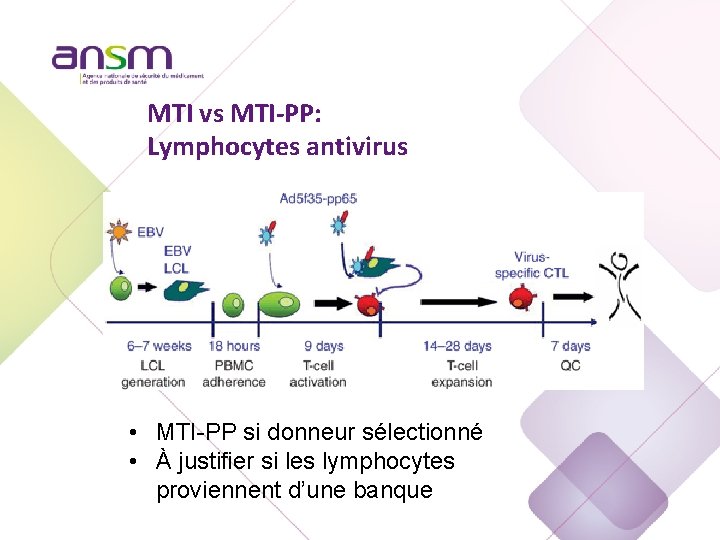
MTI vs MTI-PP: Lymphocytes antivirus

MTI vs MTI-PP: Lymphocytes antivirus • MTI-PP si donneur sélectionné • À justifier si les lymphocytes proviennent d’une banque

Produit innovant Etablissement autorisé sauf ES MTI Tissu/cel lule MTI-PP Banque tissu/cellule Etablissement y compris ES

CONCLUSIONS Il est important de bien classer le produit dès le stade des essais cliniques • Le classement va impacter le développement futur du produit • Ne pas hésiter à demander un avis à l’ANSM ou à l’EMA (CAT) en cas de doute •
 Thrapie
Thrapie Des des des
Des des des Le texte narratif tronc commun
Le texte narratif tronc commun Nouvelle gestion publique
Nouvelle gestion publique Realism, french new wave
Realism, french new wave Fiche de lecture ficelle
Fiche de lecture ficelle Euroregion nouvelle aquitaine euskadi
Euroregion nouvelle aquitaine euskadi La nouvelle vague
La nouvelle vague Nouvelle-caldonie
Nouvelle-caldonie Lnc cergy
Lnc cergy Images de ballon de foot
Images de ballon de foot Pass nouvelle aquitaine
Pass nouvelle aquitaine Corevih nouvelle aquitaine
Corevih nouvelle aquitaine Dup nouvelle formule
Dup nouvelle formule La nouvelle réaliste tronc commun
La nouvelle réaliste tronc commun Ligue nouvelle aquitaine badminton
Ligue nouvelle aquitaine badminton Les caractéristiques de la nouvelle fantastique
Les caractéristiques de la nouvelle fantastique Subsumption example
Subsumption example Indirect object pronouns continued
Indirect object pronouns continued Insuline naaldverwijderaar
Insuline naaldverwijderaar Aster de nouvelle angleterre
Aster de nouvelle angleterre C'est une bien triste nouvelle
C'est une bien triste nouvelle Une nouvelle réaliste définition
Une nouvelle réaliste définition Une sacrée nouvelle
Une sacrée nouvelle Nouvelle france flag
Nouvelle france flag Double des and triple des
Double des and triple des La diffusion des idées des lumières
La diffusion des idées des lumières Cartographie des flux de valeur
Cartographie des flux de valeur Diversification des espaces et des acteurs de la production
Diversification des espaces et des acteurs de la production Budget des ventes méthode des moindres carrés
Budget des ventes méthode des moindres carrés Il existe des personnes qui sont des lumières pour tous
Il existe des personnes qui sont des lumières pour tous Je t'offrirai des fleurs et des nappes en couleurs
Je t'offrirai des fleurs et des nappes en couleurs Le volume d'un corps
Le volume d'un corps Modes temps et valeurs
Modes temps et valeurs Robin des bois des alpes
Robin des bois des alpes