Introduo aos Mtodos Instrumentais de Anlise Etapas de

































- Slides: 37

Introdução aos Métodos Instrumentais de Análise

Etapas de Análise Química • • 1. Coleta de amostra: amostragem; 2. Preparo da amostra; 3. Preparo do extrato; 4. Análise do analito/composto de interesse. – Gravimetria; – Volumetria; – Instrumental ou Físico-químico.

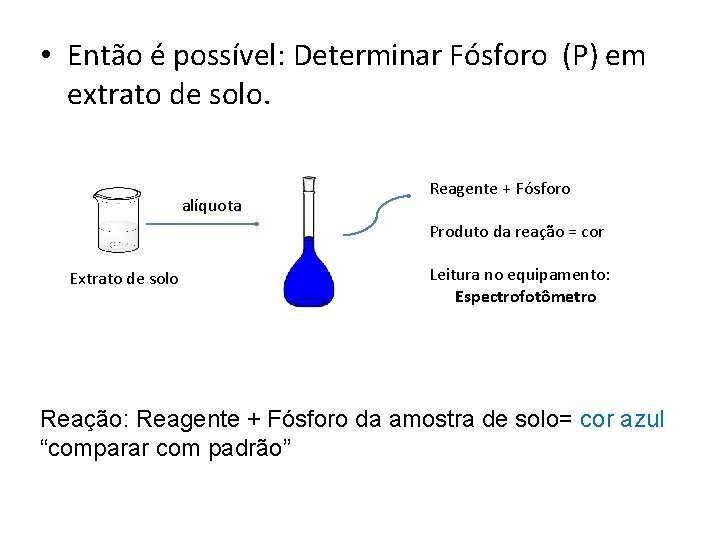
Aula de Hoje: Método Instrumental • Determinação de Fósforo (P- macronutriente) em extrato de solo. alíquota Reagente + Fósforo Produto da reação = cor Extrato de solo Leitura no equipamento: Espectrofotômetro

FUNÇÕES DO P NA PLANTA • o fósforo no solo é indispensável para o crescimento e produção vegetal. • Interfere nos processos de fotossíntese, respiração, armazenamento e transferência de energia, divisão celular, crescimento das células. • Contribui para o crescimento prematuro das raízes, qualidade de frutas, verduras, grãos e formação das sementes. Por interferir em vários processos vitais das plantas, deve haver um suprimento adequado de fósforo desde a germinação, principalmente em plantas de ciclo curto. • O fósforo, na planta, apresenta uma grande mobilidade. As plantas quando jovens absorvem maiores quantidades de fósforo ocorrendo um crescimento rápido e intenso das raízes em ambientes com níveis adequados do nutriente.

• Espectrofotometria (técnica): é o método de análises óptico mais usado nas investigação biológicas e físico-químicas. • Espectrofotômetro (equipamento): é um instrumento óptico utilizado para medir propriedades da luz em uma determinada faixa de espectro eletromagnético.

Espectrofotômetro: • Permite comparar a radiação absorvida por uma solução que contém uma quantidade desconhecida de soluto com uma solução que contenha uma quantidade conhecida do mesmo soluto (padrão).




INTRODUÇÃO A ESPECTROSCOPIA • A energia radiante, ou radiação eletromagnética se origina da desaceleração de partículas eletricamente carregadas constituídas de uma determinada fonte, que quando emitida se propaga no meio em todas as direções. As radiações eletromagnéticas ora se manifestam como onda e ora como um conjunto de “pacotes de energia”- os fótons.

• INTRODUÇÃO A ESPECTROSCOPIA • A luz é uma forma de radiação eletromagnética que são ondas que se autopropagam pelo espaço, algumas das quais são percebidas pelo olho humano. A radiação eletromagnética compõe-se de um campo elétrico (E) e um magnético (B), que oscilam perpendicularmente um ao outro na direção da propagação de energia. • A luz interage com a matéria e como isto pode ser usado para extrair informação sobre moléculas biológicas.





• LEI DE BEER (1852) observou a relação existente entre a transmissão e a concentração do meio onde passa o feixe de luz. Uma certa solução absorve a luz proporcionalmente à concentração molecular do soluto que nela encontra. • LEI DE LAMBERT (1870) observou a relação entre a transmissão de luz e a espessura da camada do meio absorvente. Quando um feixe de luz monocromática, atravessava um meio transparente homogêneo, cada camada deste meio absorvia igual a fração de luz que atravessava, independentemente da intensidade da luz que incidia.



*Quando o elétron volta ao seu estado fundamental, emite energia no mesmo comprimento de onda em que foi excitado: detecção no aparelho.

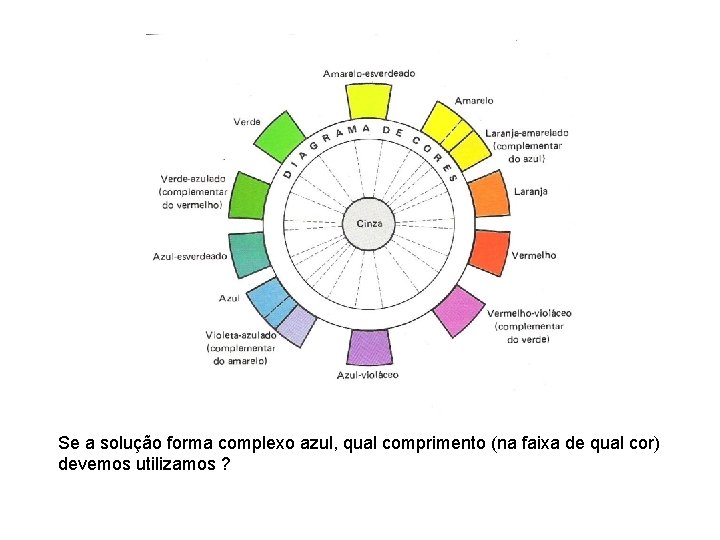
• A interação da matéria com radiações de comprimento de onda entre 450 a 750 nm se manifesta através das cores. A cor observada é a fração da luz visível que ela não absorve.


Se a solução forma complexo azul, qual comprimento (na faixa de qual cor) devemos utilizamos ?

• Ou seja: • Se a solução forma complexo azul, qual comprimento utilizamos ? R: o que se refere a cor complementar- Amarelo 640 nm


Revisando. . Se o Espectrofotômetro: • Permite comparar a radiação absorvida por uma solução que contém uma quantidade desconhecida de soluto (ou analítico especifico) com uma solução que contenha uma quantidade conhecida do mesmo soluto (padrão).

• Então é possível: Determinar Fósforo (P) em extrato de solo. alíquota Reagente + Fósforo Produto da reação = cor Extrato de solo Leitura no equipamento: Espectrofotômetro Reação: Reagente + Fósforo da amostra de solo= cor azul “comparar com padrão”

• Reação para formar complexo azul H 2 PO 4 - (ortofosfato) + 12 Mo. O 4 2 - (molibdato) + 24 H+ (ácido) (ácido 12 -molibdofosfórico, “amarelo”) + 12 H 2 O H 2 PO 4 (Mo. O 3)12 3 - + ácido ascorbico complexo azul H 2 PO 4 (Mo. O 3)12 3 -

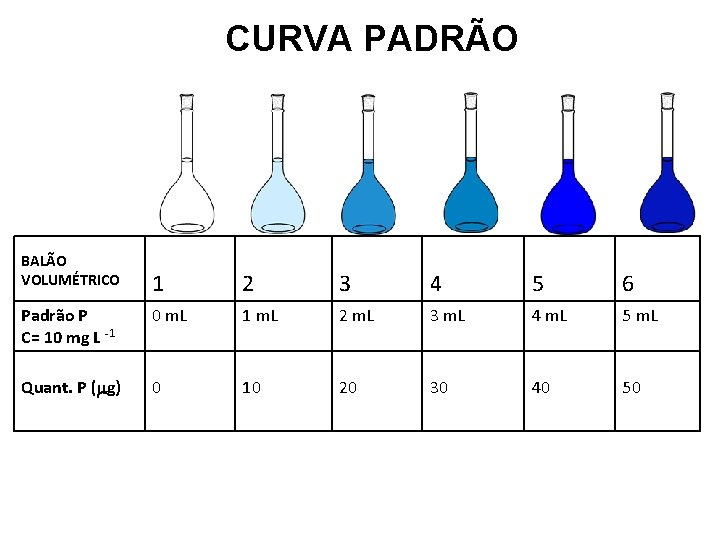
CURVA PADRÃO BALÃO VOLUMÉTRICO 1 2 3 4 5 6 Padrão P C= 10 mg L -1 0 m. L 1 m. L 2 m. L 3 m. L 4 m. L 5 m. L Quant. P (mg) 0 10 20 30 40 50

Leitura dos padrões no espectrofotômetro


Roteiro da aula 9 Nome: no USP: TURMA: Bancada: Título: Determinação do fósforo solúvel em solos pela técnica de espectrometria de absorção molecular (método “azul de molibdênio”) Objetivos: Introdução: Material Utilizado:

Procedimentos 1. Estabelecimento da curva padrão 1. 1. Transferir 0, 1, 2, 3, 4, 5 m. L da solução padrão de P de 10 mg L-1 para balões volumétricos de 50 m. L por meio de bureta de 10 m. L. Em cada balão de 50 m. L a quantidade de P presente será respectivamente, 0; 10; 20; 30; 40; 50 µg de P. 1. 2. Adicionar a todos os balões 20 m. L de solução de H 2 SO 4 0, 025 mol L-1. 1. 3. Adicionar 5 m. L do reativo sulfo–bismuto–molíbdico e 1 m. L de solução de ácido ascórbico à 30 g L-1, agitando após adição de cada reativo. 1. 4. Completar o volume dos balões volumétricos com água destilada e homogeneizar. Aguardar 15 minutos. 1. 5. Transferir as soluções para cubetas do espectrofotômetro e fazer a leitura contra a prova em branco usando o comprimento de onda de 640 nanômetros.

2. Procedimento para preparo do extrato (Etapa já realizada em aula anterior): 2. 1. Transferir 5 cm 3 da amostra de solo para Erlenmeyer de 250 m. L. 2. 2. Adicionar 100 ml de solução de H 2 SO 4 0, 025 mol L-1, agitar durante 15 minutos em agitador mecânico e filtrar através de papel de filtro Whatman no 1 para frasco limpo e seco.

3. Preparo da solução para determinação de P (Etapas a serem realizadas): 3. 1. Transferir uma alíquota da amostra (A = 10 m. L); (B = 20 m. L); (C = 10 m. L) e (D = 20 m. L), do extrato obtido para balão volumétrico de 50 m. L. 3. 2. Deste ponto em diante, proceder como foi descrito para obtenção da curva padrão a partir do item 1. 3.

Resultados • Calcular a quantidade de P presente no solo em mg Kg-1 e mg dm-3 para as amostras A, B, C e D. Fazer uma tabela cada cd amostra. Fosforo (P) Solo mg cm 3 mg dm 3 g Kg • Conclusão Faça a interpretação do solo baseando-se nos valores da tabela.

USAR ESTES DADOS NOS CÁLCULOS: Dados Obtidos: Equação da reta: y= 0, 0077 x + 0, 0113 Valores de Absorbância Obtidos Amostras A= 0, 085 B= 0, 171 C=0, 186 D= 0, 342 Dados: • Densidade do solo • Solos A e C = 1, 2 g cm-3 • Solos B e D = 1, 4 g cm-3

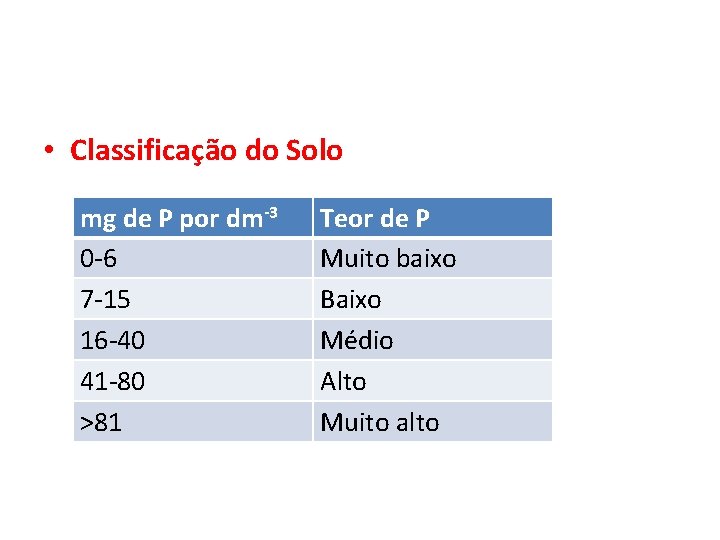
• Classificação do Solo mg de P por dm-3 0 -6 7 -15 16 -40 41 -80 >81 Teor de P Muito baixo Baixo Médio Alto Muito alto
 Anlise swot
Anlise swot Atividades instrumentais de vida diária
Atividades instrumentais de vida diária Pelotas
Pelotas Conceito de autarquia
Conceito de autarquia Mtodos
Mtodos Mtodos
Mtodos Mtodos
Mtodos Método del ritmo para no quedar embarazada
Método del ritmo para no quedar embarazada Mtodos
Mtodos Gynefix diu
Gynefix diu Mtodos
Mtodos Mtodos
Mtodos Mtodos
Mtodos Mtodos
Mtodos Khan's tutorial scandal
Khan's tutorial scandal Equilibrio arquitetura
Equilibrio arquitetura Aos dana ancient ireland
Aos dana ancient ireland Setsuyaku
Setsuyaku Atenha-se aos enunciados cujo intuito é analisar
Atenha-se aos enunciados cujo intuito é analisar Não vades aos gentios
Não vades aos gentios Ato penitencial senhor que sois o defensor dos pobres
Ato penitencial senhor que sois o defensor dos pobres Consolai-vos uns aos outros
Consolai-vos uns aos outros Capitulo 3 sermao de santo antonio aos peixes
Capitulo 3 sermao de santo antonio aos peixes Aos 60
Aos 60 Nao recorram aos mediuns
Nao recorram aos mediuns Amai vos uns aos outros assim como eu vos amei
Amai vos uns aos outros assim como eu vos amei Penyajian wajar laporan keuangan
Penyajian wajar laporan keuangan Estrutura interna do sermão de santo antónio aos peixes
Estrutura interna do sermão de santo antónio aos peixes Poema a un amigo jorge luis borges
Poema a un amigo jorge luis borges Aos.wisc.edu
Aos.wisc.edu A santidade cristã é oposta aos costumes dos gentios
A santidade cristã é oposta aos costumes dos gentios George‚äôs gyros
George‚äôs gyros Sermão de santo antónio aos peixes análise da obra
Sermão de santo antónio aos peixes análise da obra Jueces 6:7
Jueces 6:7 Características da carta aos efésios
Características da carta aos efésios Standard form parabola
Standard form parabola Aos 50
Aos 50 Aos 30
Aos 30