Grupo 2 A Metales alcalinotrreos Propiedades generales de




![Propiedades del Berilio. Número atómico 4 Configuración electrónica. [He] 2 S 2 Radio atómico/ Propiedades del Berilio. Número atómico 4 Configuración electrónica. [He] 2 S 2 Radio atómico/](https://slidetodoc.com/presentation_image_h/a365f2371583048d3976daa3d6fc7444/image-5.jpg)





![Propiedades del magnesio. Numero atómico. 12 Configuración electrónica. [Ne] 3 S 2 Radio atómico/ Propiedades del magnesio. Numero atómico. 12 Configuración electrónica. [Ne] 3 S 2 Radio atómico/](https://slidetodoc.com/presentation_image_h/a365f2371583048d3976daa3d6fc7444/image-11.jpg)





![Propiedades del Ca. Número atómico 20 Configuración electrónica. [Ar] 4 S 2 Radio Propiedades del Ca. Número atómico 20 Configuración electrónica. [Ar] 4 S 2 Radio](https://slidetodoc.com/presentation_image_h/a365f2371583048d3976daa3d6fc7444/image-19.jpg)




![Propiedades del Sr. Número atómico 38. Configuración electrónica. [Kr] 5 S 2 Radio Propiedades del Sr. Número atómico 38. Configuración electrónica. [Kr] 5 S 2 Radio](https://slidetodoc.com/presentation_image_h/a365f2371583048d3976daa3d6fc7444/image-24.jpg)




![Propiedades del Bario. Numero atómico. 56 Configuración electrónica. [Xe] 6 S 2 Radio atómico/ Propiedades del Bario. Numero atómico. 56 Configuración electrónica. [Xe] 6 S 2 Radio atómico/](https://slidetodoc.com/presentation_image_h/a365f2371583048d3976daa3d6fc7444/image-29.jpg)




![Propiedades del Radio. Numero atómico. 88 Configuración electrónica. [Rn] 7 S 2 Radio atómico/ Propiedades del Radio. Numero atómico. 88 Configuración electrónica. [Rn] 7 S 2 Radio atómico/](https://slidetodoc.com/presentation_image_h/a365f2371583048d3976daa3d6fc7444/image-35.jpg)



- Slides: 38

Grupo 2 A Metales alcalinotérreos

Propiedades generales de los alcalinotérreos. Sólidos a temperatura ambiente Propiedades metálicas típicas Más electronegativos que los metales alcalinos Más densos que los metales alcalinos Más duros que los metales alcalinos Los compuestos que forman son predominantemente iónicos (a excepción del Be)

Métodos de Obtención Existen dos métodos fundamentales de obtención: �Electrólisis de sus haluros fundidos: MX 2(l) —> M(l) + X 2(g). �Reducción de sus óxidos con carbono: MO(s) + C(s) —> M(s) + CO(g)

Berilio.
![Propiedades del Berilio Número atómico 4 Configuración electrónica He 2 S 2 Radio atómico Propiedades del Berilio. Número atómico 4 Configuración electrónica. [He] 2 S 2 Radio atómico/](https://slidetodoc.com/presentation_image_h/a365f2371583048d3976daa3d6fc7444/image-5.jpg)
Propiedades del Berilio. Número atómico 4 Configuración electrónica. [He] 2 S 2 Radio atómico/ (A) 0. 90 Radio Iónico/ pm 31 900 1. 57 1. 85 1280 321 1° Energía de ionización /Kjmol-1 Electronegatividad Densidad /g cm-3 Punto de fusión /° C H sub/ KJ mol-1

Minerales que contienen Berilio. � El mineral principal del cual se extrae el metal es el mineral berilio Be 3 Al 2(Si. O 3)6 . � También existe como bertrandita, [Be 4(Si. O 4)2. H 2 O], crisoberilo [Be. O. Al 2 O 3] y fenaquita [Be 2 Si. O 4]. � La esmeralda y el aguamarina son dos piedras preciosas de berilio con impurezas de Cr 3+ y Fe 3+.

Método de extracción Se calienta el mineral berilio con hexafluorosilicato de sodio, Na 2 Si. F 6 para producir Be. F 2, este a su vez se reduce al elemento por medio de magnesio. Mediante electrólisis de Na 2 Be. F 4

Toxicidad Tanto el berilio como sus aleaciones son tóxicas. Las sales solubles de berilio son altamente toxicas (causan problemas en los pulmones, beriliosis) por lo que se han restringido sus aplicaciones industriales.

Usos del Berilio. El principal uso del berilio metálico se encuentra en la manufactura de aleaciones berilio-cobre y en el desarrollo de materiales moderadores y reflejantes para reactores nucleares. El berilio tiene muchos usos en la energía nuclear porque es uno de los materiales más eficientes para disminuir la velocidad de los neutrones, así como para reflejarlos.

Magnesio.
![Propiedades del magnesio Numero atómico 12 Configuración electrónica Ne 3 S 2 Radio atómico Propiedades del magnesio. Numero atómico. 12 Configuración electrónica. [Ne] 3 S 2 Radio atómico/](https://slidetodoc.com/presentation_image_h/a365f2371583048d3976daa3d6fc7444/image-11.jpg)
Propiedades del magnesio. Numero atómico. 12 Configuración electrónica. [Ne] 3 S 2 Radio atómico/ (A) 1. 30 Radio Iónico/ pm 65 736 1. 31 1. 74 650 1° Energía de ionización /Kjmol-1 Electronegatividad Densidad /g cm-3 Punto de fusión /° C H sub/ KJ mol-1

Minerales que contienen Magnesio. Magnesita (Mg. CO 3) Dolomita Epsomita Serpentina [Mg 3(Si 2 O 5)(OH)4] Olivino Esteatita (Mg. Si. O 3) Talco [Mg 3(Si 4 O 10)(OH)2]

Métodos de obtención. Electrólisis : Mg. Cl 2 fundido Ca. Cl 2 Na. Cl (700 -720ºC) Mg. Cl 2 Mg +2 + 2 Cl • con

Aplicaciones. �El Mg. SO 4 es muy soluble en agua y se emplea en la industria textil, papelera, como laxante y como abono �El magnesio da origen a los llamados "compuestos de Grignard”. �Es utilizado en aleaciones ligeras, materiales útiles para: construcciones aeronáuticas, automóviles y construcción de misiles

El Mg(OH)2 es muy insoluble en agua y ligeramente básico, se utiliza para tratar la acidez de estomago.

Curiosidades. El Magnesio tiene baja toxicidad y no es considerado como peligroso para la salud, no obstante, el polvo de magnesio puede irritar las membranas mucosas o el tracto respiratorio superior. La producción mundial estimada de magnesio fue de 350 000 toneladas. El magnesio sin alear se utiliza en flashes fotográficos, bombas incendiarias y señales luminosas. El magnesio aleado con aluminio o cobre en fundición se utiliza en piezas de aviones.

Propiedades físicas Estado de la materia: Sólido Punto de fusión: 1115 K Punto de ebullición: 1757 K Entalpía de vaporización: 153, 6 k. J/mol Entalpía de fusión: 8, 54 k. J/mol Estructura cristalina: Cúbica centrada en las caras

Método de Obtención. �Electrólisis del cloruro de calcio: (ánodo) Reacción de oxidación: 2 Cl- + 2 e– Cl 2 (cátodo) Reacción de reducción: Ca 2+ + 2 e– Ca
![Propiedades del Ca Número atómico 20 Configuración electrónica Ar 4 S 2 Radio Propiedades del Ca. Número atómico 20 Configuración electrónica. [Ar] 4 S 2 Radio](https://slidetodoc.com/presentation_image_h/a365f2371583048d3976daa3d6fc7444/image-19.jpg)
Propiedades del Ca. Número atómico 20 Configuración electrónica. [Ar] 4 S 2 Radio atómico/ (A) 1. 74 Radio Iónico/ pm 99 590 1 1. 54 850 193 1° Energía de ionización /Kjmol-1 Electronegatividad Densidad /g cm-3 Punto de fusión /° C H sub/ KJ mol-1

Características. Es menos reactivo que otros de los metales alcalinotérreos. Se encuentra en prácticamente todas las zonas terrestres del mundo. El Ca es el quinto elemento en abundancia en la corteza terrestre: grandes depósitos minerales como Ca. CO 3. También se encuentra como fluorita (Ca. F 2), calcita, aragonito (Ca. CO 3), y fluoroapatita(3 Ca 3(PO 4)2·Ca. F 2).

Entre los minerales que lo contienen destacan: Piedra caliza (Ca. CO 3 ), calcita, mármol Anhidrita (Ca. SO 4), Yeso Ca. SO 4· 2 H 2 O Fluorofosfato de calcio (Apatita) Ca 5(PO 4)3 F Óxido de calcio y magnesio (Ca. O), (Ca. Mg. O 2)

Datos curiosos. El consumo de más de 2. 5 g de calcio al día sin una causa médica puede llevar al desarrollo de piedras en los riñones, esclerosis y problemas en los vasos sanguíneos. La falta de calcio es una de las causas principales de la osteoporosis. A las mujeres se les recomienda aumentar el consumo de calcio para disminuir la depresión post- parto. Cosas roban calcio: Falta de ejercicio, consumo excesivo de tabaco y bebida. � La tortilla tiene más calcio que la leche. � El esqueleto humano contiene 1 kilo de calcio.

Estroncio
![Propiedades del Sr Número atómico 38 Configuración electrónica Kr 5 S 2 Radio Propiedades del Sr. Número atómico 38. Configuración electrónica. [Kr] 5 S 2 Radio](https://slidetodoc.com/presentation_image_h/a365f2371583048d3976daa3d6fc7444/image-24.jpg)
Propiedades del Sr. Número atómico 38. Configuración electrónica. [Kr] 5 S 2 Radio atómico/ (A) 1. 92 Radio Iónico/ pm 113 548 0. 95 2. 62 768 164 1° Energía de ionización /Kjmol-1 Electronegatividad Densidad /g cm-3 Punto de fusión /° C H sub/ KJ mol-1

Recibe el nombre de una aldea escocesa “Strontian” • Metal ligero, blanco plateado. • Se encuentra en la naturaleza como carbonato de estroncio Sr. CO 3 (estroncionita) y como sulfato de estroncio Sr. SO 4 (celestita). • Se extrae por medio de la electrolisis del Sr. Cl 2 , fundido por reducción del Sr. O con el aluminio • El estroncio reacciona de manera vigorosa con el agua y en forma de polvo finamente dividido se enciende en el aire •

Aplicaciones �Se utiliza para pirotecnia El carbonato de estroncio se usa para producir una coloración roja al formarse Sr. Cl 2. �Para bengalas de emergencia. El nitrato de estroncio se mezcla con aserrín, ceras, azufre y KCl. O 4 y se empacan en un tubo impermeable • El Titanato de estroncio Sr. Ti. O 3, se emplea para fabricar gemas artificiales

Datos curiosos. El estroncio se encuentra principalmente en los cereales, vegetales de principalmente hojas y productos lácteos El único compuesto de Sr que es considerado peligroso para la salud humana, incluso en pequeñas cantidades, es el cromato de estroncio, conocido por causar cáncer de pulmón.

Bario.
![Propiedades del Bario Numero atómico 56 Configuración electrónica Xe 6 S 2 Radio atómico Propiedades del Bario. Numero atómico. 56 Configuración electrónica. [Xe] 6 S 2 Radio atómico/](https://slidetodoc.com/presentation_image_h/a365f2371583048d3976daa3d6fc7444/image-29.jpg)
Propiedades del Bario. Numero atómico. 56 Configuración electrónica. [Xe] 6 S 2 Radio atómico/ (A) 1. 98 Radio Iónico/ pm 135 1° Energía de ionización /Kjmol-1 502 0. 89 3. 51 714 176 Electronegatividad Densidad /g cm-3 Punto de fusión /° C H sub/ KJ mol-1

Reactividad. Con aire: Vigorosa; con calor Ba. O ; Ba 2 N 3 Con H 2 O: Vigorosa; H 2 ; Ba(OH)2 Con HCl 6 M: Vigorosa; H 2 ; Ba. Cl 2 Con HNO 3 15 M: Suave; Ba(NO 3)2 Con Na. OH 6 M: Se vuelve pasivo

Obtención. Se extrae por electrólisis de una disolución de su cloruro usando cátodo de mercurio y destilando en el vacío la amalgama formada. También se extrae por electrólisis del cloruro fundido y por reducción del Ba. O con aluminio.

Datos curiosos. El Bario se encuentra en altas cantidades en los frutos secos, algas, pescados y ciertas plantas. La toma de gran cantidad de Bario que es soluble puede causar parálisis y en algunos casos incluso la muerte. Pequeñas cantidades de Bario soluble en agua puede causar en las personas dificultad al respirar, incremento de la presión sanguínea, dolor de estómago, debilidad en los músculos, cambios en los reflejos nerviosos, inflamación del cerebro y el hígado.

Tiene pocos usos: eliminar trazas de gases en tubos de vacío y televisión ("getter"). Piedras de mechero, ya que emite electrones fácilmente al calentarse.

Radio.
![Propiedades del Radio Numero atómico 88 Configuración electrónica Rn 7 S 2 Radio atómico Propiedades del Radio. Numero atómico. 88 Configuración electrónica. [Rn] 7 S 2 Radio atómico/](https://slidetodoc.com/presentation_image_h/a365f2371583048d3976daa3d6fc7444/image-35.jpg)
Propiedades del Radio. Numero atómico. 88 Configuración electrónica. [Rn] 7 S 2 Radio atómico/ (A) 2. 23 Radio Iónico/ pm 140 510 0. 89 5. 00 700 130 1° Energía de ionización /Kjmol-1 Electronegatividad Densidad /g cm-3 Punto de fusión /° C H sub/ KJ mol-1

Particularidades del Radio. • Es el mas pesado de los alcalinotérreos • Es uno de los mas voluminosos • Es un elemento radioactivo • Los compuestos formados por el radio producen o emiten rayos alfa , meta y gama • Tiene una estructura cristalina cubica centrada en el cuerpo • Fue descubierto por Marie Curie y su marido en 1898

Métodos de obtención. • Se obtiene como resultado de los procesos de desintegración en minerales de torio y uranio. • Puede extraerse mediante lavados durante el procesado de los mismos, obteniéndose como bromuro o cloruro de radio. • Electrólisis de una disolución de cloruro de radio puro con un cátodo de mercurio; la amalgama se destila en atmósfera de hidrógeno y, así, se obtiene el metal puro.

Aplicaciones. Se emplea en pinturas luminosas, ya que, tanto el radio como sus sales presentan luminiscencia. En medicina se emplea para el tratamiento del cáncer
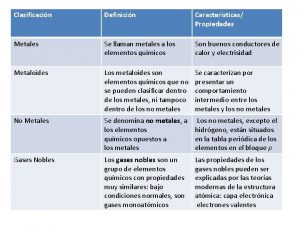
 Características de los metales de la tabla periódica
Características de los metales de la tabla periódica Grupos representativos de la tabla periódica
Grupos representativos de la tabla periódica Los materiales y sus propiedades
Los materiales y sus propiedades Ejemplos de cristales
Ejemplos de cristales Propiedades generales
Propiedades generales Cloro propiedades fisicas y quimicas
Cloro propiedades fisicas y quimicas Propiedades generales de la ciencia
Propiedades generales de la ciencia Propiedades generales de la materia divisibilidad
Propiedades generales de la materia divisibilidad Logaritmo de una raiz propiedades
Logaritmo de una raiz propiedades Aurea propiedades
Aurea propiedades Generalidades de los alquenos
Generalidades de los alquenos Oq é sujeito composto
Oq é sujeito composto Grupo nominal e grupo verbal
Grupo nominal e grupo verbal Constituintes da frase
Constituintes da frase Grupo objeto y grupo sujeto ejemplos
Grupo objeto y grupo sujeto ejemplos Edad de los metales que comian
Edad de los metales que comian Serie de actividad de los metales
Serie de actividad de los metales Calor latente
Calor latente Fogón donde se forjan los metales
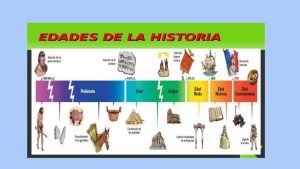
Fogón donde se forjan los metales Division de la prehistoria
Division de la prehistoria Los metales en la historia
Los metales en la historia Imagenes de oxidacion de alimentos
Imagenes de oxidacion de alimentos Radio atomico
Radio atomico Eo del oxigeno
Eo del oxigeno Tabla periódica electronegatividad
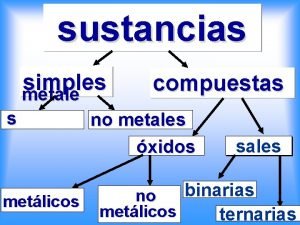
Tabla periódica electronegatividad Unidad 3 metales y aleaciones
Unidad 3 metales y aleaciones Soluciones solidas sustitucionales e intersticiales
Soluciones solidas sustitucionales e intersticiales Edad de los metales
Edad de los metales Oxigeno periodo
Oxigeno periodo Propiedades fisicas de los hidroxidos metalicos
Propiedades fisicas de los hidroxidos metalicos Geco minero artesanal precio metales
Geco minero artesanal precio metales Calor especifico del diamante
Calor especifico del diamante Esquema neolitico
Esquema neolitico Caracteristicas del humanismo
Caracteristicas del humanismo Objetivos específicos de las emociones
Objetivos específicos de las emociones Cuales son las disposiciones generales
Cuales son las disposiciones generales Objetivo general ejemplos
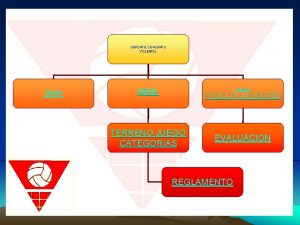
Objetivo general ejemplos Aspectos generales del voleibol
Aspectos generales del voleibol Principios generales de higiene
Principios generales de higiene